INTRODUCCIÓN
El dolor nociceptivo somático es el tipo de dolor causado por la estimulación de fibras nerviosas Aσ mielínica y C amielínica, que se ubican en el sistema tegumentario y en el sistema musculoesquelético superficial y profundo 1. De forma general, las fibras aferentes nociceptivas primarias llegan hasta el asta dorsal de la médula espinal, donde hacen sinapsis con neuronas medulares que transportan la información, principalmente, hasta el tálamo contralateral y desde allí hacia la corteza frontal y somatosensorial 1,2. Por otra parte, hay un complejo circuito neural que conforma el sistema modulador descendente del dolor, dicho circuito parte de áreas corticales y subcorticales donde están implicadas, principalmente, vías serotoninérgicas y opiodérgicas 3.
El estrés es una reacción fisiológica a condiciones reales o potenciales que amenazan la vida y se acompaña de cambios en los sistema nervioso, endocrino e inmune 4. El estrés agudo es una reacción casi inmediata ante estímulos nocivos de diversa naturaleza y que activa al sistema nervioso simpático, resultando en la liberación de adrenalina y noradrenalina. La respuesta endocrina estimula al eje hipotálamo-pituitario-suprarrenal (HPA), con la consecuente liberación de cortisol y diversas citoquinas 4,5. Dichas vías desencadenan diversas respuestas al estrés que incluyen: variaciones en el umbral del dolor, cambios en la actividad locomotora y en múltiples funciones sistémicas 6. El estrés agudo generalmente se asocia con efectos analgésicos; sin embargo, se ha encontrado que puede inducir hiperalgesia con una gran variabilidad interindividual en individuos sanos 7,8, aunque generalmente dicha hiperalgesia se ha encontrado en pacientes que tiene previamente una condición inflamatoria crónica 6,9-11.
Rechinar los dientes o masticar objetos o chicles se consideran como respuestas ante el estrés; encontrándose que dichos comportamientos pueden atenuar diversas patologías inducidas por los estresores 12. Se conoce que la estimulación de las estructuras bucales, como las que intervienen en la masticación, es llevada hacia el neocortex por el complejo sistema sensorial ascendente, el cual llega hasta la corteza frontal y somatosensorial 13. La activación de la corteza somatosensorial, además de diversas áreas superiores, intervienen en la disminución del dolor mediante el sistema modulador descendente 14. La masticación regularía el procesamiento doloroso por medio de una integración sensorio-motriz a través de mecanismos corticales, además, la masticación podría regular el sistema descendente opioide mediante la vía sensorial trigeminal y la corteza somatosensorial resultando en un efecto antinociceptivo 15,16. Así, se ha encontrado que el comportamiento rítmico de la masticación activa neuronas serotoninérgicas lo que mejora la acción de la vía moduladora descendente 17. Diversos estudios han demostrado que la masticación mejora la respuesta anti nociceptiva tanto en individuos sanos como enfermos 18-20; además de reducir la respuesta a diversos marcadores relacionados con el estrés, como el factor de liberación de corticotropina en el hipotálamo (CRF), el proto-oncogén C-fos y la quinasa forforilada regulada por señal extracelular (pERK) 21,22.
A pesar de que algunos estudios concluyen que la masticación disminuye el efecto del estrés agudo sobre la percepción dolorosa, estos estudios son escasos, son heterogéneos en los indicadores que evalúan y son poco recientes. Debido a ello el presente trabajo tuvo como objetivo determinar el efecto del estrés agudo y de la variación del estímulo masticatorio sobre el dolor nociceptivo somático en ratones Balb/c.
MÉTODOS
Diseño de estudio
Se realizó un estudio experimental preclínico, realizado en el Bioterio de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos (UNMSM).
Población y muestra
Se emplearon 40 ratones macho de 8 semanas de edad de la cepa BALB/c que fueron adquiridos del Centro de Producción de Animales de Experimentación del Instituto Nacional de Salud. Luego de una semana de ambientación en el bioterio de la Facultad de Medicina de la UNMSM, los animales fueron divididos aleatoriamente en 5 grupos de 8 animales cada uno. El tiempo del experimento duró 2 semanas, los grupos fueron sometidos a los siguientes tratamientos: semana 1 sin ningún estímulo y en la semana 2 estímulo masticatorio + estrés agudo (grupo A), semana 1 sin ningún estímulo y en la semana 2 estrés agudo (grupo B), semana 1 estrés agudo y en la semana 2 sin ningún estímulo (grupo C), semana 1 estímulo masticatorio + estrés agudo y en la semana 2 sin ningún estímulo (grupos D), y sin ningún estímulo, grupo control (grupo E).
Procedimiento para inducir estímulo masticatorio
El estímulo masticatorio fue inducido en los ratones introduciéndolos dentro de la caja de restricción, en la cual se encontraba cada roedor y una varilla de madera que se le permitió roer a cada animal durante la semana 1 en el grupo D, y durante la semana 2 en el grupo A, respectivamente. Dicha varilla se mantuvo durante todo el tiempo del sometimiento al estrés en los grupos indicados, según el procedimiento propuesto por Kubo et al24 (Figura 1A).
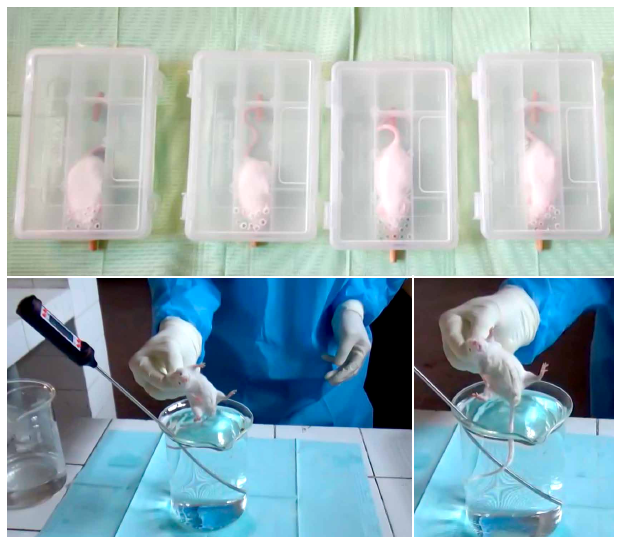
A: Animales sometidos a estrés por restricción y con las varillas de madera para estimular la masticación. B: Implementos empleados en la evaluación del dolor. C: Primer plano de la cola del animal sumergido en el agua temperada.
Figura 1. Procedimientos de Inducción de estrés, estimulo masticatorio y dolor nociceptivo somático en los ratones Balb/c.
Procedimiento para inducir estrés agudo
El estrés agudo fue inducido en cada roedor colocándolo dentro de una caja de poliestireno transparente, de 3 cm de alto, 3 cm de ancho y 8 cm de largo, para restringir su movimiento, pero sin privarle completamente del mismo, según el diseño de Lam-Figueroa et 23. El estrés por restricción de movimiento fue aplicado durante la semana 1 a los grupos C y D, y durante la semana 2 a los grupos A y D, respectivamente. Dicho procedimiento fue realizado durante 1 hora entre las 08:00 horas y 12:00 horas, una vez al día, como se observa en la figura 1A.
Procedimiento para evaluar el dolor nociceptivo somático
Para evaluar la respuesta al dolor nociceptivo somático se empleó la prueba de tiempo de retirada de la cola de ratón ante estímulo térmico. Dicha prueba consistió en la inmersión de la cola del animal dentro de un recipiente con agua temperada (55 ± 1 °C), según el procedimiento de Aguirre-Siancas et al25. La evaluación fue realizada en los 5 grupos experimentales, el día 7 y 14 de iniciado el experimento, como se observa en la figura 1B y 1C. Se contabilizó el tiempo que cada ratón demoró en retirar su cola de la fuente de agua temperada, menores tiempos se relacionan con una mayor percepción y, a la vez, menor umbral al estímulo nociceptivo.
Variables estudiadas
Se evaluó el efecto de las variables independientes: estrés agudo y estímulo masticatorio sobre la variable dependiente: dolor nociceptivo somático. El procedimiento para la medición fue descrito en párrafos previos.
Análisis de datos
Para los análisis estadísticos se empleó el programa SPSS versión 23 para Windows. Debido al comportamiento normal de las variables se aplicó la prueba t de Student para muestras relacionadas y el análisis de varianza (ANOVA) de un factor. El nivel de significancia fue de 0,05.
Aspectos éticos
El protocolo del estudio fue aprobado por el Vicerrectorado de Investigación y Postgrado de la UNMSM con código A20011021 y RR 01686-R-20. La manipulación de los animales se realizó respetando las normas internacionales de uso de animales de experimentación de la Office of Animal Care and Use of National Institutes of Health.
RESULTADOS
Se evaluó el dolor nociceptivo somático en los 5 grupos de roedores con la prueba de ANOVA de un factor a los 7 días, obteniendo como promedio y desviación estándar en el grupo A (3,36 ± 1,74), B (4,51 ± 1,16), C (3,14 ± 0,9), D (3,3 ± 0,73) y E (4 ± 0,87), respectivamente (Figura 2).
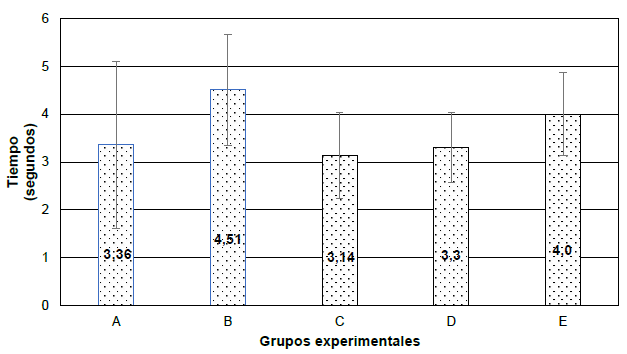
Grupo A: semana 1 sin ningún estímulo y semana 2 estímulo masticatorio + estrés. Grupo B: semana 1 sin ningún estímulo y semana 2 estrés. Grupo C: semana 1 estrés y semana 2 sin ningún estímulo. Grupo D: semana 1 estimulo masticatorio + estrés y semana 2 sin ningún estímulo. Grupo E: control.
Prueba de ANOVA de un factor: 0,13. Estadístico F: 1,93
Figura 2. Evaluación del dolor nociceptivo somático en los grupos experimentales a los 7 días.
También se evaluó el dolor en los 5 grupos experimentales con la prueba de ANOVA de un factor a los 14 días, obteniendo como promedio y desviación estándar en el grupo A (7,20 ± 3,32), B (6,22 ± 1,41), C (5,52 ± 1,67), D (5,36 ± 1,80) y E (7,5 ± 0,55), respectivamente (Figura 3).
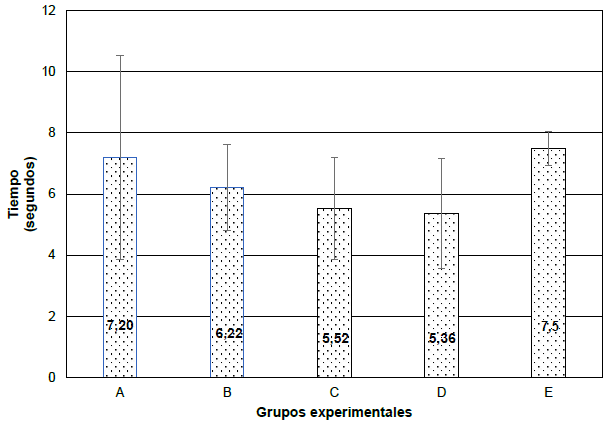
Grupo A: semana 1 sin ningún estímulo y semana 2 estímulo masticatorio + estrés. Grupo B: semana 1 sin ningún estímulo y semana 2 estrés. Grupo C: semana 1 estrés y semana 2 sin ningún estímulo. Grupo D: semana 1 estimulo masticatorio + estrés y semana 2 sin ningún estímulo. Grupo E: control.
Prueba de ANOVA de un factor: 0,18. Estadístico F: 1,69.
Figura 3. Evaluación del dolor nociceptivo somático en los grupos experimentales a los 14 días.
Se compararon, dentro de cada grupo experimental, las respuestas al estímulo nociceptivo entre los 7 y 14 días, encontrándose aumentos en los tiempos de retirada de la cola, de manera significativa, tanto en el grupo A como en el grupo C, como se detalla en la tabla 1.
Tabla 1. Evaluación del dolor nociceptivo somático dentro de cada grupo experimental entre los 7 y 14 días.
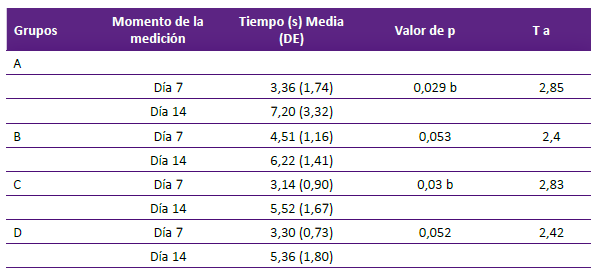
A: semana 1 sin ningún estímulo y semana 2 estímulo masticatorio + estrés. B: semana 1 sin ningún estímulo y semana 2 estrés. C: semana 1 estrés y semana 2 sin ningún estímulo. D: semana 1 estímulo masticatorio + estrés y semana 2 sin ningún estímulo. E: control.
DE: Desviación estándar. T: estadístico T.
a Prueba t de Student para muestras relacionadas, b Diferencia significativa. s: segundos.
DISCUSIÓN
En el presente trabajo, no se encontró diferencia significativa al evaluar a los 5 grupos experimentales entre sí tanto a los 7 como a los 14 días. Dichos resultados nos indicarían que la percepción del dolor nociceptivo somático no se vio influenciado por alguna de la combinación de las variables independientes. Posiblemente el poco tiempo de exposición a dichas variables o la poca intensidad de estas puedan explicar dichos hallazgos. Lo cual concuerda con lo reportado por Aguirre-Siancas et al26, quienes también encontraron que el estrés y la masticación no modifican la respuesta al dolor en ratones. Aunque en ese estudio trabajaron un modelo de estrés crónico y emplearon otro tipo de procedimiento para manipular la función masticatoria. Lo cual también nos puede hacer entender que el estrés, ya sea agudo o crónico, no modificaría la respuesta al estímulo nociceptivo en los procedimientos hechos sobre los ratones albinos de la cepa Balb/c.
Se encontró diferencia significativa en la evaluación dentro del grupo C. Se sabe que uno de los efectos del estrés agudo es estimular la vía de señalización del factor nuclear kappa-beta (NF-κB) y de diversas citoquinas pro inflamatorias como la interleuquina 1beta (IL-1β) y el factor de necrosis tumoral alfa (TNF-α) 27,28, las cuales se relacionan con una mayor percepción a estímulos dolorosos 29, lo cual podría explicar, parcialmente, la disminución del umbral a dicho estímulo en los ratones el día 7; sin embargo, dicha respuesta ya no se observó durante la segunda semana al ya retirarse el estrés por restricción.
Dentro del grupo A se encontró que el tiempo de respuesta a los 7 días, donde no se indujo estímulo alguno fue de 3,36 s y a los 14 días dicho tiempo aumentó a 7,20 s induciéndose durante esa segunda semana estrés + estimulo masticatorio. A diferencia del grupo C, donde el estrés aumentó la percepción dolorosa, en el grupo A, al final de la segunda semana, el aumento del tiempo de respuesta se relacionó con un aumento en el umbral de percepción del estímulo nociceptivo. Es importante destacar el rol que el estímulo masticatorio cumplió al disminuir el efecto del estrés sobre la percepción dolorosa durante esa segunda semana. Estas observaciones encontradas en la prueba comportamental que se empleó se pueden entender, porque hay vías serotoninérgicas activadas por la estimulación masticatoria 20, además la masticación reduce el número de células positivas al CRF en el núcleo paraventricular del hipotálamo, los niveles de c-fos y la pERK, marcadores que aumentan después del estrés 21.
En la literatura no se ha encontrado trabajos que estudien nuestras variables independentes mediante la prueba de tiempo de retirada de la cola de ratón ante estímulo térmico; sin embargo, sí se reportan algunos trabajos que evalúan la masticación y el estrés mediante pruebas hematológicas e inmunohistoquímicas. Yamada et al, 22 y Onuki et al, 30 encontraron en roedores que la estimulación masticatoria, mediante el empleo de una varilla de madera, similar al empleado en el presente trabajo, bajo el sometimiento al estrés agudo por restricción disminuyó la pERK de la sustancia gris periacueductal y de la corteza insular, respectivamente. Dichos estudios coinciden con el nuestro en que la estimulación masticatoria disminuye los efectos del estrés, aunque en nuestro trabajo empleamos una prueba comportamental, como ya se fue indicado, mientras en los estudios referenciados emplearon indicadores inmunohistoquímicos de áreas relacionadas con el procesamiento del dolor.
En humanos, Okayasu, et al19 encontraron que el umbral para el estímulo nociceptivo aumentó en el grupo que masticó goma de mascar sobre el control que no masticó, mientras Kamiya et al20 refieren que la masticación de goma de mascar disminuyó la respuesta nociceptiva y aumentó los niveles sanguíneos de serotonina. Ambos estudios coinciden con lo que encontramos en el grupo A, aunque los trabajos referenciados emplean diferentes paradigmas para estimular la masticación y para evaluar la percepción dolorosa, aparte que son realizados en seres humanos a diferencia de nuestro trabajo.
Dentro de las limitaciones, podemos indicar que el empleo de pruebas hematológicas e inmunohistoquímicas hubiesen permitido una visión más integral y profunda de los fenómenos estudiados. Se concluye que la masticación disminuye el efecto del estrés sobre la respuesta al estímulo nociceptivo, como se encontró durante la segunda semana en el grupo A y, por otra parte, que el estrés aumentó la percepción del estímulo nociceptivo como se encontró durante la primera semana en el grupo C.















