INTRODUCCIÓN
La enfermedad conocida como COVID-19 es el resultado de la infección por el virus del SARS-CoV-2 1. En Colombia, el brote epidémico ha tenido un impacto significativo con más de 6 360 780 casos confirmados y 142 639 defunciones para el 2023 2. Por otro lado, el dengue es una enfermedad endémica que persiste con intensa transmisión en Colombia, el informe disponible hasta abril de 2023 muestra un preocupante aumento en el número de casos, con un total de 32 645 casos, considerándose brote y alerta epidemiológica 3.
La infección por el SARS-CoV-2 tiene una marcada preferencia por el sistema respiratorio, afectando especialmente a las células alveolares, conocidas como neumocitos I y II, debido a la afinidad entre la proteína Spike del virus y los receptores ACE2 4. La complejidad del diagnóstico y tratamiento en la coinfección entre SARS-CoV-2 y dengue aumenta la duración de la hospitalización y mortalidad en el entorno clínico, considerando un gran reto para los profesionales de la salud 5,6.
Es importante destacar que la evidencia sobre la coinfección entre SARS-CoV-2 y DENV es limitada, lo que puede resultar en retrasos de diagnóstico y tratamiento oportuno. Por lo tanto, el objetivo de este reporte es describir el caso de un paciente adulto varón con coinfección por COVID-19 y dengue que tuvo un desenlace fatal, y brindar una explicación fisiopatológica para dicho desenlace. Esta acción no solo contribuirá a una comprensión más profunda de la interacción entre estos dos virus, sino que desempeñará un papel crucial en la mejora de la atención proporcionada por los profesionales de la salud.
El presente reporte de caso ha sido debidamente autorizado por los familiares y se ha obtenido su firma para el consentimiento informado, tanto para su publicación como para su divulgación científica.
REPORTE DE CASO
Paciente masculino de 49 años, originario de Santiago de Cali, auxiliar de enfermería especializado en traslado y toma de muestras de pacientes con sospecha o casos confirmados de COVID-19, con antecedentes patológicos de hipertensión arterial (HTA) y obesidad grado I. El motivo de consulta al servicio de urgencias fue un cuadro clínico de cinco días, caracterizado por dificultad respiratoria, dolor pleurítico, fatiga y artralgias.
En la evaluación física, se observó taquipnea (35 rpm), frecuencia cardíaca (100 lpm), saturación de oxígeno (SaO2) 89% e HTA (150/84 mmHg). Como consecuencia del estado clínico, se decidió ingresar al paciente a la unidad de cuidados intensivos (UCI) y se inició el oxígeno a alto flujo.
Al ingreso al servicio de urgencias se le solicitaron pruebas diagnósticas (Tabla 1) incluyendo PCR-RT para SARS-CoV-2 e IgG/IgM para dengue. Los resultados fueron positivos, lo que confirmó la presencia de coinfección.
Tabla1. Paraclínicos de ingreso al servicio de urgencias
| Laboratorio | Al ingreso | Valores de referencia |
|---|---|---|
| Hemograma | ||
| Leucocitos | 4220 | 4500 - 11 000 |
| Neutrófilos | 3210 | 2000 - 7500 |
| Linfocitos | 0,69 | 1 - 4,80 |
| Plaquetas | 84 000 | 150 000 - 400 000 |
| Marcadores de severidad | ||
| PCR, mg/l | 1,76 | >10 |
| Dímero D, ug/mL | 41,3 | <0,5 |
| LDH, U | 268 | 50 - 150 |
| Ferritina, ng/mL | 1130 | 300 |
| Índice de oxigenación | ||
| Pa/FiO2, mmHg | 353 | <300 |
| Electrolitos | ||
| Na+, mmol/L | 138 | 135 - 145 |
| K+, mmol/L | 3,71 | 3,5 - 5,5 |
| Creatinina, mg/dL | 0,84 | 0,7 - 1,3 |
| BUN, mg/dL | 20,3 | 6 - 20 |
| Bilirrubina, mg/dL | 0,79 | 0,2 - 1 |
| AST, U/L | 92,4 | 8 - 33 |
| INL | 4,1 | 4 - 36 |
| Antígenos | ||
| IgM | Positivo | |
| IgG | Positivo | |
| Ns1 | Positivo |
Fecha de ingreso: 16 de octubre 2020
En UCI el paciente presentó progresión hacia falla respiratoria severa con marcada hipoxemia, requiriendo ventilación mecánica invasiva (VMI) con uso de sedoanalgesia y bloqueantes neuromusculares, adicionalmente se le realizaron varias pruebas (Tabla 2) que incluyeron análisis paraclínicos, gases arteriales, PCR-RT para SARS-CoV-2, pruebas de anticuerpos IgG/IgM para dengue, policultivos (hemocultivo #1: negativo, #2: Staphylococcus epidermidis, urocultivo: negativo; lavado broncoalveolar: recuento mayor de 10.000 UFC/mL de Staphylococcus aureus; secreción traqueal: Staphylococcus aureus) y radiografía de tórax (Figura 1).
Tabla 2. Seguimiento de paraclínicos en cuidados intensivos
| Laboratorio | 18/10/2020 | 6/11/2020 | 10/11/2020 | Valores de referencia |
|---|---|---|---|---|
| Hemograma | ||||
| Leucocitos | 2970 | 22 640 | 55 700 | 4500 - 11 000 |
| Neutrófilos | 2280 | 17 800 | 35 030 | 2000 - 7500 |
| Linfocitos | 5,60 | 2,20 | 7,49 | 1 - 4,80 |
| Plaquetas | 90 000 | 299 000 | 168 000 | 150 000 - 400 000 |
| Marcadores de severidad | ||||
| PCR, mg/l | 1,76 | 13 | 7,4 | >10 |
| Dímero D, ug/mL | 45,9 | <0,5 | ||
| LDH, U | 268 | 50 - 150 | ||
| Ferritina, ng/mL | 1130 | 300 | ||
| Gases arteriales | ||||
| Pa/FiO2, mmHg | 149 | 121 | <300 | |
| pH | 7,40 | 7,03 | 6,98 | 7,35 - 7,45 |
| paCO2, mmHg | 35,3 | 135 | 72 | 35 - 45 |
| paO2, mmHg | 127 | 77 | 72 | 80 - 100 |
| HCO3, mEq/L | 21,8 | 35 | 16,9 | 22 - 26 |
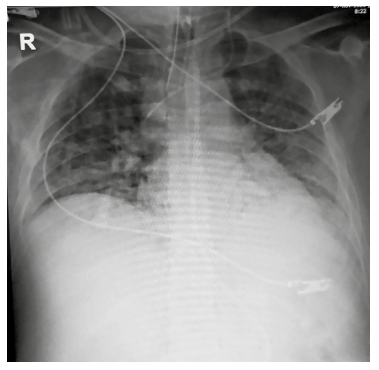
Figura 1. La radiografía de tórax revela una prominencia en la zona que comprende el corazón y los pulmones. Se aprecian numerosas opacidades difusas en el tejido intersticial de ambos pulmones, engrosamiento del tejido que rodea los bronquios bilaterales. También se pueden identificar pequeñas áreas de consolidación, principalmente en la parte inferior izquierda.
Se sospechó la presencia de microangiopatía trombótica relacionada con infección viral, lo que llevó a solicitar pruebas específicas, incluyendo el antígeno del Factor Von Willebrand, actividad FvW y la medición de ADAMST-13.
Se realizó plasmaféresis con reposición de plasma fresco congelado con la intención de atenuar la respuesta inmunitaria exacerbada, sin embargo, no se observaron mejoras clínicas y paraclínicas. Ante la gravedad de la condición del paciente, la posibilidad de infecciones bacterianas secundarias, resultados y hallazgos clínicos se administra tratamiento antimicrobiano de amplio espectro con linezolid 600 mg cada 12 horas y meropenem 2 g cada 8 horas. Además, se consideró terapia antifúngica con caspofungina 50 mg cada 24 horas, debido al riesgo de infección fúngica oportunista. La cual fue elegida por la capacidad de ofrecer una amplia cobertura contra una amplia gama de hongos patógenos, asegurando un enfoque terapéutico integral ante la compleja situación clínica.
El paciente continuó una evolución desfavorable y desarrolló cuadro de choque séptico que no responde al soporte vasoactivo, que incluye noradrenalina, vasopresina 20 UI y azul de metileno 150 mg. Presentó falla multiorgánica requiriendo terapia de reemplazo renal continua, a pesar de seguir rigurosamente las directrices de manejo establecidas por las guías de la American Heart Association (AHA) para el año 2022, el paciente experimentó hipotensión arterial persistente, y, finalmente, presentó arresto cardíaco con ritmo asistolia y fallece.
DISCUSIÓN
Actualmente existe escaza bibliografía sobre la presentación de casos de coinfección por dengue y COVID-19. Según el comportamiento epidemiológico a nivel global, de 1.000.000 de personas se presentan 1,4 millones de casos por COVID-19 y una letalidad de 2,1%, adicionalmente el dengue presenta una tasa de incidencia de 0,5 millones de casos por cada 1.000.000 de personas y una letalidad de 0,6% 7. Ambas presentaron un comportamiento clínico similar que se destaca en una presentación asintomática o con sintomatología poco precisa 8, lo que dificulta la diferenciación y resulta en un diagnóstico tardío en casos con coinfección por dengue y COVID-19. La prevalencia de esta coinfección en población adulta es de un 78,6%, mientras que el 21,4% restante se enfoca en población pediátrica y gestantes 9.
La coinfección del SARS-CoV-2 y el DENV, es una rareza clínica que plantea desafíos significativos en términos de diagnóstico debido a que comparten mecanismos de infección y replicación en la fisiopatología, además de la similitud de síntomas clínicos, entre ellos, disnea, fiebre, artralgias y emesis 10,11. Adicionalmente, se han descrito factores de riesgo para COVID-19, entre ellos, la hipertensión arterial y edades entre 41 y 60 años, datos que coinciden con el caso reportado 12.
Aunque el mecanismo fisiopatológico de la coinfección aún no se comprende completamente, existen informes de casos que han arrojado información sobre esta condición clínica. Una hipótesis fisiopatológica sugiere que podría relacionarse con activación temprana de anticuerpos subóptimos que desencadena inflamación sostenida, proporcionando un entorno propicio para la replicación continua del virus SARS-CoV-2 13.
Existe evidencia que involucra pacientes con coinfección de SARS-CoV-2 y DENV, diagnosticados con signos de alarma, entre ellos, trombocitopenia, leucopenia y múltiples complicaciones que determinan la decisión de ingreso a UCI, requiriendo VMI, terapia vasopresora y antibióticos. Sin embargo, un deterioro progresivo de las condiciones clínicas destaca la complejidad en las coinfecciones y el impacto significativo en la evolución clínica 14,15.
Asimismo, la coinfección desencadena complejas cascadas inflamatorias desreguladas que resultan en daño del endotelio pulmonar como vascular, amplifica la permeabilidad vascular al máximo, favorece la acumulación de líquido en los alvéolos, provocando activación de macrófagos y liberación de factores, como el factor de necrosis tumoral alfa (TNF-α), interferón gamma (IFN-γ), factor nuclear kappa B (NF-κB) y factor estimulante de colonias de granulocitos y macrófagos (GM-CSF), entre otros 16,17. Estos mecanismos conllevan al aumento del material genético viral (ARN) en el citoplasma, que aumenta la cantidad de copias virales circulantes en el organismo, que inducen mayor activación macrofágica, monocitos y producción del factor de crecimiento endotelial vascular (VEGF), factor de crecimiento derivado de plaquetas (PDGF) y TNF-α 18. Finalmente se provoca apoptosis plaquetaria, activación del tromboxano A2 y prostaciclina, causando adherencia plaquetaria y formación de trombos, que limita aún más el flujo sanguíneo y agrava la hipoxemia 19.
En las etapas terminales de COVID-19, la coagulopatía se asocia con un aumento de marcadores de gravedad, como el dímero D, fibrinógeno, factor de Von Willebrand y desintegrina y metaloproteasa con motivo de trombospondina tipo 1 no. 13 (ADAMST-13). Esta elevación resulta en trastornos sistémicos de la coagulación, como la coagulación intravascular diseminada y la microangiopatía trombótica. La tormenta de citoquinas desregulada con el TNF-α eleva los niveles de protrombina e inhibe la modulación de la trombina, lo cual produce incremento en la formación de trombos a nivel distal y al desarrollo de una falla multiorgánica, generando un pronóstico sombrío y de gravedad 20.
Un aspecto crucial para tener en cuenta es la tendencia a obtener resultados positivos falsos en las pruebas serológicas de IgG e IgM para el dengue. Esta situación se origina debido a la exposición previa del DENV, desencadena una respuesta inmunológica que puede confundirse con una coinfección. Sin embargo, es importante destacar que las pruebas de reacción en la RT-PCR son altamente específicas en la detección del COVID-19, permitiendo un diagnóstico preciso en casos de coinfección 21.
El paciente transitó una prolongada estadía en UCI debido a una neumonía originada por la infección del SARS-CoV-2 que desencadenó una hipoxemia refractaria. Durante el tratamiento con VMI adquirió una infección nosocomial que generó un síndrome de respuesta inflamatoria sistémica, manifestado con un aumento significativo en los recuentos de leucocitos, neutrófilos y episodios febriles. Sin embargo, este cuadro evolucionó hacia un estado de choque distributivo severo que no respondió a las dosis elevadas de vasopresores. Los análisis de gases arteriales revelaron una acidosis mixta con marcados niveles de acidemia respiratoria e hipoxemia, indicando la presencia de choque séptico refractario y falla orgánica múltiple que resultaron resistentes a la VMI, diálisis, terapia vasopresora y tratamiento antimicrobiano.
En la actualidad, el tratamiento de la enfermedad sigue siendo un área en evolución, y constantemente se están realizando nuevos descubrimientos fisiopatológicos de la enfermedad que eventualmente nos permitirán mejorar la forma en que la abordamos. Sin embargo, cuando se trata de un paciente de edad avanzada con comorbilidades significativas y un extenso compromiso pulmonar, es probable que la evolución siga siendo desfavorable, incluso si aplicamos las mejores prácticas terapéuticas disponibles.
En conclusión, el pronóstico de pacientes críticos con marcadores de severidad es un desafío complejo debido a la interacción entre el paciente, entorno clínico y los tratamientos. La investigación constante es crucial para desarrollar tratamientos efectivos y diagnósticos tempranos, permitiendo una intervención oportuna y una respuesta más efectiva a las complejidades clínicas.















