INTRODUCCIÓN
El síndrome de antidiuresis inadecuada (SADI) es una entidad con una baja frecuencia de presentación, caracterizada por elevación en los niveles de vasopresina plasmática, producto de una alteración en el eje hipotálamo-neurohipófisis por una falla en la respuesta regulatoria osmótica o por factores no osmóticos 1-3. con frecuencia se asocia a neoplasias entre ellas el cáncer de pulmón, trastornos del sistema nervioso central (SNC), enfermedad pulmonar crónica y/o medicación 4-6.
Las complicaciones de este síndrome están en relación directa al grado de hiponatremia, puede comprometer la calidad de vida y es potencialmente mortal 7-9. El tratamiento del SADI consiste en un control adecuado y oportuno de la hiponatremia, así como la búsqueda de la etiología 9,10.
Presentamos el caso de un paciente adulto con el diagnóstico de SADI y trastorno neurocognitivo asociado que respondió favorablemente al tratamiento hospitalario con urea. Es relevante destacar que este paciente no aceptó el tratamiento con litio, y la falta de disponibilidad de vaptanes o demeclociclina en Perú fue un factor limitante en las opciones terapéuticas 11-14.
Este manuscrito fue elaborado siguiendo las guías CARE para reporte de casos y se obtuvo el consentimiento del paciente para la publicación del artículo.
REPORTE DE CASO
Varón de 56 años, autosuficiente, con antecedente de consumo habitual de alcohol e ingesta de bebidas azucaradas no mayor a 2 litros diarios e historia de dos ingresos en urgencias de centro médico en los últimos seis meses por crisis epilépticas tratadas con fenitoína endovenosa (dosis 10 mg/kg de peso), con posterior autolimitación de las crisis epilépticas, sin prescripción posterior de continuación de dicho medicamento y sin un estudio etiológico.
El paciente ingresó al servicio de emergencia de un hospital de referencia nacional de Perú por un nuevo evento de crisis epiléptica tónico-clónico generalizada autolimitada. El examen clínico de ingreso fue normal. Se realizó una tomografía de encéfalo sin evidencia de alteraciones estructurales (Figura 1).
Se realizaron exámenes laboratoriales que tuvieron los siguientes valores: glucosa: 90 mg/dL, urea: 17 mg/dL, creatinina: 0,63 mg/dL y sodio (Na): 123 mEq/L, osmolaridad sérica: 253 mOsm/L, osmolaridad efectiva: 251 mOsm/L, potasio (K): 3,97 mEq/L, cloro (Cl): 91,9 mEq/L, sodio urinario: 302 mEq/L (valor normal: 40 a 220), ácido úrico: 1,9 mg/dL, cortisol sérico: 12,5 mg/dL (valor normal: 5 a 25), TSH: 0,73 mUI/L (valor normal: 0,4 a 4), T4 libre: 1,20 ng/dL (valor normal : 0,8 a 1,9).
Por el hallazgo de hiponatremia, el paciente recibió solución salina al 3% a 80 cc/hora durante las primeras 24 horas, con aumento de sodio a 129 mEq/L. Posteriormente, se reguló la infusión a 30 cc/hora y al completar las 72 horas de inicio de infusión, la natremia fue de 123 mEq/L con una diuresis de 1500 cc y balance hídrico positivo de 1776 cc.
Al quinto día del ingreso por persistencia de hiponatremia (valor mínimo de Na: 121 mEq/L) se agregaron cápsulas de cloruro de sodio (4 gramos/día) y se decidió hospitalización en el servicio de endocrinología para estudio y tratamiento de hiponatremia.
No se pudo realizar el estudio de vasopresina en plasma por no estar disponible en nuestro centro. Los hallazgos de los exámenes laboratoriales se analizaron por médicos de la unidad concluyendo en un cuadro compatible con SADI.
La evaluación neurológica tuvo un puntaje de 16 en la escala de la evaluación cognitiva de Montreal y reportó deterioro cognitivo multidominio moderado, con predominio en la autorregulación de la flexibilidad cognitiva, la memoria operativa y mnésica.
Respecto al estudio etiológico del SADI, la analítica fue negativa para enfermedad autoinmune, neoplásica e infecciosa. Se realizó una resonancia magnética cerebral que mostró signos de atrofia cerebral a nivel fronto-temporal (Figura 2) y una tomografía por emisión de positrones con fluoro dexosiglucosa (18F-FDG PET-CT) de encéfalo con ausencia de lesión hipermetabólica focal y con hipometabolismo mesial temporal derecho (Figura 3).
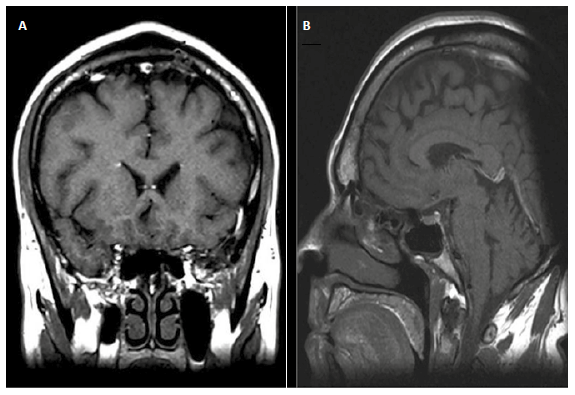
Figura 2. Resonancia de encéfalo con atrofia a nivel fronto-temporal. Ponderación T1. Corte coronal y sagital.
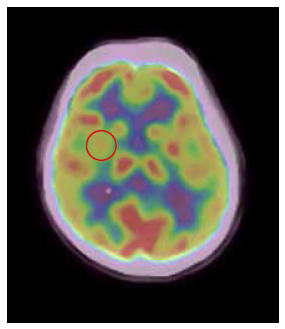
Figura 3. Corte Axial que muestra hipometabolismo a nivel temporal mesial derecho y ausencia de lesión hipermetabólica focal.
Luego de culminada la evaluación diagnóstica, se concluyó en el diagnóstico de SADI idiopático. Se aumentó el aporte de sal a 15 gramos diarios y se añadió furosemida 40 mg/día vía oral (VO) por 5 días, logrando Na sérico de 126 mEq/L con caída inmediata de natremia posterior al retiro de furosemida (Na: 120 mEq/L), diuresis de 1650 cc y un balance hídrico negativo de 680 cc.
Por la persistencia de la hiponatremia a pesar de las intervenciones previamente descritas, la negativa por parte del paciente de usar carbonato de litio y la no disponibilidad de vaptanes y demeclociclina en Perú, se decidió usar fórmula de urea oral cada 8 horas (Fórmula magistral: 10 g de Urea, 2 g de bicarbonato de sodio, 1,5 g de ácido cítrico y 200 mg de sacarosa, disuelto en 100 mL de agua).
En el control el paciente logró un aumento de natremia a las 96 horas de iniciada la fórmula de úrea (Na: 129 mEq/L). Se mantuvo el tratamiento con urea a dosis de 10 g al día asociado a cápsulas de 4 g de cloruro de sodio al día. El alta médica fue dada, continuando con la misma terapéutica por un mes con valores de sodio sérico control encima de 125 mEq/L. El paciente tuvo una buena evolución sin recurrencia de crisis epiléptica y mejora del trastorno neurocognitivo (Evaluación Cognitiva de Montreal de 22 puntos). El resumen de la evolución de natremia según terapéutica durante la estancia hospitalaria se resume en la tabla 1.
Tabla 1. Valores de laboratorio durante hospitalización.
| Momento de medición | Terapéutica | Na+sérico (mEq/L) | Osmolaridad sérica (mOsm/Kg) | Osmolaridad efectiva (mOsm/Kg) |
|---|---|---|---|---|
| Ingreso Emergencia | Solución salina hipertónica (80 cc/h) | 124 | 258,16 | 255 |
| 24 horas | Solución salina hipertónica (30 cc/h) | 129 | 265,78 | 258,8 |
| 72 horas | Solución salina hipertónica (30 cc/h) | 123 | 253,83 | 251 |
| Quinto día | Solución salina hipertónica (41 cc/h) + Cápsulas de NaCl (4 g al día) | 121 | 253 | 251 |
| Sexto día | Solución salina hipertónica (41 cc/h) + Na en dieta mínimo 6 g + Cápsulas de NaCl ( 6g al día) | 126 | 252,7 | 245,9 |
| Segunda semana | Solución salina hipertónica (41 cc/h) + Cápsulas de NaCl (15 g al día) + Furosemida 40 mg al. día | 126 | 264 | 257,9 |
| 48 horas posterior a retiro de furosemida | Solución salina hipertónica (10 cc/h) + Cápsulas de NaCl (15 g al día) | 120 | 252,7 | 245,9 |
| Inicio de fórmula con urea | Cápsulas de urea oral + Cápsulas de NaCl (15 g al día) | 121 | 254,07 | 248 |
| 96 horas después de tratamiento con urea | Cápsulas de urea oral + Cápsulas de NaCl (10 g al día) | 129 | 270 | 264 |
| Alta médica | Cápsulas de urea oral + Cápsulas de NaCl (4 g al día) | 125 | 262,07 | 256 |
Posteriormente al primer control ambulatorio, se reportó poca adherencia al tratamiento sumado a la dificultad para conseguir urea de manera ambulatoria, por lo que se suspendió el tratamiento con urea, presentando una evolución estacionaria hasta los 6 meses de seguimiento y descontinuando sus atenciones por consulta externa.
DISCUSIÓN
El SADI es un diagnóstico de exclusión, se debe investigar otras etiologías de hiponatremia (potomania, síndrome perdedor de sal o reseteo de osmorreceptores) 2,11,12,15. Nuestro paciente cumple con los criterios diagnósticos de SADI establecidos por Bartter y Schwartz, así mismo para determinar la etiología de este síndrome, el estudio hormonal e imágenes no evidenciaron alteraciones, ni uso de drogas, por lo que se concluyó en el diagnóstico de SADI idiopático 1,2,4.
En el tratamiento de la hiponatremia crónica, la administración de solución salina hipertónica, ya sea mediante bolo o infusión continua, se ha mostrado efectiva para lograr una corrección rápida de 6 a 8 mEq/L en un período de 24 horas. La decisión de suspender este tratamiento recae en el médico tratante, quien evalúa la ausencia de síntomas moderados o graves de hiponatremia, el nivel de sodio alcanzado en las primeras 24 horas y la capacidad del paciente para tolerar la ingesta de alimentos por vía oral. En caso de que se determine la viabilidad, se puede iniciar el tratamiento con aporte de sal, con una cantidad que puede llegar hasta 18 g al día 3,4,5,14.
Según el cálculo de la fórmula de Furst, se determinó que la restricción hídrica con un valor igual o superior a 1 no sería efectiva. Esto indica que la nefrona no elimina agua libre de manera significativa. Ante esta situación, se exploraron alternativas para elevar los niveles de natremia 16.
El empleo de furosemida se consideró como una medida para aumentar el aclaramiento de agua libre a través de la nefrona, y se demostró su eficacia en este paciente con una osmolaridad urinaria superior a 350. Este enfoque se respalda en la literatura, donde se describe la utilidad de la furosemida en el tratamiento inicial de la hiponatremia. A pesar de las opciones disponibles, el paciente rechazó el uso fuera de etiqueta del carbonato de litio. Además, la falta de disponibilidad de demeclociclina limitó las opciones terapéuticas. Este escenario subraya la importancia de considerar alternativas viables y personalizadas en el tratamiento, adaptándose a la situación del paciente 17. Algunas revisiones de tratamiento de SADI crónico recomiendan el uso de vaptanes como una alternativa útil en no candidatos a restricción hídrica ni a furosemida, pero este fármaco no estaba disponible en nuestro país 18-21.
El uso previo de la solución de urea se ha descrito en una serie de 58 pacientes con hiponatremia, en donde se reportó un aumento 6 mEq/L de sodio a las 24 horas. En otros artículos, se ha reportado su uso en pacientes con SIHAD presentando elevaciones de natremia en los siguientes 4 a 5 días y pocos efectos adversos 12,18,22,23. En nuestro caso se administró 28 mg al día, con un seguimiento de la respuesta positiva tras evidenciar la elevación de la natremia mínimo de 2 mmol/l cada día durante 2 días seguidos.
La urea al ser un soluto que se excreta en orina, favoreciendo la eliminación de agua libre en orina, origina una diuresis osmótica al interferir en la reabsorción de agua en toda la nefrona. Por lo que se ha planteado utilizarlo en casos de hiponatremia euvolémica o hipervolémica con síntomas leves a moderados, con una dosis de aporte de 7,5 a 90 g/día. En casos de hiponatremia con síntomas moderados a graves se puede administrar 0,25 a 0,5 g/kg de urea y la dosis en paciente adulto mayor es 15 g cada 12 horas 22,23.
Se ha reportado que el uso de urea se puede asociar a una hipercorrección inicial de sodio, deshidratación franca en caso de adultos mayores que no beban agua libremente, además, puede inducir nauseas interfiriendo con la ingesta del paciente 24-26.
Se debe considerar que el tratamiento y seguimiento del paciente con hiponatremia se realiza en función de la gravedad neurológica, diagnóstico y características del paciente, siendo necesaria la reevaluación para asegurar que la terapia sea indicada en cada momento (26. En el caso de nuestro paciente no se pudo realizar un tratamiento continuo con urea y el control ambulatorio no se pudo realizar más allá de los 6 meses del egreso hospitalario, por lo que no se puede descartar una recurrencia de su sintomatología neurológica posterior a ello.
En conclusión, se reporta el caso de un paciente peruano adulto con síndrome de antidiuresis inadecuada idiopático y trastorno neurocognitivo asociado, con una respuesta favorable al tratamiento con urea durante hospitalización, la cual puede ser una opción terapéutica por considerar en los pacientes con afección de este síndrome. Es importante el seguimiento adecuado y adherencia al tratamiento para evitar posibles recurrencias del cuadro clínico en estos pacientes.