INTRODUCCIÓN
La leishmaniasis es una enfermedad parasitaria crónica causada por protozoos flagelados del género Leishmania. Según la Organización Mundial de la Salud (OMS) es una enfermedad desatendida y de distribución global. Afecta, principalmente, países en vías de desarrollo, con al menos 2 millones de nuevos casos y alrededor de 30 000 muertes al año. En los últimos años, se ha observado un incremento en el número de casos, debido al desarrollo urbano, la deforestación, el cambio climático y la migración de personas a áreas donde la enfermedad es endémica 1,2.
La trasmisión se produce a través de la picadura de un mosquito infectado conocido como flebótomo. Esta enfermedad está presente en numerosas regiones tropicales y subtropicales a nivel mundial, siendo endémica en aproximadamente 100 países 3-5. La forma más común de leishmaniasis es la cutánea (LC) con 0,7 a 1,3 millones de casos nuevos cada año en el mundo. LC tiene tres formas diferentes: leishmaniasis cutánea localizada (LCL), leishmaniasis cutánea difusa (LCD) y leishmaniasis mucocutánea (LMC). La leishmaniasis visceral (LV) es la forma más grave de leishmaniasis 4,6.
La conexión entre la pobreza y el riesgo de leishmaniasis es estrecha y está mediada por factores ecológicos y malas condiciones de la vivienda, como grietas en paredes y pisos de tierra húmedos que favorecen la supervivencia del vector y las puertas que permiten la entrada de los flebótomos, entre otros 7. Las malas condiciones de saneamiento ambiental, la falta de medidas de protección personal, la migración y el empleo informal, también incrementan el riesgo de exposición con flebótomos infectados 8. La mayor incidencia ocurre en áreas con amplia vegetación, con periodos de precipitaciones pluviales y temperatura media anual alta 9.
Durante las últimas décadas, investigaciones en América del Sur han demostrado que la urbanización y la deforestación pueden alterar la dinámica de la leishmaniasis, trasladando el riesgo a espacios más poblados a medida que los reservorios (mamíferos salvajes) y los vectores (flebótomos) se adaptan a los ecosistemas alterados 10.
En Perú, la mayor trasmisión ocurre principalmente fuera la vivienda, en centros poblados de la sierra y selva 10, y está favorecida por las condiciones eco ambientales de estas zonas 11. En Perú se reporta trasmisión autóctona de leishmaniasis en 18 departamentos 12; sin embargo, se desconoce la cantidad de población potencialmente expuesta a la enfermedad, considerando la residencia en distritos con trasmisión conocida. Este estudio tuvo como objetivo el cuantificar la población que reside en escenarios de trasmisión a nivel distrital e identificar algunas características de las poblaciones afectadas por esta enfermedad; a fin de contribuir a la implementación de intervenciones según escenarios.
MÉTODOS
Diseño de estudio
Se realizó un estudio descriptivo, trasversal, de tipo ecológico. Fueron analizados datos de fuentes secundarias de casos de leishmaniasis e indicadores socioeconómicos obtenidos de publicaciones y datos de acceso público, de diferentes instituciones del país.
Definición de caso
La población de estudio incluye los casos de leishmaniasis notificados al sistema nacional de vigilancia epidemiológica en el periodo 2010 al 2022. Se consideran las definiciones de caso de LC y LMC, establecidas para el sistema nacional de vigilancia epidemiológica en Perú 13. Estas definiciones se han mantenido sin cambio durante el periodo de estudio.
Variables y fuente de datos
Las variables del presente estudio fueron año de notificación, número de casos de leishmaniasis según tipo (cutánea, mucocutánea) y condición (probables y confirmados), sexo, grupo de edad (etapas de vida establecidas por el Ministerio de Salud), distrito de procedencia, región natural y población distrital. Además, fueron incluidas variables socioeconómicas como pobreza monetaria, índice de desarrollo humano (IDH) y necesidades básicas insatisfechas (NBI) estratificadas en quintiles. Todas las variables fueron medidas a nivel distrital.
Se definió como pobreza monetaria, aquella situación en que el gasto per cápita mensual está por debajo del valor de una canasta básica 14. El IDH se calculó como una medida resumen considerando: esperanza de vida, nivel educativo y la media del producto interno bruto 15. Las NBI incluyeron variables relacionadas con necesidades estructurales. El Instituto Nacional de Estadística e Informática (INEI) estima las necesidades básicas insatisfechas considerando los siguientes indicadores: porcentaje de población que reside en viviendas: con características físicas inadecuadas, con hacinamiento, sin desagüe, con niños que no asisten a la escuela y con alta dependencia económica 16.
La base de los casos de leishmaniasis notificados entre los años 2010-2022 incluyó información de año de notificación, número de casos de leishmaniasis según tipo (cutánea, mucocutánea), sexo, grupo de edad (etapas de vida establecidas por el Ministerio de Salud), distrito de procedencia. Esta base fue descargada de la Sala de Situación Virtual, que actualiza semanalmente el Centro Nacional de Epidemiologia, Prevención y Control de Enfermedades (CDC) del Ministerio de Salud del Perú (17.
Los datos del tamaño poblacional fueron obtenidos del archivo de población estimada por edades simples y grupos de edad, según departamento, provincia y distrito del año 2022, proporcionada al CDC por la Oficina General de Tecnologías de la información del Ministerio de Salud. La información de distritos según región natural se obtuvo de la plataforma nacional de datos abiertos del gobierno del Perú 18.
La información de pobreza monetaria fue obtenida de la publicación del INEI, Mapa de Pobreza Monetaria Provincial y Distrital 2018 19. Los datos del IDH del año 2019 fueron obtenidos de la página web del Instituto Peruano de Economía 20. La información de NBI a nivel distrital fue obtenida de publicaciones del INEI, elaboradas a partir de los Censos Nacionales 201721.
Los distritos fueron clasificados en tres áreas de trasmisión: a) áreas con trasmisión continua definido como distritos que presentaron en promedio 1 o más casos por año para el periodo de estudio, b) áreas con trasmisión esporádica definido como distritos que presentaron en promedio < 1 caso por año, y c) áreas sin transmisión fueron aquellos distritos que no reportaron casos durante el periodo de estudio.
Análisis de datos
Se realizó el análisis descriptivo mediante el recuento de casos, porcentajes, estimación de la incidencia acumulada anual media, la cual fue obtenida dividiendo el número de casos en el periodo de estudio 2010-2020, entre la población de los distritos para el 2022. Se estimó la incidencia acumulada por cada 10 000 habitantes.
Se realizó el análisis bivariado mediante el cálculo de razón de incidencias acumuladas, considerando casos de áreas con trasmisión y las variables sexo, etapas de vida, región natural, pobreza monetaria, IDH y NBI. Los resultados fueron presentados en tablas de contingencia y tablas compuestas, considerando medidas de frecuencia absoluta (número de casos) y relativa. (porcentajes, incidencia acumulada media anual y razón de incidencias acumuladas).
Los datos obtenidos fueron organizados en una hoja de cálculo Excel, se utilizó el programa libre Epidat v3.1 para los cálculos de asociación mediante la prueba de chi cuadrado y el cálculo de intervalos de confianza al 95% para las razones de incidencia acumulada; asimismo, se utilizó el software QGIS v3.4 para la elaboración del mapa.
RESULTADOS
En Perú, durante el periodo de estudio, 7 374 007 (22,08%) habitantes vivían en áreas de trasmisión continua de leishmaniasis, 11 467 420 (34,33%) habitantes residían en áreas trasmisión esporádica y 14 558 983 (43,59%) personas en áreas sin trasmisión. En total 18 841 427 (56,41%) habitantes vivían en algún área de trasmisión (continua o esporádica) de leishmaniasis. Entre el 2010-2022, 543 distritos presentaron trasmisión continua, 454 distritos trasmisión esporádica y 893 distritos no presentaron trasmisión (Tabla 1).
Tabla 1. Distribución del número de distritos y población por departamentos y áreas con casos y transmisión de leishmaniasis, Perú 2010 - 2022.
| Departamento | Área con trasmisión continua | Área con transmisión esporádica | Área sin transmisión | Total | ||||
|---|---|---|---|---|---|---|---|---|
| Número de Distritos | Poblacióna | Número de Distritos | Poblacióna | Número de Distritos | Poblacióna | Distritos | Poblacióna | |
| Amazonas | 48 | 368 710 | 28 | 54 958 | 8 | 5847 | 84 | 429 515 |
| Ancash | 59 | 671 257 | 59 | 396 024 | 48 | 127 299 | 166 | 1 194 580 |
| Apurímac | 8 | 112 624 | 41 | 231 438 | 36 | 85 874 | 85 | 429 936 |
| Arequipa | 0 | 0 | 5 | 216 333 | 104 | 1 337 918 | 109 | 1 554 251 |
| Ayacucho | 15 | 141 503 | 33 | 270 558 | 76 | 258 906 | 124 | 670 967 |
| Cajamarca | 83 | 1 110 304 | 27 | 207 719 | 17 | 136 461 | 127 | 1 454 484 |
| Callao | 0 | 0 | 2 | 919 974 | 5 | 251 684 | 7 | 1 171 658 |
| Cusco | 19 | 297 844 | 17 | 205 624 | 80 | 877 292 | 116 | 1 380 760 |
| Huancavelica | 0 | 0 | 24 | 112 149 | 78 | 238 936 | 102 | 351 085 |
| Huánuco | 37 | 594 302 | 32 | 126 051 | 15 | 34 927 | 84 | 755 280 |
| Ica | 0 | 0 | 2 | 110 719 | 41 | 909 335 | 43 | 1 020 054 |
| Junín | 16 | 413 060 | 17 | 444 886 | 91 | 516 696 | 124 | 1 374 642 |
| La Libertad | 35 | 384 465 | 20 | 865 178 | 28 | 827 846 | 83 | 2 077 489 |
| Lambayeque | 5 | 134 053 | 12 | 667 329 | 21 | 537 649 | 38 | 1 339 031 |
| Lima | 57 | 102 453 | 46 | 4 472 825 | 68 | 6 411 021 | 171 | 10 986 299 |
| Loreto | 34 | 873 973 | 16 | 166 450 | 3 | 4484 | 53 | 1 044 907 |
| Madre de Dios | 11 | 185 496 | 0 | 0 | 0 | 0 | 11 | 185 496 |
| Moquegua | 0 | 0 | 1 | 71 752 | 20 | 125 688 | 21 | 197 440 |
| Pasco | 10 | 105 712 | 12 | 123 054 | 7 | 40 575 | 29 | 269 341 |
| Piura | 20 | 327 953 | 11 | 876 691 | 34 | 898 489 | 65 | 2 103 133 |
| Puno | 8 | 65 191 | 27 | 723 966 | 75 | 437 506 | 110 | 1 226 663 |
| San Martin | 61 | 880 000 | 16 | 42 294 | 1 | 2222 | 78 | 924 516 |
| Tacna | 0 | 0 | 0 | 0 | 28 | 384 342 | 28 | 384 342 |
| Tumbes | 0 | 0 | 4 | 151 562 | 9 | 107 986 | 13 | 259 548 |
| Ucayali | 17 | 605 107 | 2 | 9886 | 0 | 0 | 19 | 614 993 |
| Total | 543 | 7 374 007 | 454 | 1 1467 420 | 893 | 14 558 983 | 1890 | 33 400 410 |
a Población año 2022
Área con trasmisión continua: Área con 1 a más casos por año en promedio
Área con trasmisión esporádica: Área con < 1 caso/año en promedio
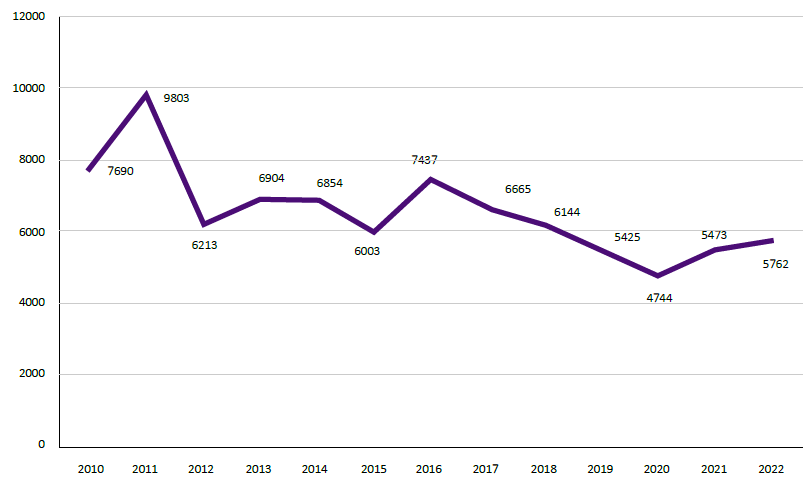
A nivel nacional, durante el periodo 2010-2022 fueron reportados 85 117 casos, el mayor número ocurrió en el 2011 y el menor en el 2020 (Figura 1). Del total, 83 551 (98,16%) casos ocurrieron en los distritos con trasmisión continua, mientras que en los distritos con trasmisión esporádica ocurrieron 1566 (1,84%) casos.
Son 18 departamentos con distritos con trasmisión continua, seis departamentos (Cusco, Madre de Dios, San Martin, Piura, Junín y Cajamarca) concentraron 48 971 (57,53%) casos. Los departamentos de Huancavelica, Tumbes, Arequipa, Ica, Moquegua y la provincia constitucional del Callao solo tuvieron distritos con trasmisión esporádica. Mientras que Tacna no tuvo distritos con trasmisión de leishmaniasis (Tabla 2, Figura 2).
Tabla 2. Población distrital por departamentos de áreas con trasmisión y reporte de casos e incidencia acumulada media anual de leishmaniasis, Perú 2010 - 2022.
| Departamento | Área con trasmisión continua | Área con trasmisión esporádica | Total 2010 - 2022 | |||||
|---|---|---|---|---|---|---|---|---|
| Casos | Población | Casos | Población | Casos | % | Incidencia acumulada media anual (IA) x 10 000 hab. | Razón de IA departamental sobre nacional | |
| Madre de Dios | 10 236 | 185 496 | 0 | 0 | 10 236 | 12,03 | 42,45 | 12,20 |
| Cusco | 10 272 | 297 844 | 59 | 205 624 | 10 331 | 12,14 | 15,78 | 4,54 |
| Amazonas | 4598 | 368 710 | 138 | 54 958 | 4736 | 5,56 | 8,60 | 2,47 |
| San Martin | 8973 | 880 000 | 76 | 42 294 | 9049 | 10,63 | 7,55 | 2,17 |
| Pasco | 1696 | 105 712 | 42 | 123 054 | 1738 | 2,04 | 5,84 | 1,68 |
| Junín | 6198 | 413 060 | 60 | 444 886 | 6258 | 7,35 | 5,61 | 1,61 |
| Ucayali | 3574 | 605 107 | 5 | 9886 | 3579 | 4,20 | 4,48 | 1,29 |
| Piura | 6810 | 327 953 | 49 | 876 691 | 6859 | 8,06 | 4,38 | 1,26 |
| Huánuco | 3695 | 594 302 | 144 | 126 051 | 3839 | 4,51 | 4,10 | 1,18 |
| Cajamarca | 6101 | 1 110 304 | 137 | 207 719 | 6238 | 7,33 | 3,64 | 1,05 |
| Ancash | 4240 | 671 257 | 181 | 396 024 | 4421 | 5,19 | 3,19 | 0,92 |
| Puno | 3037 | 65 191 | 73 | 723 966 | 3110 | 3,65 | 3,03 | 0,87 |
| Ayacucho | 1448 | 141 503 | 85 | 270 558 | 1533 | 1,80 | 2,86 | 0,82 |
| Loreto | 3630 | 873 973 | 102 | 166 450 | 3732 | 4,38 | 2,76 | 0,79 |
| La Libertad | 3522 | 384 465 | 63 | 865 178 | 3585 | 4,21 | 2,21 | 0,63 |
| Lambayeque | 1702 | 134 053 | 17 | 667 329 | 1719 | 2,02 | 1,65 | 0,47 |
| Apurímac | 190 | 112 624 | 127 | 231 438 | 317 | 0,37 | 0,71 | 0,20 |
| Lima | 3629 | 102 453 | 155 | 4 472 825 | 3784 | 4,45 | 0,64 | 0,18 |
| Huancavelica | 0 | 0 | 39 | 112 149 | 39 | 0,05 | 0,27 | 0,08 |
| Tumbes | 0 | 0 | 4 | 151 562 | 4 | 0,00 | 0,02 | 0,01 |
| Arequipa | 0 | 0 | 5 | 216 333 | 5 | 0,01 | 0,02 | 0,01 |
| Ica | 0 | 0 | 2 | 110 719 | 2 | 0,00 | 0,01 | 0,00 |
| Moquegua | 0 | 0 | 1 | 71 752 | 1 | 0,00 | 0,01 | 0,00 |
| Callao | 0 | 0 | 2 | 919 974 | 2 | 0,00 | 0,00 | 0,00 |
| Tacna | 0 | 0 | 0 | 0 | 0 | 0,00 | 0,00 | 0,00 |
| Total | 83 551 | 7 374 007 | 1566 | 11 467 420 | 85 117 | 100,00 | 3,48 | 1,00 |
Área con trasmisión continua: Área con 1 a más casos por año en promedio
Área con trasmisión esporádica: Área con < 1 caso/año en promedio
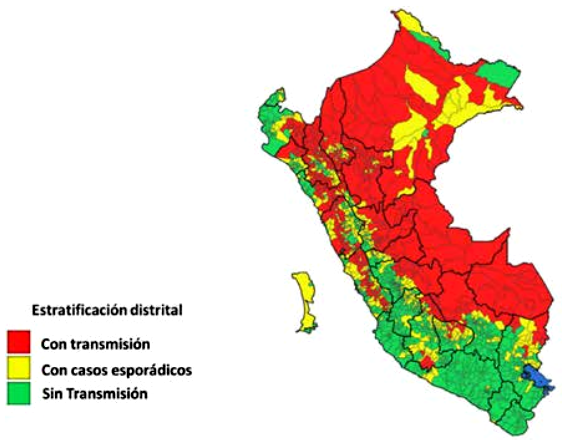
Figura 2. Mapa de estratificación distrital según condición de trasmisión de leishmaniasis, Perú 2010 - 2022.
La incidencia acumulada anual media, para el periodo de estudio, fue de 3,48 casos/10 000 habitantes por año. Los departamentos Madre de Dios (42,45 /10 000 hab.), Cusco (15,78 /10 000 hab.), Amazonas (8,60 /10 000 hab.) y San Martín (7,55 /10 000 hab.) son los que tuvieron las más altas incidencias. La razón de incidencia acumulada anual media del departamento de Madre de Dios es 12,2 veces la incidencia nacional, seguido por Cusco con una razón de 4,54 veces respecto al valor nacional (Tabla 2).
Respecto al tipo de leishmaniasis, 79 213 (93,60%) casos fueron leishmaniasis cutánea y 5 904 (6,94%) fueron leishmaniasis mucocutánea. Los adultos (32,29%), los jóvenes (24,09%) y niños (21,77%) acumularon el mayor porcentaje de casos; sin embargo, la incidencia acumulada anual media fue más alta entre adolescentes (4,60 /10 000 hab.) seguido por los jóvenes (4,37/10 000 hab.). En el análisis de la razón de riesgos, en los adolescentes fue de 1,83 veces respecto a los adultos mayores, esta razón fue de 1,73 para los jóvenes respecto a los adultos mayores.
Respecto al sexo, la leishmaniasis predominó en varones (razón hombre/mujer = 1,98). La mayor transmisión ocurrió en distritos ubicados en zona de selva, la razón de incidencia acumulada con respecto a la costa fue 14 (Tabla 3 y Figura 2). Con relación a la pobreza monetaria, la incidencia acumulada anual media fue mayor en el quintil de mayor pobreza y menor en los distritos del quintil de menor pobreza. Hubo mayor incidencia acumulada de leishmaniasis en los distritos con más NBI. Las mayores incidencias acumuladas correspondieron a distritos ubicados en los dos quintiles de menor IDH (Tabla 3).
Tabla 3. Casos e incidencia acumulada media anual de leishmaniasis, según etapas de vida, sexo, región natural, e indicadores socioeconómicos, Perú 2010 - 2022.
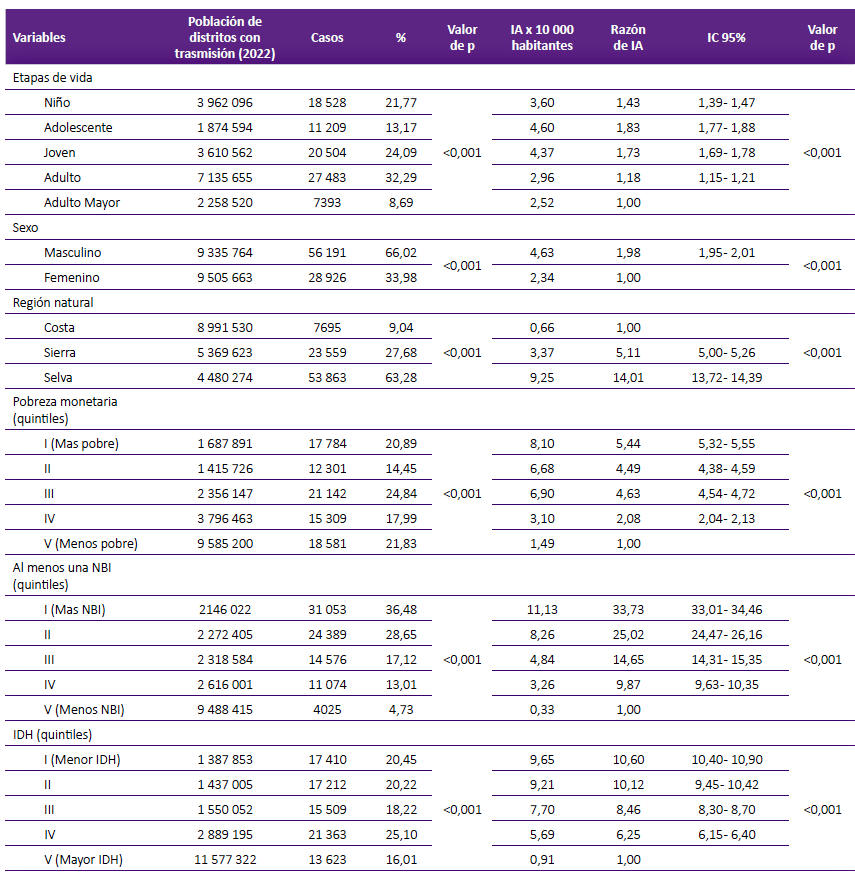
IA: Incidencia acumulada, IC95%: Intervalo de confianza al 95%, NBI: Necesidades básicas insatisfechas, IDH: Índice de desarrollo humano. Valor p para prueba chi cuadrado.
DISCUSIÓN
En Perú, la leishmaniasis tiene extensa distribución, son 18 departamentos que durante el periodo 2010-2022 han reportado trasmisión; sin embargo, el riesgo de trasmisión es heterogéneo, configurando escenarios de trasmisión de diferente riesgo. Cuando se realiza un análisis a nivel departamental, se tiende a reducir la incidencia acumulada, debido a que se incluyen poblaciones que no están expuestas a riesgos, es por ello que, en este estudio se consideran las zonas con trasmisión a nivel distrital.
El análisis de la población que reside en áreas de transmisión nos permite delimitar tres diferentes escenarios. El primero conformado por 543 distritos que han presentado transmisión continua y que concentran al 22,08% de la población nacional. El segundo escenario está conformado por 454 distritos con trasmisión esporádica, en esta área reside el 34,33% de la población nacional. El tercer escenario está conformado por 893 distritos, sin transmisión registrada durante el periodo 2010-2022, en esta área habita el 43,59% de la población nacional. La identificación de estos escenarios permite identificar la población en riesgo y podría orientar la planificación de estrategias diferenciadas por escenarios, de prevención y control.
Los adolescentes y jóvenes tuvieron las incidencias acumuladas más altas, seguido por los niños, en conjunto estos tres grupos acumularon el 59,03% de los casos. Hashiguchi y col. reportan que más del 60% de los casos correspondieron a niños, adolescentes y jóvenes, en un estudio realizado en Perú y Ecuador 22. Gijón-Robles y col. en un estudio realizado en Marruecos reportaron que el 47,5% de casos fueron menores de 20 años 23. En nuestro estudio en comparación con los adultos mayores los adolescentes tuvieron 83% más riesgo de enfermar por leishmaniasis, en los jóvenes este exceso de riesgo fue del 73% y en los niños el 43%.
Los varones tuvieron 98% mayor riesgo de infección por leishmaniasis respecto a las mujeres. El 66,02% de los casos fueron varones. Estudios en varias regiones han encontrado una mayor prevalencia de leishmaniasis en hombres: 68% en Irán 24, 65% en Argelia (2003-2015) 25, 57% en Brasil (2009-2014) 26, y 58,6% en zonas endémicas de Irán 27. El mayor riesgo en varones se explicaría por una mayor exposición a las actividades fuera de casa, como actividades agrícolas, incluso pernoctar fuera de casa. Estas actividades incrementan la exposición a la picadura de los vectores 24,28,29. Las diferencias en morbimortalidad entre sexos son evidentes en varias enfermedades infecciosas, como la leishmaniasis. Los factores biológicos, genéticos y hormonales pueden influir en una mayor susceptibilidad y complicaciones en hombres 30.
Se encontró asociación entre la región natural donde se ubican los distritos con la trasmisión. En áreas de trasmisión, los distritos de la selva y sierra tuvieron 14 y 5 veces, respectivamente, el riesgo respecto a los distritos ubicados en la costa. La leishmaniasis tiene una mayor incidencia en las zonas rurales y tropicales. Las incursiones por actividades agrícolas o por migraciones del hombre al nicho ecológico de los vectores facilitan la trasmisión. La enfermedad es más común en las áreas agrícolas pobres donde las viviendas suelen tener paredes de barro y piso de tierra, y el ganado se mantiene bajo el mismo techo o en distancia cercana, creando un nicho ecológico favorable para los flebótomos. Contribuyen en la trasmisión los factores ambientales como las condiciones de temperatura, la deforestación y los cambios climáticos (4,31.
La población que reside en los distritos más pobres y con menos desarrollo son las que tienen más riesgo. La leishmaniasis afecta principalmente a las poblaciones más empobrecidas de los países en desarrollo. La conexión entre la pobreza y el riesgo de leishmaniasis es muy evidente y es explicada por muchos factores. Las malas condiciones de vivienda, incluidas las paredes agrietadas que proporcionan lugares de descanso para los flebótomos y los pisos de tierra húmedos, mejoran la supervivencia del vector. Además, las puertas inadecuadas permiten la entrada de flebótomos. Se ha demostrado que algunos factores socioeconómicos como vivienda, alfabetización y el tipo de trabajo realizado, influyen la incidencia de la leishmaniasis 29.
Se encontró asociación entre el IDH y la incidencia acumulada de leishmaniasis. En los distritos del quintil de menor IDH hubo 10,6 veces el riesgo respecto al quintil distrital de mayor IDH. Estos hallazgos concuerdan con lo reportado en un estudio realizado en estados endémicos en Venezuela 32, que encuentra que la mejora en las condiciones socioeconómicas reflejadas en el IDH y sus componentes se asocia con una significativa reducción de la incidencia de la enfermedad.
La extensión geográfica de las áreas de trasmisión de leishmaniasis incluye territorios donde son frecuentes sistemas de economía informal, caracterizadas por actividades no reguladas y a menudo ilegales, incluye empresas y trabajadores que operan fuera de acuerdos formales, favorecido por bajos niveles de educación, discriminación, pobreza y acceso limitado a recursos y servicios, ente otros 33.
La minería ilegal, el comercio ilícito, el turismo no regulado, la tala ilegal pueden favorecer un mayor contacto humano con los vectores y mayor riesgo de infección por leishmaniasis. Douine y col. reportan la presencia de leishmaniasis y otras zoonosis entre la población que trabaja en los campamentos mineros ilegales en la Guayana Francesa 34, similar a lo que ocurre en algunas áreas del Perú, como Madre de Dios. La suburbanización asociadas a estas actividades generan escenarios propicios para la trasmisión de la leishmaniasis 35. La tala ilegal, una actividad frecuente en la selva del Perú, altera los ecosistemas. La deforestación y la perturbación del hábitat natural pueden influir en la distribución de los vectores de la leishmaniasis y otras enfermedades, esto podría desempeñar un rol significativo en la propagación enfermedades trasmitidas por vectores (36.
Concluimos que la leishmaniasis es una enfermedad endémica de amplia distribución en Perú. 7 374 007 habitantes residen en áreas con trasmisión continua, y otros 11 467 420 habitan en áreas con trasmisión esporádica. Los grupos poblacionales de mayor riesgo son los varones, los adolescentes y jóvenes; asimismo, las poblaciones que residen en distritos de la selva, las poblaciones de distritos más pobres y de distritos con menor índice de desarrollo humano. Es necesario tomar en cuenta los escenarios de trasmisión y los grupos de poblaciones de mayor riesgo para la implementación de intervenciones diferenciadas de prevención y control.