INTRODUCCIÓN
El método definitivo para obtener tejido pulmonar en la evaluación diagnóstica de la enfermedad pulmonar intersticial difusa (EPID) es la biopsia pulmonar quirúrgica mediante cirugía toracoscópica asistida por video (VATS) 1. Sin embargo, en los últimos años ha surgido un nuevo método de biopsia pulmonar broncoscópica, llamado criobiopsia transbronquial, que tiene la ventaja de producir muestras más grandes (≥ 5 mm) y con menos artefactos por aplastamiento que las biopsias con pinza de las broncofibroscopías convencionales 2,3,4.
Además, se ha demostrado una buena correlación diagnóstica entre las criobiopsias y las biopsias pulmonares quirúrgicas, disminuyendo el riesgo de complicaciones, la estancia hospitalaria y los costos 5,6. En nuestro país, la técnica es nueva para los hospitales nacionales públicos, por tanto, el siguiente reporte describe la primera experiencia de criobiopsia transbronquial, previa revisión exhaustiva del tema y la logística disponible en el hospital, con la finalidad de establecer una metodología, motivar la réplica y mejora. Se obtuvo el consentimiento informado de la paciente para la publicación del reporte con fines académicos; se mantuvo la confidencialidad sus datos.
REPORTE DE CASO
Paciente mujer de 53 años, natural y procedente de Lima, comerciante. Negó hábitos nocivos y exposiciones a tóxicos. Refirió un tiempo de enfermedad de cinco años, de inicio insidioso, curso progresivo, y caracterizado por disnea progresiva. Al examen, tuvo crépitos basales, saturación de 97% sin requerimiento de oxígeno, no presentaba estigmas clínicos reumatológicos.
Las imágenes de tomografía demostraron patrón no usual de neumonía intersticial con leve progresión en los últimos dos años (Figura 1). La paciente tuvo estudio reumatológico con ANA (anticuerpos antinucleares) positivo, patrón mixto: nuclear moteado 1/2560 y nucleolar 1/5120. El anti acido desoxirribonucleico bicatenario (anti-dsDNA) fue negativo, el anti-ENA (anticuerpos nucleares extraíbles) fue positivo 28,15, y el ANCA (anticuerpos frente al citoplasma de los neutrófilos) negativo.
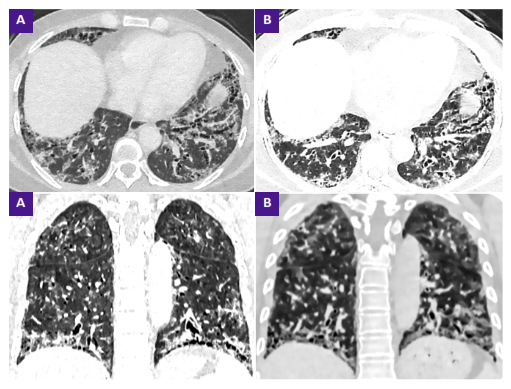
Figura 1. A. Tomografía de tórax sin contraste inicial, cortes axiales y coronales. B. Tomografía de tórax comparativa, con un tiempo de 2 años de evolución, donde impresiona aumento del patrón reticular de distribución predominantemente peribroncovascular y subpleural, pequeñas zonas de panalización en bases, bronquiectasias varicosas y por tracción a predominio basal: patrón no usual de neumonía interstitial.
En la espirometría se encontró una capacidad vital forzada (CVF) de 1,83 (69% del predicho, Z score -2,42), un VEF1 de 1,68 y un VEF1/CVF 91,8 %. Estos resultados sugirieron un patrón de restricción moderada. En la prueba de caminata de 6 min recorrió 540 metros que equivale al 100% del predicho, no hubo desaturación basal ni al ejercicio. La prueba de difusión de monóxido de carbono (DLCO) tuvo un valor de 10,39 (67% del predicho). La ecocardiografía no tuvo signos de hipertensión pulmonar, siendo la presión de la arteria pulmonar media (PAPm), sistólica (PSAP) y diastólica (PDAP), 19, 30 y 11 mmHg, respectivamente. La FeVI (fracción de eyección del ventrículo izquierdo) fue 62% y el resto de parámetros fueron normales. Se presentó el caso al comité multidisciplinario y se determinó realizar la criobiopsia transbronquial para estudio histológico.
Previo al procedimiento, se revisó la estabilidad clínica, medicación previa, laboratorio, perfil de coagulación, pruebas de función pulmonar, gases arteriales, ecocardiografía y comorbilidades médicas, según protocolo internacional 7, que se muestran en la tabla 1, y cuyos parámetros son discutidos posteriormente.
Tabla 1. Lista de verificación para la selección de pacientes7.
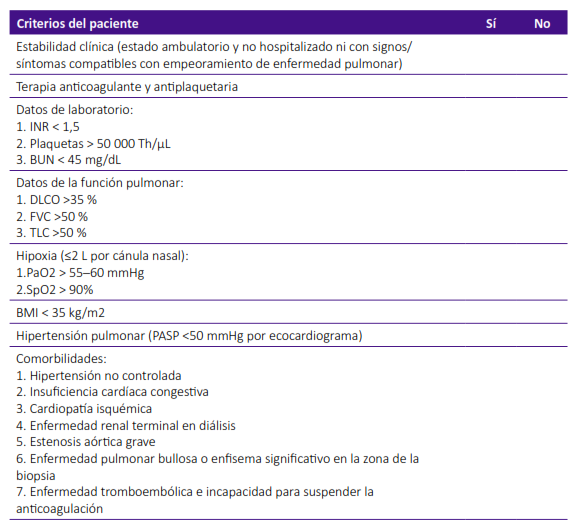
BUN, nitrógeno ureico en sangre; DLCO, capacidad de difusión del monóxido de carbono; FVC, capacidad vital forzada; INR, razón internacional normalizada; PASP, presión sistólica de la arteria pulmonar; TLC, capacidad pulmonar total.
Durante el procedimiento se usó anestesia general y colocación de tubo orotraqueal (TOT), que permitió mayor control sobre el reflejo de la tos y disminuir riesgo de mala colocación de sonda; además una vía aérea segura para el control de hemorragias. Se usó de bloqueador endobronquial (Fogarty N° 7) que se fijó en el ingreso del segmento 9 del lóbulo inferior derecho; para ello, durante el uso del laringoscopio previo a la colocación del tubo endotraqueal, se insertó el bloqueador en la vía aérea, luego con la punta del broncoscopio se dirigió hacía el lugar objetivo. Además, se conectó el bloqueador a una jeringa con solución salina. Se realizó la prueba del balón, insuflando 1 cc de solución salina, para verificar la integridad del balón y la valoración de la respuesta fisiológica de la paciente, si se manifestaba signos de hipoxia se suspendía procedimiento (Figura 2).
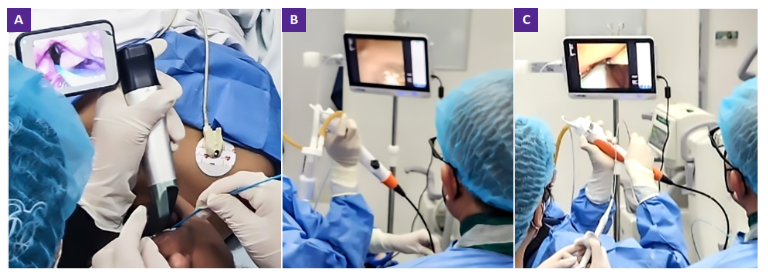
Figura 2. Uso del laringoscopio previo a la colocación del tubo endotraqueal. A. Se insertó el bloqueador en la vía aérea. B. Con la punta del broncoscopio se dirigió hacia el lugar objetivo. C. Prueba del balón para valorar respuesta fisiológica de la paciente.
Se realizó previamente un lavado broncoalveolar (LBA) en el segmento 9. Luego se dirigió la punta de la criosonda ERBE de 1,1 mm con guía fluoroscópica con arco en C aproximadamente a 1 cm de la pleura de dicho segmento (Figura 3), realizándose un tiempo de congelación de 5 segundos. Posteriormente se extrajo en conjunto el broncoscopio y la criosonda con la muestra adquirida por congelación. Se insufló inmediatamente el balón con 1 cc de solución salina para asegurar adecuada hemostasia. Se descongelo y se depositó la muestra en un frasco de suero fisiológico a temperatura de ambiente, posteriormente se trasladó la muestra a formol. Luego se revisó la hemostasia reposicionando el broncoscopio en las vías respiratorias, se desinfló el balón para realizar una inspección. No fue necesario maniobras de hemostasia porque sangrado estaba controlado, por lo que se culminó procedimiento sin complicaciones inmediatas (Figura 4).
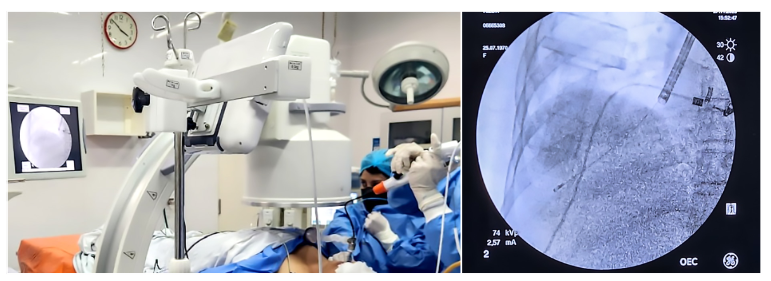
Figura 3. Guía fluoroscópica con arco en C. La punta de la criosonda se coloca aproximadamente a 1 cm de la pleura.
La radiografía de tórax control, 4 horas después de procedimiento, evidenció neumotórax derecho, por lo que se colocó tubo de drenaje torácico, resolviendo neumotórax en menos de 24 horas, se retiró tubo sin complicaciones.
Los resultados de anatomía patológica describieron fragmento de parénquima pulmonar con alteración estructural compatible con patrón histológico de neumonía intersticial no específica en fase fibrosante (Figura 5).
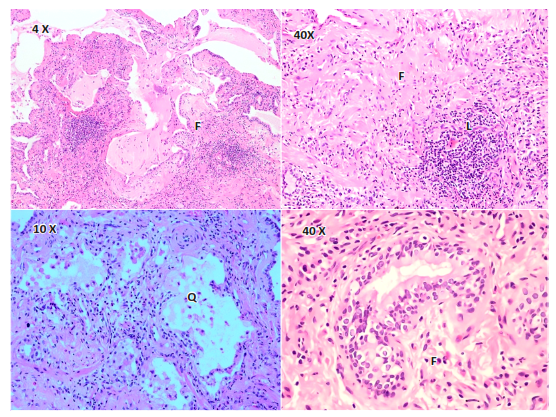
Figura 5. Fragmento de parénquima pulmonar con alteración estructural caracterizada por fibrosis intersticial irregular (F), con áreas quísticas bronquiolares (Q), focos fibroblásticos jóvenes con acúmulos linfoides aislados (L). Patrón histológico de neumonía intersticial no especifica en fase fibrosante. Tinción hematoxilina - eosina.
DISCUSIÓN
En el presente caso, tras la evaluación del comité multidisciplinario, luego de considerar que los resultados de la evaluación clínica, de imagen y de laboratorio no fueron concluyentes para llegar a un diagnóstico, fue necesario solicitar la biopsia pulmonar para la evaluación histológica y sumar criterios para el diagnóstico final (2.
Para la estabilidad clínica, la regla general es que, si un paciente no es apto para biopsia quirúrgica, probablemente tampoco lo sea para criobiopsia; además, si el paciente tiene signos o síntomas clínicos de empeoramiento de la EPID (disnea, la disminución progresiva o rápida de la DLCO o vidrio esmerilado progresivo, exacerbación aguda) entonces se debe cancelar el procedimiento 8,9. En el presente caso, la paciente se encontraba estable sin signos de descompensación.
Para las pruebas de función pulmonar lo recomendado es un DLCO > 35% previsto y una FVC > 50% 10. Una DLCO < 35% aumenta la probabilidad de resultados adversos y mortalidad a los 30 y 90 días 11. Nuestra paciente cumplía con parámetros aceptables. Para la gasometría, una PaO2 > 55 - 60 o SpO2 > 90% con 2 litros de oxígeno a través de una cánula nasal es un requisito para algunos autores, mientras que otros consideran que cualquier uso de oxígeno suplementario es una contraindicación 10,12. Nuestra paciente no dependía de oxígeno, ni al reposo ni al ejercicio.
Se recomienda realizar ecocardiograma trastorácica antes del procedimiento ya que muchos pacientes con EPID pueden tener hipertensión arterial pulmonar coexistente. Algunos centros utilizan el BNP (péptido natriurético cerebral) como marcador sustituto para excluir hipertensión pulmonar 13. Nuestra paciente no tenía signos de hipertensión pulmonar en la ecocardiografía y no fueron necesarios más estudios.
Las comorbilidades que se consideran contraindicación para la criobiopsia son la enfermedad cardiaca no controlada, la insuficiencia renal crónica en diálisis, la enfermedad tromboembólica no controlada y el enfisema centrolobulillar significativo o enfermedad pulmonar ampollosa en el área de la biopsia 10. Ninguno de los descritos estuvo presente en nuestra paciente.
Para el procedimiento, se recomienda un broncoscopio flexible con un canal de trabajo mínimo de 2,8 mm, para una mayor capacidad de succión si no se utiliza una broncoscopia rígida. El tamaño de la criosonda depende del operador, pero puede haber un mayor riesgo de neumotórax con la sonda de 2,4 mm 4. No se han identificado diferencias significativas en el rendimiento diagnóstico, por lo que se recomienda la sonda numero 1,9 mm 3,14. Para nuestra paciente se trabajó con un broncoscopio flexible descartable y una criosonda de 1,1 mm, para el cual previamente se realizó una prueba de congelamiento para lograr 5 mm de diámetro.
El bloqueador bronquial debe ser lo suficientemente grande para obstruir los bronquios segmentarios o principales proximales al sitio de la biopsia, con el objetivo de contener la hemorragia 15,16. La distancia óptima entre la sonda y la pleura es esencial tanto para la seguridad como para el rendimiento diagnóstico, por lo que la guía fluoroscopia con arco en C resulta de mucha utilidad. La distancia que se recomienda actualmente es de 1 cm de la pleura 4,14.
Es recomendable tomar biopsias de dos sitios diferentes: un segmento diferente dentro del mismo lóbulo o un lóbulo ipsilateral diferente. El número de biopsias por segmento o lóbulo no está estandarizado y generalmente depende del operador; sin embargo, se recomienda obtener de tres a cinco biopsias17. En el presente caso tomamos una muestra por tratarse de nuestra primera experiencia y considerando el margen de seguridad de la paciente.
Las complicaciones más frecuentes de la criobiopsia son la hemorragia moderada (15%) y el neumotórax (10%)18. La hemorragia moderada fue definida por el control de la hemorragia con un bloqueador endobronquial o la administración de solución salina helada. Nuestra paciente desarrollo neumotórax que se solucionó con tubo de drenaje torácico, en menos de 24 horas, con buena evolución.
Finalmente, en nuestro país la criobiopsia transbronquial es una técnica nueva para los hospitales nacionales públicos, lo que motiva a la exhaustiva revisión del tema y reportar las primeras criobiopsias realizadas con la finalidad establecer la metodología, motivar su réplica y mejora. Atribuimos el éxito del procedimiento -como primera experiencia en nuestro hospital- a la capacitación adecuada de la técnica, y a la revisión y seguimiento de las recomendaciones.