Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.14 n.2 Lima jul./dic. 2003
ARTÍCULOS PRIMARIOS
Efecto de la sustancia P sobre la presión arterial pulmonar en pollos expuestos a la altura
Sebastiana Bernilla De la C. 1; Sergio Cueva M. 2; Milder Ayón S.2.
1
Graduada de la Unidad de Postgrado.FMV-UNMSM. Práctica privada.2 Laboratorio de Fisiología Animal, FMV-UNMSM.
RESUMEN
La hipoxia de la altura produce hipertensión arterial pulmonar como consecuencia de una vasoconstricción arteriolar pulmonar, cuyo mecanismo es aun desconocido. Bajo estas condiciones, en el endotelio vascular se sintetizan sustancias vasoactivas en las que podría incluirse la Sustancia P (SP). A fin de determinar el efecto de la SP sobre la Presión Arterial Pulmonar media (PAPm) se utilizaron 30 pollos de carne, machos, nacidos y criados a nivel del mar. A los 35 días de edad fueron expuestos a 3,320 m de altitud por 3 días, al término de los cuales se determinó la PAPm por cateterismo directo de la arteria pulmonar, tanto antes (Pre-SP) como despues de la administración de Sustancia P (Post-SP), en dosis de 0.30 mcg (0.3ml)/ kg. de peso vivo, El valor promedio de la PAPm para Pre-SP fue de 37.92 ± 4.10 mmHg, mientras que en los tiempos de 01, 05, 10, 15, 30, 45, 60, 75 y 90 segundos de administrada la SP fueron 36.08 ± 3.70, 31.11 ± 7.51, 28.00 ± 10.22, 26.43 ± 11.02, 24.43 ± 11.02, 23.17 ± 11.54, 24.08 ± 10.98, 27.27 ± 10.97 y 30.67 ± 9.40 mmHg, respectivamente. La SP disminuyó significativamente la PAPm desde el primer segundo (P< 0.001), y alcanzó su mínimo valor a los 45 segundos. La rápida disminución de la PAPm debido a la aplicación de la SP permite sugerir la posible influencia a nivel endotelial vascular por su acción vasodilatadora, disminuyendo el efecto presor que, a su vez, podría estar relacionado con la hiperpolarización de la membrana o con el aumento de la actividad del óxido nítrico.
Palabras clave: Sustancia P, hipoxia, pollos, presión arterial pulmonar, taquicininas.
ABSTRACT
Hypoxia at high altitude produces pulmonary arterial hypertension as a result of pulmonary arteriolar vasoconstriction, which mechanism is still unknown. Under these conditions, vasoactive substances like Substance P (SP), are synthesized in the vascular endothelium. To study the effect of SP on the mean pulmonary arterial pressure (PAPm), 30 male chickens for meat production, born and reared at sea level were used. The birds were exposed at 35 days of age to 3,320 m of altitude for 3 days, and then the PAPm was determined by catheterising the pulmonary artery, both before (Pre-SP) and after (Post-SP) injection of SP in dose of 0.30 mcg (0.3ml)/kg of body weight. The mean value of PAPm for Pre-SP was 37.92 ± 4.10 mm Hg, while for Post-SP at the times of 01, 05, 10, 15, 30, 45, 60, 75 and 90 seconds were 36.08 ± 3.70, 31.11 ± 7.51, 28.00 ± 10.22, 26.4 ± 11.02, 24.43 ± 11.02, 23.17 ± 11.54, 24.08 ± 10.98, 27.27 ± 10.97, 30.67 ± 30-62 + 9.40 mm Hg, respectively. SP significatively diminished the PAPm (P < 0.001) from the 1st second and reached his lowest value at 45 seconds. The quich decrease of PAPm suggest a possible influence of SP at vascular endothelial level through its vasodilator effect, decreasing the press effect that could be related the hyper polarization of the membrane as well to an increase of nitric oxide activity.
Key words: Substance P, hypoxia, chicken, pulmonary arterial pressure, tachykinin.
INTRODUCCIÓN
La baja presión de oxígeno en la altura produce una vasoconstricción arteriolar pulmonar, principal mecanismo causante de la hipertensión arterial pulmonar (HAP) conducente a una insuficiencia cardiaca derecha que frecuentemente culmina con la muerte del animal. Este cuadro patogénico se presenta en diversas especies animales, especialmente en bovinos (Alexander et al., 1960; Grover, 1966; Will y Bisgard, 1975) y en aves (Burton et al., 1968; Cueva et al., 1974), ocasionando grandes pérdidas económicas.
Se han realizado diversos estudios sobre el tema, pero aun no se logra encontrar el mecanismo regulador íntimo de esta condición. Actualmente se conoce que existen factores intrínsecos producidos a nivel vascular que causan su remodelación, la que se acentúa de acuerdo al tiempo de exposición del individuo a la hipoxia; además, se incrementa la producción de factores de crecimiento y del fibroblasto adventicial, alterando el tono vascular (Knot y Nelson, 1998). Animales sometidos a hipoxia se caracterizan por un incremento del tono vascular pulmonar que es mantenido, en parte, por una remodelación vascular dependiente de la duración y severidad de la misma; así, en la pared arterial pulmonar, la célula endotelial, el músculo liso y el fibroblasto adventicial tienen un crecimiento específico, que se puede observar aún a las 24 horas de exposición a la hipoxia. Las células arteriales producen factores de contracción o relajación en respuesta a varios estímulos, los cuales modulan el tono vascular (Brij Seema y Peacock, 1998).
Investigaciones recientes demuestran la existencia de sustancias vasoactivas que actúan en respuesta a hipoxia, tales como la Sustancia P (SP), un neuromodulador del grupo de neuropéptidos (NPS). Esta sustancia es un potente vasodilatador secretada por los nervios perivasculares y liberada dentro de las células endoteliales (Schaffer et al., 1998).
El presente trabajo tuvo como objetivo estudiar el rol que juega el neuromodulador SP en el mecanismo íntimo de la HAP utilizando el ave como un modelo experimental. Se pretende que los resultados del presente trabajo permitan orientar los estudios de adaptación a la altura en otras especies de producción.
MATERIALES Y MÉTODOS
El trabajo se realizó en los laboratorios de Fisiología Animal de la Facultad de Medicina Veterinaria de la UNMSM y de la Estación Experimental del C.I. IVITA-El Mantaro. Se utilizaron 30 pollos machos de producción de carne de la línea Arbor Acress.
Los pollos nacieron y fueron criados a nivel del mar hasta los 35 días de edad, luego de los cuales fueron expuestos durante tres días a 3,320 m de altitud.
En cada animal se determinó la Presión Arterial Pulmonar media (PAPm) mediante la técnica descrita por Burton et al. (1968), antes (Pre-SP) y después (Post-SP) de la aplicación de 0.30 mcg/kg de peso vivo de Sustancia P (SP) por vía directa en la arteria pulmonar. Para tal efecto se utilizó un transductor de presión modelo 167AC conectado a un fisiógrafo de registro térmico modelo 8805B, ambos de la marca Hewlett Packard.
Los resultados de la PAPm en cada estadío de Post-SP fueron expresados en valores promedio y comparados con el de Pre-SP, utilizando la prueba de "t" Student, teniendo en consideración las diferencias a través del tiempo. Se estableció el nivel de confiabilidad de la SP a través de la prueba de intervalo de confianza mayor y menor entre los promedios y las diferencias.
RESULTADOS Y DISCUSIÓN
La PAPm antes y después de la administración del neuromodulador SP, muestra diversas tendencias de efecto (
Cuadro 1), llegando a niveles por debajo de los registrados a nivel del mar (Burton et al., 1968).
La administración de SP disminuyó significativamente (p<0.001), la PAPm durante los 90 segundos de su administración alcanzando el promedio más bajo a los 45 segundos, para luego iniciar su incremento desde los 60 segundos hasta los 90 segundos, tendiendo a alcanzar el valor Pre-SP. El registro de 37.92 ± 4.10 mm Hg, antes de la administración de SP, guarda estrecha relación con investigaciones realizadas en aves expuestas a similares altitudes (Burton et al., 1968; Cueva et al., 1974).
La
Fig. 1. muestra gráficamente las diferencias de la PAPm en los diferentes intervalos de estudio con relación a la PAPm antes de la administración de la Sustancia P.
Al parecer, esta disfunción fisiológica en respuesta a la hipoxia, puede ser un mecanismo de defensa por el cual la vasculatura se protege ante cualquier tipo de injuria del área del lecho vascular a fin de mantener un menor flujo en esas zonas donde tienen incrementadas su permeabilidad, por lo tanto incrementado su presión capilar (Zanaboni et al., 1992; Staton y Ingram, 1998, Kato et al., 1990). La presión intravascular causa un potencial de despolarización de la membrana abriendo canales de Ca++ dependiente de voltaje y actuando como un censor de voltaje. De esta manera se incrementa la entrada de Ca++ a la pared arterial llevando a la despolarización del músculo liso (células musculares lisas), el cual dirige la vasoconstricción arterial visto en pequeñas arterias, causando una gran constricción entre cada tono miogénico (Meininger y Davis, 1992; Knot y Nelson, 1998). A una presión dada, el diámetro arterial es muy sensible al potencial de membrana, el cual causa hiperpolarización de la misma membrana, que a su vez causa vasodilatación; un mecanismo común para muchos vasodilatadores sintéticos y endógenos con activación de canales de K+. Además, el proceso de generación y mantenimiento del ritmo respiratorio está controlado por la excitabilidad de las neuronas y la conductancia al K+. Dos canales de K+ están esencialmente involucrados en la respuesta vasomotora: canales de K+ sensible a ATP que responde a cambios metabólicos celulares y canales de K+ estimulados por niveles de Ca++ citosólico (Perrault y Demarte, 1993). Estos canales de Ca++ en la hipoxia contribuyen a la respuesta del centro respiratorio (Mironov y Rickter, 1998; Sun y Reis, 1994).
La disminución de la PAPm en el presente estudio podría ser una respuesta al estímulo mecánico ejercido por el incremento del tono vascular o por un mecanismo que podría involucrar la hiperpolarización de la membrana, ejercido por la vasodilatación dependiente del endotelio dado a conocer en animales recién nacidos, en fetos y que según estudios realizados, pertenecen al pulmón y a vasos cerebrales (Perreault y Demarte, 1993; Armstead, 1996). Además, este factor de hiperpolarización dependiente del endotelio (EDHF) induce hiperpolarización del músculo liso vascular por activación de la bomba Na - K ATPasa o bomba de sodio (Brayden 1990; Feletou y Van Houtte, 1988) o por incremento de la conductancia de la membrana al K+ (Komori y Suzuki 1997; Chen et al., 1988; Smith et al., 1991).
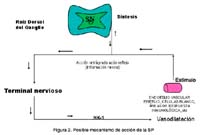
El posible mecanismo de acción de la Sustancia P se indica en la
Fig. 2. Considerando que numerosos neuropéptidos están localizados en terminales nerviosos mielinizados (AC) y amielinizados (C), y la estimulación antidrómica de estas fibras induce liberación de neuropéptidos almacenados, esto resulta en vasodilatación e incremento de la permeabilidad vascular por inflamación neurogénica. Estos impulsos nerviosos viajan no sólo centralmente, sino que a través de las ramificaciones colaterales pasan antidrómicamente para estimular las terminales nerviosas y causar liberación de neuropeptidos denominado "Axón reflejo". Tales agentes pueden actuar normalmente sobre receptores de terminales nerviosos pre y post sinápticos localizados sobre la célula blanco (Holzer, 1988; Hokfelt et al., 1994). Este mecanismo de acción podría estar ocurriendo con la SP, para producir el efecto vasoactivo sobre la arteria pulmonar (célula blanco), y por consiguiente disminuir la PAPm.
CONCLUSIONES
- La administración de Sustancia P al 0.01% en dosis de 0.30 mcg (0.3 ml)/kg de peso vivo en pollos de producción de carne expuestos durante tres días a hipoxia ambiental, disminuyó la PAPm en forma rápida.
- La disminución rápida de la PAPm permite sugerir la influencia de la Sustancia P a nivel endotelial vascular, modulando el efecto presor mediante la hiperpolarización de la membrana.
- El efecto hipotensor fue transitorio, ya que desde los 60 hasta 90 segundos Post-SP se observó un incremento tendiente a acercarse al valor Pre-SP.
LITERATURA CITADA
1. Alexander, A.F.; D.F. Will; R.F. Grover; J.T. Reeves. 1960. Pulmonary hypertension and right ventricular hypertrophy in cattle at high altitude. Amer. J. Vet. Res. 21: 199-204. [ Links ]
2. Armstead, W.M. 1996. Role of ATP-sensitive K+ channels in c GMP-mediated pial artery vasodilation. Am. J. Physiol. 270: H423-426. [ Links ]
3. Brayden, J.E. 1990. Membrane hyperpolarization is a mechanism of endothelium-dependent cerebral vasodila-tion. Am. J. Physiol. 259: H668-H673. [ Links ]
4. Brij Seema, O.; A.J. Peacock. 1998. Cellular responses to hypoxia in the pulmonary circulation. Thorax 53: 1075-1079. [ Links ]
5. Burton, R.R.; E.L. Besch; A.H. Smith. 1968. Effect of hypoxia on the pulmonary arterial blood pressure of the chicken. Am. J. Physiol. 214: 1438-1442. [ Links ]
6. Cueva, S.; H. Sillau; A. Valenzuela; H. Ploog. 1974. High altitude pulmonary hypertension and right heart failure in broiler chicken. Res. Vet. Sci. 16: 370-374. [ Links ]
7. Chen, G.; H. Suzuki; A.H. Weston. 1988. Acetylcholine releases endothelium-derived hyperpolarizing factor and EDRF from rat blood vessels. J. Pharmacol. 95: 1165-1174. [ Links ]
8. Feletou, M.; P.M. Van Houtte. 1988. Endothelium-dependent hyperpolarization of canine coronary smooth muscle. Br. J. Pharmacol. 93: 515-524. [ Links ]
9. Grover, R.F. 1966. Comparative physiology of hypoxia pulmonary hypertension. En: Proc. Int. Symp. Card. Vasc. Resp. Effects hypoxia. Karger. Basel. New York. p 307-321. [ Links ]
10. Hokfelt, T.; H.G. Shaible; R.F. Schmidt. 1994. Neuropeptides nociception and pain. Chapman & Hall. Weinheim, Germany. [ Links ]
11. Holzer, P. 1988. Local effectors functions of capsaicin sensitive sensory nerve ending: Involvement of tachykinins, calcitonin generelated peptide and other neuropeptide. Neuroscience 24: 739-768. [ Links ]
12. Kato, T.; Y. Iwama; K. Okumura; H. Hashimoto; T. Ito; T. Satake. 1990. Prostaglandin H2 may be the endothe-lium-derived contracting factor released by acetylcholine in the aorta of the rat. Hypertension 15: 475-481. [ Links ]
13. Knot, H.J.; M.T. Nelson. 1998. Regulation of arterial diameter and wall Ca2+ in cerebral arteries of rat by membrane potential and intravascular pressure. J. Physiol. 508: 199-209. [ Links ]
14. Komori, K.; H. Suzuki. 1987. Electrical responses of smooth muscle cells during cholinergic vasodilation in the rabbit saphenous artery. Cir. Res. 61: 586-593. [ Links ]
15. Meininger, G.A.; M.J. Davis. 1992. Cellular mechanisms involved in the vascular myogenic response. Am. J. Physiol. 263: H647-H659. [ Links ]
16. Mironov, S.L.; D.W. Rickter. 1998. L-tipe Ca2+ channels in inspiratory neurones of mice and their modulation by hypoxia. J. Physiol. 512: 75-87. [ Links ]
17. Perreault, T.; J. De Marte. 1993. Naturational changes in endothelium-derived relaxations in newborn piglet pulmonary circulation. Am. J. Physiol. Heart Cir. Physiol. 264: H302-309. [ Links ]
18. Schaffer, M.; T. Beiter; H.D. Becker; T.K. Hunt. 1998. Neuropeptides: Mediators of inflammation and tissue repair?. Arch. Surg. 133: 1107-1116. [ Links ]
19. Smith, J.C.; H.H. Ellenberger; K. Bellanyi; D.W. Richter; J.L. Feldman. 1991. Pre-Botzinger complex: A brain stem regions that may generate respiratory rhythm in mammals. Science 254: 726-729. [ Links ]
20. Sun, M.K.; D.J. Reis. 1994. Hypoxia-activated Ca++ currents in pacemaker-neurones of rat rostral ventrolateral medulla in vitro. J. Physiol. 476: 101-106. [ Links ]
21. Staton, G.; R. Ingram. 1998. Respiratory pulmonary edema. Scientific American INC. 1-8. [ Links ]
22. Will, J.A.; E.G. Bisgard. 1975. Comparative homodynamic of domestic animals at high altitude. Prog. Res. 9: 138-43. [ Links ]
23. Zanaboni, P.B.; J.D. Bradley; R.O. Webster; T.E. Dahams. 1992. Cyclooxigenase inhibition prevents PMA-Induced in pulmonary vascular permeability to album. J. APPL Physiol. 73: 2011-2015. [ Links ]