Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.17 n.2 Lima jul./dic 2006
ARTÍCULOS PRIMARIOS
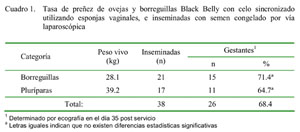
Inseminación intrauterina vía laparoscópica de ovejas Black Belly con semen congelado Edwin Mellisho S.1,2; René Pinazo H.1; Lilia Chauca F.3; Próspero Cabrera V.1 y Victoria Rivas P.4 1 Facultad de Zootecnia, Universidad Nacional Agraria La Molina (UNALM), Lima, Perú Resumen El estudio tuvo por objetivo evaluar la tasa de preñez de ovejas Black Belly criadas de forma estabulada en la costa peruana y que fueron inseminadas intrauterinamente vía laparoscópica con semen congelado. Los animales fueron divididos de acuerdo a su edad e historia reproductiva en borreguillas (n = 21) y ovejas (n = 17). La sincronización del estro se realizó con esponjas intravaginales (60 mg de acetato de medroxiprogesterona) por 13 días y la aplicación de 300 UI de gonadotropina coriónica equina al retiro de las esponjas. La inseminación se realizó a tiempo fijo (62-65 h del retiro de la esponja intravaginal) usando un pellet de semen congelado (0.4 ml con 40 x 106 espermatozoides) en el lumen de cada cuerno uterino. No se utilizaron sedantes ni tranquilizantes. El diagnóstico de preñez por ecografía transrectal se hizo 35 días después de la inseminación artificial. No se encontraron diferencias significativas en la tasa de preñez a los 35 días después de la inseminación laparoscópica entre las borreguillas (71.4%) y las ovejas (64.7%). Las altas tasas de preñez obtenidas al inseminar ovejas vía laparascópica con semen congelado hacen elegible esta técnica para reproducir carneros élite. Palabras clave: sincronización, inseminación, laparoscopía, oveja Abstract The present study was carried out to evaluate the pregnancy rate of Black Belly ewes reared under the conditions of the Peruvian coast, that were laparoscopic intrauterine inseminated with frozen-thawed pellet semen. Females were divided according to age and reproductive history in nulliparous (n = 21) and ewes (n = 17). Estrous synchronization was done using vaginal sponges (60 mg medroxyprogesterone acetate) for 13 days and the injection of 300 IU equine chorionic gonadotrophin upon sponge removal. The intrauterine insemination was conducted at fixed time (62-65 h post withdrawal of vaginal sponge) using a semen dose (0.4 ml, 40 x 106 spermatozoa) into the lumen of each uterine horn. Sedatives or tranquilizers were not used. Ultrasound pregnancy diagnosis was performed at day 35 after insemination. No significant differences were found in pregnancy rates between nulliparous (71.4%) and ewes (64.7%). The high pregnancy rates when using laparoscopic intrauterine insemination with frozen-thawed semen in Black Belly females supports the use of this technique for breeding elite animals. Key words: synchronization, insemination, laparoscopic, sheep Introducción La inseminación artificial (IA) con semen congelado juega un rol muy importante en los programas de mejoramiento genético, no solo por acelerar el flujo de material genético superior hacia sectores de inferiores características productivas, sino por facilitar el transporte de semen, evitando el costoso traslado de los reproductores y disminuyendo los riesgos sanitarios. No obstante, para poder cumplir con el mejoramiento genético, es fundamental que la técnica reproductiva garantice adecuadas tasas de preñez. En ovejas, la IA se realiza mayormente con semen fresco o refrigerado, debido a los pobres resultados de fertilidad que se obtienen al usar semen congelado (Maxwell et al., 1980; Salamon y Maxwell, 2000) y a la reducción de la viabilidad espermática producida por el proceso de congelamiento y descongelamiento (Salamon y Lightfoot, 1970). A esto, se suma la dificultad de transponer la cérvix de la oveja con la pipeta de inseminación (Halbert et al., 1990) y los efectos secundarios de la sincronización del estro utilizando esponjas intravaginales (Lightfoot y Salamon, 1970). Hoy en día estos problemas pueden ser superados usando un método alternativo de inseminación intrauterina vía laparoscópica con semen congelado (McKelvey et al., 1985; Eppleston y Maxwell, 1995). A pesar de las reconocidas bondades de la inseminación intrauterina vía laparascópica en ovejas, la técnica ha tenido una aplicación bastante limitada en el Perú debido a la falta de técnicos calificados y a la difusión inadecuada de sus ventajas. El presente experimento se desarrolló con el fin de evaluar la tasa de preñez en ovejas Black Belly inseminadas con semen congelado utilizando la inseminación intrauterina vía laparascópica. Materiales y Métodos El experimento se llevó a cabo en la Granja de Ovinos del INIEA-CE La Molina (Lima, Perú) durante la estación de otoño. Se utilizaron 38 ovinos de la raza Black Belly, criadas de forma estabulada y alimentados a base a desechos de cosecha de maíz, camote, leguminosas, etc. Los ovinos fueron divididos en dos grupos de acuerdo a su edad e historia reproductiva: borreguillas (n = 21) y ovejas ≥ 1 parto (n = 17). La sincronización del estro se realizó con esponjas intravaginales (60 mg de acetato de medroxiprogesterona, MAP) por 13 días, además de una aplicación de 300 UI de eCG (Folligon®) al retiro de las esponjas. Se registró el peso de los animales el día que se colocaron las esponjas. El semen colectado de un carnero Black Belly fue congelado por el método rápido (Evans y Maxwell, 1987; Cueto et al., 1993a; Mellisho y Flores, 2004) y almacenado en pellets (pastillas) de 0.2 ml con 40 x 106 espermatozoides mótiles. El dilutor contenía 36.3 mg/ml de Tris, 5.0 mg/ml de glucosa, 19.9 mg/ml de ácido cítrico, 15% (v/v) de yema de huevo, 5% (v/v) de glicerina, 1000 UI/ml de penicilina y 1 mg/ml de estreptomicina. La descongelación del semen se realizó extrayendo el pellet del tanque criogénico con ayuda de una pinza y colocándolo en un tubo de ensayo de vidrio, seco y estéril, donde se agitaba en un baño de agua a 38 ºC, hasta que cambiase de estado sólido a líquido (45 a 60 segundos); de allí se traslada a baño maría a 32-33 ºC para su inmediato depósito en el útero de la hembra. La pipeta de inseminación fue acondicionada insertando una aguja 22 G y ½ pulgada de largo a un extremo de la pipeta. Las hembras se colocaron encima de una camilla, con las patas sujetas en posición cúbito dorsal a 45º. Se les rasuró el abdomen (15 cm debajo de los pezones), limpiando y desinfectándose la zona donde se colocaron los trócares de 7 y 5 mm. El primero se usó para colocar el endoscopio y el segundo para introducir la pipeta de inseminación. La IA se realizó a tiempo fijo (62-65 h post retiro de la esponja intravaginal). Se depositó una dosis de semen en el lumen de cada cuerno. Luego del servicio, se retiraron los instrumentos (pipeta de IA, endoscopio y trócares), aplicándose un antiséptico, cicatrizante y medicamentos contra la miasis cutánea en forma local. Se les colocó en un ambiente limpio y tranquilo por unas horas antes de ser trasladadas a su corral. Todo el proceso de la IA, desde colocar el animal en la camilla hasta culminar la IA, fue de 3 a 4 minutos, por lo que no fue necesario utilizar sedantes ni tranquilizantes. El diagnóstico de preñez se realizó 35 días posteriores a la IA, mediante un examen ecográfico (Pie Medical, 5 MHZ) con transductor rectal. Esto se hizo con las hembras de pie y sujetas a la pared. La preñez se confirmó al observar el útero aumentado de tamaño, así como la presencia de líquido y feto. Las tasas de preñez entre nulíparas y ovejas se compararon con el Z-Test (prueba de dos proporciones), usando el software Statistical Minitab for Windows 2000, versión 13.2. Resultados Los animales experimentales presentaron cuernos uterinos turgentes y rojizos al momento de la inseminación, lo cual era un indicativo que estaban en estro. La motilidad progresiva del semen descongelado fue mayor al 50%. Las tasas de preñez obtenidas en el estudio se muestran en el Cuadro 1. Discusion Los resultados de preñez fueron superiores a algunos reportes que obtuvieron entre 42 y 48% (Cueto et al., 1993b; Boretto et al., 2002) , aunque bastante similares a otros estudios (Maxwell 1986b; Evans y Maxwell, 1987; Anel et al., 1992; Ghalsasia y Nimbkar, 1996; Stellflug et al., 2001; Cattaneo et al., 2004), que obtuvieron tasas de preñez entre 59 y 77%. La fertilidad en ovejas inseminadas artificialmente depende de muchos factores, tales como la técnica de inseminación, raza, edad, intervalo parto-inseminación, establecimiento, estación, año, efecto macho, y estado nutricional, entre otros (Lewis et al., 1996; Nottle et al., 1997; Anel et al., 2005). Se tienen reportes de mayores tasas de fertilidad cuando se usa semen congelado en pellets versus pajillas (Gordon, 1997). Esta diferencia podría deberse a que la mayor velocidad en el proceso de congelamiento rápido favorece el mantenimiento de la viabilidad espermática (Evans y Maxwell, 1987). Así mismo, se reporta una baja tasa de preñez (40%) al inseminar con dosis de 16 millones de espermatozoides, mientras que con dosis de 64 millones se obtienen tasas de preñez superiores (73%) (Eppleston et al., 1994). Resultados similares fueron obtenidos por Maxwell (1986b) quién reporta tasas de preñez crecientes al incrementar el número de espermatozoides de 10 a 20 y 50 millones. La dosis de semen usada en el presente experimento fue de 40 millones de espermatozoides, lográndose una tasa de preñez del 68%. La buena fertilidad conseguida podría deberse no solamente por el número de espermatozoides utilizados, sino además, por el efecto raza, ya que la oveja Black Belly tiene un mayor tasa ovulatoria que otras razas ovinas. El momento de la IA con respecto a la ovulación es fundamental para lograr el éxito de la IA y, para esto, es determinante el método de sincronización del estro y la respuesta ovulatoria de las hembras; aspectos que fueron controlados con el uso del MAP en esponjas intravaginales y eCG al retiro de la esponja. No obstante, la literatura presenta resultados contradictorios, donde García et al. (1992) obtuvieron mejores tasas de preñez en ovejas inseminadas con celo natural (52%) que con celo sincronizado (44%), en tanto que Maxwell y Barnes (1986) reportaron una alta tasa de parición en ovejas sincronizadas con Chronogest® (67%) y CIDR® (55%). No se observaron diferencias estadísticas significativas en la tasa de preñez entre nulíparas y ovejas con uno o más partos. Diversos reportes mencionan una reducción grdual de la tasa de preñez por efecto de la edad de la oveja (Shackell et al., 1990; Anel et al., 2005); aunque hay reportes que señalan tasas de preñez superiores en ovejas (70%) que en borreguillas (60%) (Moses et al., 1997). El presente estudio demuestra la viabilidad del uso de la inseminación intrauterina vía laparoscópica en ovejas Black Belly, obteniéndose altas tasas de preñez con el uso de semen congelado para la difusión de genes de machos elite. Literatura Citada 1. Anel, L.; J.C. Boixo; E. Anel; M. Carbajo; J.C. Domínguez; J.A. Olmedo; C. Melcon. 1992. Fertility of Churra ewes following intrauterine insemination by laparoscopy with frozen-thawed semen. Proc. 12th Internat. Congr. Anim. Reprod. The Hague. 3: 404 (Abstr. [ Links ]) 2. Anel, L.; M. Kaabi; B. Abroug; M. Alvarez; E. Anel; J.C. Boixo; L.F. De la Fuente; P. De Paz. 2005. Factors influencing the success of vaginal and laparoscopic artificial insemination in Churra ewes: a field assay. Therio-genology 63: 1235-1247. [ Links ] 3. Boretto, J.M.; A.E. Gibbons; M.M. Bunge; M.I. Cueto; F. Bidinost. 2002. Calidad seminal post-descongelamiento en relación con la eficiencia reproductiva de la inseminación artificial laparoscópica en ovinos. Rev. Med. Vet., Argentina 83: 185-188. [ Links ] 4. Cattaneo, L.; P. Martin; J.O. Caballero; M. Calvi; B. Vietri; E. Puyó; M. Medina. 2004. Pregnancy rate ewes inseminated with sexed semen in Argen tina. Reprod. Fert. Develop. 16: 284 (Abstr.) 5. Cueto, M.; J. García; A. Gibbons; M. Wolf; J. Arrigo. 1993a. Obtención, procesamiento y conservación del semen ovino. Manual de Divulgación. Comunicación Técnica de Producción Animal del INTA, Bariloche Nº 200. Argentina. 23p. [ Links ] 6. Cueto, M.; J. García; A. Gibbons; M. Wolf; H. Taddeo; R. González. 1993b. Efecto de la dosis de gonadotropina de suero de yegua preñada (PMSG) y momento de inseminación artificial intrauterina con semen congelado sobre la fertilidad de ovejas Merino Australiano. Rev. Argentina Prod. Anim. 13: 277-281. [ Links ] 7. Eppleston, J.; W.M.C. Maxwell. 1995. Sources of variation in the reproductive performance of ewes inseminated with frozen-thawed ram semen by laparos-copy. Theriogenology 43: 777-788. [ Links ] 8. Eppleston, J.; S. Salamon; N. Moore; G. Evans. 1994. The depth of cervical insemination and site of intrauterine insemination and their relationship to the fertility of frozen thawed ram semen. Anim. Reprod. Sci. 36: 221-225. [ Links ] 9. Evans, G.; W.M.C. Maxwell. 1987. Salamons artificial insemination of sheep and goats. Butterworths. Sydney. 185 p. [ Links ] 10. García, V.J.; R. González; M. Cueto; A. Gibbons. 1992. Efecto de la inseminación artificial intrauterina con dos concentraciones de semen congelado, celo natural y sincronizado, sobre la fertilidad en ovejas Merino Australiano. Manual de divulgación. Comunicación Técnica de Producción Animal del INTA, Bariloche Nº 187. Argentina. 7 p. [ Links ] 11. Ghalsasia, P.M.; C. Nimbkar. 1996. Evaluation of laparoscopic intrauterine insemination in ewes. Small Ruminant Res. 23: 69-73. [ Links ] 12. Gordon, I. 1997. Fixed-time sheep artificial insemination. En: Controlled reproduction in sheep and goats. p 116-145. CABI Publishing. UK. [ Links ] 13. Halbert, G.W.; H. Dobson; J.S. Walton; B.C. Buckrell. 1990. The structure of the cervical canal of the ewe. Theriogenology 33: 977-992. [ Links ] 14. Lewis, R.M.; D.R. Notter; D.E. Hogue; B.H. Magee. 1996. Ewe fertility in the STAR accelerated lambing system. J. Anim. Sci. 74: 1511-1522. [ Links ] 15. Lightfoot, R.J.; S. Salamon. 1970. Fertility of ram spermatozoa frozen by the pellet method. I. Transport and viability of spermatozoa within the genital tract of the ewe. J. Reprod. Fert. 22: 385-398. [ Links ] 16. Maxwell, W.M.C. 1986a. Artificial insemination of ewes with frozen-thawed semen at a synchronized oestrous. I. Effect of time of onset of oestrus, ovulation and insemination on fertility. Anim. Reprod. Sci. 10: 301-308. [ Links ] 17. Maxwell, W.M.C. 1986b. Artificial insemination of ewes with frozen-thawed semen at a synchronized oestrous. II. Effect of dose of spermatozoa and site of insemination on fertility. Anim. Reprod. Sci. 10: 309-316. [ Links ] 18. Maxwell, W.M.C.; D.R. Barnes. 1986. Induction of oestrus in ewes using a controlled internal drug release device and PMSG. J. Agric. Sci. 106: 201-203. [ Links ] 19. Maxwell, W.M.C.; R.M. Curnock; D.N. Logue; H.C.B. Reed. 1980. Fertility of ewes following artificial insemination with semen frozen in pellets or straws: a preliminary report. Theriogenology 14: 83-89. [ Links ] 20. McKelvey, W.;J. Robinson; R. Aitken. 1985. T he evaluation of a laparascopic insemination technique in ewes. Theriogenology 24: 519-535. [ Links ] 21. Mellisho, E.; E. Flores. 2004. Criopreservación de semen ovino en el Perú. Visión Veterinaria 4(1): [Internet]. [acceso 06 setiembre 2004]. Disponible en: http://www.visionveterinaria.com [ Links ] 22. Moses, D.; A.G. Martinez; l.G. Dorio; A. Valcarcel; A. Ham; H. Pessi; R. Castañón; A. Maciá; M.A De las Heras. 1997. A large-scale program in laparoscopic intrauterine insemination with frozen-thawed semen in Australian Merino sheep in Argentine Patagonia. Theriogenology 48: 651-657. [ Links ] 23. Nottle, M.B.; D.O. Kleemann; T.I. Grosser; R.F. Seamark. 1997. Evaluation of a nutritional strategy to increase ovulation rate in Merino ewes mated in late spring-early summer. Anim. Reprod. Sci. 47: 255-261. [ Links ] 24. Salamon, S.; R.J. Lightfoot. 1970. Fertility of ram spermatozoa frozen by the pellet method. III. The effects of insemination technique, oxytocin and relaxin on lambing. J. Reprod. Fert. 22: 409-423. [ Links ] 25. Salamon, S.; W.M.C. Maxwell. 2000. 26. Stellflug, J.N.; M.C. Wulster-Radcliffe; E.L. Hensley; E.A. Cowardin; R.C. Seals; G.S. Lewis. 2001. Oxytocin-induced cervical dilation and cervical manipulation in sheep: Effects on laparoscopic artificial insemination. J. Anim. Sci. 79: 560-573. [ Links ] 27. Shackell, G.H.; B. Kyle; R.P. Little-john. 1990. Factors influencing the success of a large scale artificial insemination programme in sheep. Proc. New Zealand Soc. Anim. Prod. 50: 427-430.
2 E-mail: emellisho@lamolina.edu.pe
3 Instituto Nacional de Investigación y Extensión Agraria (INIA) – C.E. La Molina, Lima, Perú
4 Centro de Investigación y Capacitación Campesina (CICCA), Pasco, Perú