Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.17 n.2 Lima jul./dic 2006
ARTÍCULOS PRIMARIOS
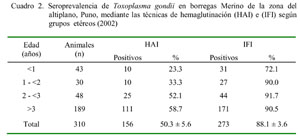
Concordancia entre las pruebas de hemaglutinación indirecta e inmunofluorescencia indirecta para determinar la prevalencia de Toxoplasma gondii en ovinos Sandra Huerta O.1; Amanda Chávez V.2,3; Eva Casas A.2; Néstor Falcón P.4 y Fernando Raymundo T.1 1 Práctica privada Resumen El objetivo del presente estudio fue medir el grado de concordancia entre las técnicas de hemaglutinación indirecta (HAI) y la inmunofluorescencia indirecta (IFI) para la detección de Toxoplasma gondii en ovinos. Se colectaron 310 sueros de ovinos hembras de diferentes edades del Fundo Santa María, distrito de Nuñoa, provincia de Melgar, Puno. Se halló un valor de Kappa (K) igual al 24% indicando un grado de asociación entre ambas técnicas del tipo regular. Con la prueba de Mc Nemar se encontró que existen diferencias significativas entre ambas, no siendo reemplazable una por la otra. La seroprevalencia para T. gondii fue de 50.3 ± 5.6%, por el método de HAI, y 88.1 ± 3.6%, por el método de IFI. La frecuencia por edades en animales <1, 1-2, 2-3, y >3 años fue de 23.2, 33.3, 52.1 y 58.7%, por el método de HAI, y de 72.0, 90.0, 91.2 y 90.5%, por el método de IFI, respectivamente. Palabras clave: HAI, IFI, ovino, toxoplasmosis, Puno Abstract The objective of this study was to measure the degree of concordance between the Indirect hemaglutination (HAI) and Indirect immunofluorescence (IFI) tests for Toxoplasma gondii detection in sheep. A total of 310 sera were collected from ewes of different ages at Fundo Santa María, district of Nuñoa, province of Melgar, Puno. The Kappa (K) value was 24%, showing that the degree of association between both techniques was of a regular type. The Mc Nemar test showed significative differences between both tests, so one cannot replace the other. The seroprevalence for T. gondii was 50.3 ± 5.6% through HAI test and 88.1 ± 3.5% through IFI test. Seroprevalence in animals <1, 1-2, 2-3, and >3 years of age was 23.2, 33.3, 52.1, and 58.7% through HAI test and 72.0, 90.0, 91.2, and 90.5% respectively through IFI test. Key words: HAI, IFI, sheep, toxoplasmosis, Puno Introducción La toxoplasmosis es una zoonosis de amplia distribución mundial (Braselli, 2003), producida por el protozoario Toxoplasma gondii que afecta un alto porcentaje de animales de sangre caliente, incluyendo al hombre (Amado Neto et al., 1995; Ortega-Mora, 1997). Los felinos, ya sean domésticos o silvestres, son los únicos hospederos definitivos y, por lo tanto, los principales difusores de la enfermedad, no mostrando sintomatología aparente (Cordero del Campillo y Rojo-Vásquez, 1999). La infección por T. gondii tiene manifestaciones clínicas diversas e inespecíficas, lo que hace difícil poder precisar el diagnóstico con certeza, por lo que se debe tener cuidado con el diagnóstico diferencial (Dubey, 1990). A la fecha se cuentan con diversas pruebas inmunológicas disponibles para el diagnóstico de la toxoplasmosis, las mismas que detectan IgG o IgM. Los títulos elevados de IgG indican la presencia de infección previa, mientras que la determinación de IgM demuestra toxoplasmosis aguda (Rojas, 1990). La técnica de hemaglutinación indirecta (HAI) no es muy específica, ya que presenta reacciones cruzadas con otros parásitos (Blood y Radostits, 1992), y su principal limitación es que no detecta anticuerpos en etapas tempranas, pues se alcanzan títulos diagnósticos a los 30 días de la infección (Rojas, 1990), aunque es una de las más usadas comercialmente; mientras que la prueba de inmunofluorescencia indirecta (IFI) requiere equipo sofisticado, es sensible, específica y reproducible (Soulsby, 1987) y detecta anticuerpos en suero desde los 10-14 días (IgG e IgM) (Rojas, 1990). En algunos países, T. gondii es uno de los principales agentes causantes de abortos infecciosos y reabsorción embrionaria en la ganadería ovina (Ameghino, 1988). Es una de las causas más importantes de aborto ovino en Nueva Zelanda, Australia, Inglaterra, Noruega, Francia y Estados Unidos; y en este último se determinó que T. gondii fue el agente que más abortos provocó en ovinos durante el decenio 1983-1993, superando a la clamydiosis y la campylobacteriosis, las cuales se consideraban, hasta ese momento, en primer término (Venturini et al., 1997). En países ovejeros como en Nueva Zelanda y Australia, se ha estimado entre 5 a 50% las pérdidas de corderos debido a la toxo-plasmosis (Rojas, 1990). El Perú cuenta aproximadamente con una población ovina de 12.1 millones (INEI, 1996), siendo la baja eficiencia reproductiva uno de los factores limitantes. Aqui se reportan tasas de abortos de 39% en borregas, 23% en caprinos, 70% en alpacas, 45% en llamas y 27% en vicuñas (Rojas, 1990). Es muy difícil establecer el diagnóstico preciso en T. gondii sin ayuda del laboratorio, sean estos métodos directos que demuestren la presencia del parásito o métodos indirectos que detecten anticuerpos específicos (o demostración de antígenos circulantes en casos agudos). Los métodos indirectos son los más usados por los laboratorios, por lo que se realiza el presente trabajo para determinar la concordancia que existe entre los resultados de la prevalencia del T. gondii en ovinos mediante el uso de la técnica de HAI e IFI. Materiales y Métodos Lugar de estudio El estudio se realizó en el mes de marzo del 2002 en el Fundo Santa María, distrito de Nuñoa, provincia de Melgar, departamento de Puno, en una zona eminentemente ganadera, especialmente para la producción de ovinos y alpacas. La zona presenta una altitud media de 4,000 msnm, con una estación seca de mayo a agosto y una temperatura medioambiental de 0 a 15 °C. Animales y tamaño muestral Se tomó una muestra al azar, representativa de la población de ovejas hembras de la raza Merino, que son criadas en pasturas naturales. El manejo de estos animales no es tecnificado y no se distribuyen por grupos etáreos o por niveles productivos. El número de animales por muestrear fue determinado mediante la fórmula de poblaciones finitas (Daniel, 1996), resultando un total de 306; sin embargo, por fines prácticos se llegaron a muestrear 310 animales. Para efectos del análisis estadístico, los animales se distribuyeron por edad en grupos de <1 año, 1-2 años, de 2-3 años y >3 años. Muestras y su procesamiento La toma de muestra de sangre se realizó por punción de la vena yugular. El suero resultante se colocó en microtubos (2 ml) y se almacenó a -20 °C hasta su procesamiento en el Laboratorio de Parasitología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos en Lima. Para determinar la presencia de anticuerpos anti-Toxoplasma gondii se utilizaron las pruebas de Hemaglutinación Indirecta (HAI), mediante el uso de un kit de diagnóstico Toxo Test, y la prueba de Inmunofluorescencia Indirecta (IFI), con una dilución de 1:50, utilizando conjugado comercial (Sigma®), y como antígeno a taquizoítos fijados que fueron proporcionados por la Universidad Complutense de Madrid. Análisis de datos El grado de concordancia entre las dos técnicas empleadas se midió con la prueba de Kappa, y para determinar si las pruebas son mutuamente reemplazables se usó la prueba de Mc Nemar (González y Falcón, 1999). Además, se determinó la prevalencia de T. gondii con las dos técnicas serológicas, discriminando la frecuencia de infección para cada categoría de edad. Resultados y Discusión La HAI es una técnica que se viene utilizando en clínicas y hospitales veterinarios, el antígeno es de fácil obtención en el comercio y ofrece resultados rápidos, requiere una pequeña cantidad de sangre o suero y tiene una mayor facilidad de ejecución e interpretación de los resultados (Suárez et al., 2002), por lo que su uso es práctico y recomendable (Camargo et al., 1986; Ishizuka et al., 1986). La prueba de IFI es específica y sensible (Araujo, 1999; Dubey, 1990; Frenkel, 1997;) pero tiene el inconveniente de requerir equipo sofisticado (Suárez et al., 2002), básicamente el alto costo del microscopio de inmunofluorescencia (Corcuera et al., 1981), además de presentar subjetividad en la lectura (Camargo et al., 1998). En el Cuadro 1 se presentan los resultados de los 310 sueros de borregas hallados mediante las técnicas de HAI e IFI. La prueba de Kappa indicó una concordancia regular de 0.24, mientras que la prueba de Mc Nemar detectó una diferencia significativa entre las técnicas, demostrando que una prueba no puede ser reemplazada por la otra. Estudios similares realizados en cerdos mediante las pruebas de HAI e IFI encontraron un Kappa de 0.46 y Mc Nemar con diferencia significativa (Germani y Pacheco, 2002). Así mismo, en otro estudio con cerdos se obtuvo un índice de Kappa de 0.69 (Ishizuka et al.,1986). En un trabajo en humanos, la prueba de HAI fue comparable a la prueba de IFI en cuanto a sensibilidad y especificidad (Camargo et al., 1986), aunque en otros estudios por el mismo grupo se obtuvo un mayor número de positivos con la prueba de IFI, posiblemente debido a la falta de detección de antígenos de superficie por parte de la prueba de HAI (Camargo et al. 1988). En caninos se ha encontrado una alta correlación entre IFI y ELISA, y baja entre IFI y HAI (Silva et al., 1981), en tanto que un estudio en ovejas se obtuvo una mayor confiabilidad en los resultados de la prueba de IFI, ya que pueden ocurrir falsos negativos en la HAI debido a la interferencia con IgM (Silva, 2001). Estos resultados permiten presumir que el grado de concordancia entre las pruebas tiende a oscilar de regular a moderado según sea la especie animal que se evalúe. Así mismo, la mayoría de autores concluyen que la especificidad y sensibilidad varían según la prueba empleada, obteniéndose los mejores resultados con la prueba IFI que con HAI, pero que sería recomendable el uso de dos técnicas para el diagnóstico (Camargo et al., 1998; Silva et al., 1997). La seroprevalencia del T. gondii en los ovinos bajo estudio fue de 50.3 ± 5.6 y 88.1 ± 3.6%, con las técnicas de HAI e IFI, respectivamente (Cuadro 2). La seroprevalencia por el método de HAI resultó similar a los valores serológicos encontrados por otros autores en el Perú con la misma técnica. Así, Leguía et al. (1987) encuentran una prevalencia de 48% en borregas con historial de aborto, y Samamé et al. (1983) reportan una prevalencia de 68.4 y 53.8% para la época lluviosa y seca, respectivamente, en ovinos de Ancash, Junín y Puno. Rojas (1990) reporta prevalencias para ovinos de 39%, y Contreras y Tejada (1974) reportaron valores entre 73 y 100% en seis departamentos del país. Así mismo, las frecuencias de T. gondii por grupo de edades fueron similares a otros estudios (Leguía et al., 1987). En este estudio, las frecuencias según el grupo etáreo por el método de IFI variaron desde 72.1% en animales <1 año hasta 91.7% en animales de 2-3 años. La información existente en el país con el método de IFI es escasa; sin embargo, un estudio en el departamento de Junín señala frecuencias de 55.1, 65.9 y 72.9% en ovejas de 2-3, 3-4 y >4años, respectivamente (Caldas, 2004). Conclusiones Literatura Citada 1. Amato Neto, V.; E.AS. Medeiros; G.C. Levi; M.I.S. Duarte. 1995. Toxoplasmose. 2ª ed. p 3-4. Ed. Sarvier. São Paulo. [ Links ] 2. Ameghino, E. 1988. Avances sobre investigación en salud animal - ovinos. Bol. Div. UNMSM 21: 50-51. [ Links ] 3. Araujo, F.A.P. 1999. Avaliacao soro-epidemiológica de anticorpos para Toxoplasma gondii Nicolle y Mancea-ux, 1909, em soros de suínos (Sus scrofa) da regiao da grande Erenchim, RS- Brasil, detectados através das técnicas de imunofluorescencia indireta e inmunoenzimática. Río de Janeiro-RJ. Tese (Doctorado). Instituto Oswaldo Cruz. 125 p. [ Links ] 4. Blood, D.C; O.M. Radostits. 1992. Medicina Veterinaria. 6ª ed. p 1083-1087. Ed. Interamericana. España. [ Links ] 5. Braselli, A. 2002. Toxoplasmosis. Infecto. Disponible en: http://infecto.edu.uy/indicetana.html [ Links ] 6. Caldas, P. 2004. Seroprevalencia de Toxoplasma gondii en una empresa ganadera de la Sierra Central-Junín. Tesis de Médico Veterinario. Facultad de Medicina Veterinaria, Univ. Nacional Mayor de San Marcos. Lima. 77 p. [ Links ] 7. Camargo, M.; A. Ferreira; A. Rocca; Z. Belem. 1986. Um test prático para a sorologia da toxoplasmose: o teste de hemaglutinacao. Estudo comparativo com os testes de imunofluorescencia e imunoenzimático de captura de Ig M. Ver. Brasileira Patol. Clin. 22: 196-201. [ Links ] 8. Camargo, A.; A. Silva; H. Marrocos; J. Rosenail; L. Olivera; R. Falcao. 1998. Estudo comparativo entre diferentes métodos para diagnóstico da toxoplasmose humana. Newslab. 28: 121-128. [ Links ] 9. Contreras, O.; A. Tejada. 1974. Estudio serológico sobre toxoplasmosis en ganado ovino beneficiado en Lima-Perú. Rev. Per. Biol. 1: 147-153. [ Links ] 10. Corcuera, M.T.; J. Lozada; R-F. López. 1981. Estudio comparativo de las distintas técnicas serológicas utilizadas para el diagnóstico de la toxoplasmosis. Revista de Sanidad e Higiene Pública 55: 1045-1059. [ Links ] 11. Cordero del Campillo, M; F. Rojo-Vásquez. 1999. Parasitología veterinaria. p 333-341, 583, 665-669. Ed. Interamericana. España. [ Links ] 12. Daniel, W. 1996. Bioestadística. Base para el análisis de las ciencias de la salud. 5ª ed. p 205-207. Ed. Limusa. México. [ Links ] 13. Dubey, J. 1990. Diagnosis of livestock abortion due to Toxoplasma gondii. En: Laboratory diagnosis of livestock abortion. 3a ed. p 168. Iowa State University Press. Ames, USA. [ Links ] 14. Frenkel, J. 1997. Toxoplasmose. En: Tratado de infectología. p 1290-1306. Veronesi, R.; Foccacia, (eds). Atheneu, Sao Paulo. [ Links ] 15. Germani, C.; F. Pacheco. 2002. Comparacao entre os testes de inmuno-fluorescencia indirecta e hemaglutinacao indirecta para deteccao e anticorpos anti Toxoplasma gondii em soros de suínos. Acta Scientiae Veterinariae 30: 185-189. [ Links ] 16. González, A.; N. Falcón. 1999. Análisis de datos en Medicina Veterinaria. Pub. Tec. FMV, Lima N° 49: 57-58. [ Links ] 17. Ishizuka, M.; J. D Angelino; J. Souza. 1986. Toxoplasmosoe suína II. Estudo comparativo das provas de imunofluo-rescencia indireta e hemaglutinacao para avaliacao de anticorpos anti-toxoplasma em soros suínos. Boletín de la Oficina Sanitaria Panamericana 100: 524-530. [ Links ] 18. INEI. Instituto Nacional de Estadística e Informática. 1996. III Censo Nacional Agropecuario. Compendio Estadístico. p 24-26, 2241-2251. Dir. Tec. Censos y Encuestas. INEI. Lima. [ Links ] 19. Leguía, G.; C. Guerrero; P. Dionisio. 1987. Toxoplasma gondii en borregas abortadas y con mortalidad de crías. Rev. Cien. Vet. FMV-UNMSM 3: 23-25. [ Links ] 20. Ortega-Mora, L.M. 1997. Toxo-plasmosis y neosporosis. Rev. Ovis 52: 11-73. [ Links ] 21. Rojas, M. 1990. Parasitismo de los rumiantes domésticos. p 326-334. Ed. Mijosa. Lima. [ Links ] 22. Samamé, H.; E. López; J. Reif. 1983. Toxoplasmosis en ovinos de la sierra del Perú. Resúmenes Proy. Inv. UNMSM 3: 52-53. [ Links ] 23. Silva, J. 2001. Analise de tranmissao congenita deToxoplasma gondii em ovinos em duas propriedades no municipio de Rosario do Sul. Dissertacao (Mestrado). Universidade Federal de Santa Maria-RS. Santa Maria-RS. 16 p. [ Links ] 24. Silva, D.; D. Cabral; B. Bernardina; M. Souza; J. Mineo. 1997. Detection of Toxoplasma gondii-especific antibodies in dog. A comparative study of immunoenzymatic, immunofluo-rescent and haemagglutination titres. Memorias do Instituto Oswaldo Cruz 92: 785-789. [ Links ] 25. Silva, N.; E. Chaplin; L. Méndez; F. Araujo. 1981. Determinacao de anticorpos toxoplásmicos em soros de suínos abatidos em matadouros, na regiao do Alto Taquari, RS, Brasil. Arq. Fac. Vet. UFRGS, Porto Alegre 9: 33-38. [ Links ] 26. Soulsby, E. 1987. Parasitología y enfermedades parasitarias en los animales domésticos. 7ª ed. p 681-693. Ed. Interamericana. México. [ Links ] 27. Súarez, F.; H. Andrade; A. Galisteo; O. Miguel. 2002. Concordancia de la pruebas de ELISA y hemaglutinación indirecta en el diagnóstico de la toxoplasmosis porcina. Rev. Inv. Vet., Perú 13: 84-86. [ Links ] 28. Venturini, L.; M. Venturini; I. Omata; G. De Carolis. 1997. Toxoplasma gondii en gatos mediante las pruebas de inmunofluorescencia y de aglutinación de látex. Vet. Argentina 12: 48-50. [ Links ]
2 Laboratorio de Microbiología y Parasitología Veterinaria, FMV-UNMSM
3 E-mail: a_chavez_g@hotmail.com
4 Laboratorio de Medicina Veterinaria Preventiva, FMV-UNMSM