Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.18 n.2 Lima jul./dic. 2007
ARTÍCULOS PRIMARIOS
Diarrea viral bovina y animales portadores del virus en hatos productores de leche de la irrigación de Majes, Arequipa
Bovine viral diarrhoea and persistently infected animals in dairy herds in Majes, Arequipa
Juan C. Huamán G.1 ; Hermelinda Rivera G.1,2 ; Mariluz Araínga R.1 ; César Gavidia Ch.3 ; Alberto Manchego S.1
1 Laboratorio de Microbiología y Parasitología Veterinaria
3 Laboratorio de Medicina Veterinaria Preventiva, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 E mail: hriverag2005@yahoo.es
RESUMEN
El objetivo del presente estudio fue determinar la prevalencia del virus de la diarrea viral bovina (VDVB) y de animales persistentemente infectados (PI) en bovinos productores de leche en la Irrigación de Majes, Arequipa. En la primera fase del estudio, se colectaron 204 muestras de leche de tanque (una por hato) en la planta local de procesamiento de leche, para la detección de anticuerpos contra el VDVB mediante la prueba de ELISA indirecta. En la segunda fase se seleccionaron de modo arbitrario a 57 hatos con anticuerpos contra el VDVB con densidades ópticas (DO) iguales o mayores a 0.900. Se colectaron 286 muestras de suero sanguíneo de estos hatos para conocer el estado serológico de cada animal y la búsqueda de animales PI mediante ELISA indirecta y ELISA de captura, respectivamente. En la tercera fase se obtuvieron muestras de suero de la totalidad de terneras y vaquillas (n = 20) de tres hatos que tuvieron animales PI a fin de buscar más animales PI. El 98.0 ± 1.9% (200/204) de las muestras de leche resultaron positivas a anticuerpos contra el VDVB con DO que fluctuaron entre 0.300 a 2.350. De las 286 muestras de suero pertenecientes a los 57 hatos, el 47.2% (135/286) tuvieron anticuerpos contra el VDVB; además, dentro del grupo de animales seronegativos se detectaron cuatro (2.7%) animales PI que pertenecieron a tres de los 57 hatos muestreados. En los animales de riesgo de los tres hatos (n = 20), se detectaron otros dos animales PI, sumando un total de seis (4.0%); además, estos seis animales PI no presentaron anticuerpos contra el VDVB. En conclusión, los resultados muestran una amplia distribución del VDVB en la población bovina de los hatos de la Irrigación Majes; así mismo, las muestras que presentan altas DO evidencian la presencia de animales PI y, por último, la muestra de leche de tanque reemplaza al suero en la detección de anticuerpos contra el VDVB.
Palabras clave: bovinos, diarrea viral bovina, virus, anticuerpos, animales persistentemente infectados, suero, leche, tanque de leche, hato lechero.
ABSTRACT
The objective of this study was to determine the prevalence of bovine viral diarrhoea virus (BVDV) and persistently infected (PI) animals in dairy herds located in Majes, Arequipa, Peru. In the first phase, 204 bulk tank milk samples from to 204 herds were collected al the local commercial processing plant in Majes for detection of antibodies against BVDV by indirect ELISA test. In the second phase, 286 blood samples were collected from 57 strong positive (Optical Density [OD] ≥ 0.900) herds for the detection of antibodies against BVDV and in PI animals by the indirect and capture ELISAs respectively. In the third phase, blood samples were collected from all animals ranging from 6 to 24 months of age from three herds that had at least one PI animal. The prevalence of BVDV in the 204 herds was 98.0 ± 1.9% (200/204), and the level of antibodies ranged from 0.300 to 2.350 OD. The 47.2% (135/286) of serum samples had antibodies against BVDV, and within the negative samples, four (2.7%) animals from three herds were PI. Later on, additional PI animals were also detected in these three herds, and none of the six (4.0%) developed antibodies against BVDV. In conclusion, the results indicate that BVDV is widespread in dairy herds in Majes, the high level of antibodies suggests the presence of PI animals in the bovine population and finally, bulk tank milk samples are very useful for antibody detection from milking cows.
Key words: bovine, bovine viral diarrhoea virus, antibodies, persistently infected animals serum, milk, bulk tank milk, dairy herd.
INTRODUCCIÓN
La industria lechera del país está concentrada, principalmente, en las cuencas de Arequipa, Lima y Cajamarca (MINAG, 1996). Actualmente, esta importante industria está extendiéndose hacia zonas como Trujillo en la Libertad y el valle del Mantaro en Junín; pero en el futuro, posiblemente, se expanda hacia otros valles interandinos con disponibilidad de recursos forrajeros.
La cuenca lechera de Arequipa es la principal del país, cuenta con una población aproximada de 50,000 vacas en producción y contribuye con el 22% de la producción lechera nacional (Andresen, 2001). La cuenca está conformada por varias irrigaciones, entre ellas Santa Rita, La Joya y Majes, estando más de la mitad de sus áreas cultivadas dedicadas al forraje. La producción lechera (480,000 L/día) de estas irrigaciones, que representa más del 60% de la producción total de la cuenca (C. Ortiz, comunicación personal), se concentra principalmente entre los pequeños productores que guardan la leche en porongos, los cuales son recolectados y transportados hacia las plantas procesadoras de grandes empresas como Gloria S.A. y Laive S.A. (Olivera, 2001).
La industria lechera en el país afronta serios limitantes en su desarrollo. Algunos de estos factores son las enfermedades infecciosas como la neosporosis y diarrea viral bovina (DVB), causados por el parásito Neospora caninum y el virus de la DVB (VDVB), respectivamente (Olivera, 2001). Las consecuencias de la infección transplacentaria del VDVB son ampliamente conocidas, sobre todo en bovinos de hatos lecheros (Houe, 1999, 2003). El efecto de estas enfermedades sobre la eficiencia productiva y reproductiva de los animales y el impacto económico para la industria lechera han permitido realizar numerosas investigaciones tendientes a conocer la epidemiología, patogénesis y biología del virus, conocimientos que están haciendo posible el control y erradicación de la enfermedad (Ståhl et al., 2006).
Los resultados de los estudios que se vienen efectuándo sobre la DVB, indican que el virus está ampliamente difundido en las principales cuencas lecheras del país (Contreras et al., 2000). Estudios previos sobre la DVB en la cuenca de Arequipa evidenciaron la infección en algunos establos de crianza intensiva, principalmente en Santa Rita (H. Rivera, datos no publicados), pero no se había involucrado a las ganaderías de otras áreas como Majes. La ganadería en esta última área está constituida principalmente por pequeños ganaderos con 5 a 10 vacas en producción que constituyen el sustento de sus familias. Por otro lado, es conocido el alto costo de los estudios de prevalencia, ya que requieren de mucho material y esfuerzo en el muestreo individual, además del estrés causado a las vacas en producción. En países como Dinamarca y Suecia, se utiliza la leche para detección de anticuerpos contra varias enfermedades virales, entre ellas la DVB, ya que las inmunoglobulinas se encuentran también en la leche y pueden proporcionar valiosos datos epidemiológicos a nivel de hatos (Lindberg y Alenius, 1999; Pritchard, 2001).
El objetivo del presente estudio fue determinar la prevalencia de hatos seropositivos al VDVB y la presencia de animales persistentemente infectados en la irrigación de Majes, utilizando muestras de leche y sangre de animales de 6 a 24 meses de edad que son considerados como grupo en riesgo por su alta susceptibilidad al VDVB.
MATERIALES Y MÉTODOS
Diseño Experimental
El estudio se llevó a cabo en la Irrigación de Majes, situado en el departamento de Arequipa, a una altura de 1000 a 1500 msnm, y en el Laboratorio de Virología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (FMV-UNMSM), Lima.
El cálculo del tamaño muestral (n=196 hatos) se obtuvo mediante la fórmula descrita por Daniel (1996) utilizando una prevalencia referencial de 85% (H. Rivera, trabajo no publicado), 95% de confianza y un error máximo del 5%. Sin embargo, se utilizaron 204 hatos, cada uno constituido por un promedio de 5 a 15 animales.
Los animales involucrados en el estudio fueron vacas en producción y hembras de 6 a 24 meses de edad. El estudio se realizó en tres fases consecutivas:
Primera fase:
La leche de los productores se transporta diariamente en porongos hasta la planta de procesamiento de leche de la empresa Gloria S.A. en Majes. En la planta se colectaron 10 ml de leche de un porongo, escogido al azar, por hato y trasladadas a la FMV-UNMSM, donde se descremaron por centrifugación y guardadas a -20 ºC hasta el momento de la realización del ELISA indirecta para la detección de anticuerpos contra el VDVB.
Segunda fase:
Se seleccionaron 57 hatos que mostraron niveles altos de anticuerpos contra el VDVB (Densidad Óptica [DO] ≥ 0.900) en la primera fase. En estos hatos se colectaron 286 muestras de sangre de la vena caudal media de animales de 6 a 24 meses de edad (grupo en riesgo) escogidos al azar (n = 5/hato) para la determinación de anticuerpos contra el VDVB. En los animales que resultaron negativos a anticuerpos, se realizó la búsqueda de antígeno viral mediante ELISA de captura, para identificar a los animales persistentemente infectados (PI).
Tercera fase:
En los hatos donde se detectaron uno o más animales PI, se procedió a muestrear al resto de los animales del grupo en riesgo para identificar a todos los animales PI.
Detección de anticuerpos y antígeno viral
Los anticuerpos contra el VDVB fueron detectados mediante la prueba de ELISA indirecta (SVANOVA Biotech, Suecia) y el antígeno del VDVB fue detectado mediante la prueba de ELISA de captura (IDEXX, USA). En ambos casos se siguió el protocolo descrito por los fabricantes.
Según el protocolo de ELISA indirecta, una muestra de leche se consideró como positiva a anticuerpos contra VDVB si presentó una DO >0.300; así mismo, la muestra de suero fue considerada positiva a anticuerpos contra VDVB si presentó una DO >0.250. DOs menores fueron consideradas negativas. De igual forma, de acuerdo al protocolo de ELISA de captura, una muestra fue considerada positiva a antígeno del VDVB si presentó una DO >0.400 y negativa con DO menores.
Análisis de datos
La prevalencia de anticuerpos fue expresada según fórmula descrita por Thrusfield (1990) y con intervalos de confianza (IC) del 95%. El número de animales positivos a anticuerpos en suero en la segunda y aquellos positivos a antígeno en la tercera fase, fueron expresados en porcentaje.
RESULTADOS
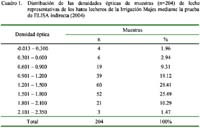
De los 204 hatos muestreados en la primera fase, 200 resultaron positivos a anticuerpos contra el VDVB, representando una prevalencia de 98.0 ± 1.9%. El Cuadro 1 muestra la distribución de los niveles de anticuerpos medidos en DOs de las muestras de leche detectadas mediante la prueba de ELISA indirecta.
De las 286 muestras de suero colectados en los 57 hatos en la segunda fase, 135 (47.2%) resultaron positivas a anticuerpos contra el VDVB y 151 (52.8%) resultaron negativas. De estas últimas, 4 (2.7%) correspondieron a animales PI, los cuales pertenecieron a tres de los 57 hatos (Cuadro 2).
En la tercera fase se muestreó el total (n = 20) de las terneras y vaquillas (animales del grupo en riesgo) de los tres hatos donde se detectaron los primeros animales PI. El ELISA de captura confirmó los cuatro primeros PI hallados y permitió encontrar a otros dos animales PI (Cuadro 3). Así mismo, se determinó que dos de los seis animales fueron madre e hija. Adicionalmente, se titularon los anticuerpos neutralizantes contra el VDVB de los animales en riesgo de los tres hatos observándose la ausencia de anticuerpos en los seis animales PI.
DISCUSIÓN
Estudios previos reportan que el VDVB se encuentra ampliamente difundido en las principales cuencas lecheras y valles interandinos del país (Contreras et al., 2000; Chacón et al., 2003; Morales et al., 2003; Rivera et al., 2003; Jayashi et al., 2005); sin embargo, la prevalencia del VDVB no había sido establecida en la irrigación de Majes en Arequipa a pesar de existir reportes de que la infertilidad es uno de los principales problemas en el ganado bovino de esta área (Olivera, 2001).
El 98.1% (200/204) de los hatos muestreados presentaron evidencia de infección viral, confirmándose la amplia distribución del VDVB en la población bovina productora de leche de la Irrigación Majes. Los anticuerpos detectados indican la exposición de los animales al virus de campo, ya que la mayoría de ganaderos no utilizan la vacunación para prevenir la ocurrencia de la DVB. Al analizar los resultados de las muestras de leche se observó que la mayoría poseía DO altas y que variaron entre 0.900 y 1.800, alcanzando incluso una un DO de 2.350 (Cuadro 1). Cada tanque contenía la leche de todas o de un grupo de vacas en producción del hato y al presentar DO altas significa, que si no todas, al menos algunas vacas presentan títulos elevados de anticuerpos que fueron detectados en la prueba. La alta prevalencia de la DVB en estos hatos, así como los altos títulos detectados, evidencian la existencia de fuentes de infección en la zona. Estas fuentes serían los animales PI (Lindberg y Alenius, 1999) y los animales con infecciones agudas, en ambos casos, favorecido por la cercanía entre hatos y la ausencia de medidas de bioseguridad. Los animales con infecciones agudas se recuperan rápidamente y los títulos de anticuerpos descienden en forma lenta pudiendo persistir por largo tiempo (Fredriksen et al., 1999).
El 47.2% (135/286) de las muestras de suero obtenidas de animales de los 57 hatos seleccionados para la segunda fase del estudio presentaron anticuerpos contra el VDVB y el 52.8% (151/286) resultaron negativas (Cuadro 2). La diferencia en el porcentaje de positividad con respecto a lo obtenido con la leche, indica que la presencia de un solo animal seropositivo en un hato es suficiente para que la muestra de leche resulte positiva, aun si el resto de animales son seronegativos (Niskanen, 1993). Además, sólo se consideraron vacas en producción cuando se analizaron las muestras de leche y estos animales tuvieron más de 2 años de edad y la probabilidad de que hubieran sufrido un desafío es mayor que en animales de menor edad.
La búsqueda de los animales PI en las muestras que resultaron seronegativas se hizo bajo el concepto de que los animales PI son incapaces de seroconvertir en anticuerpos por ser inmunotolerantes al VDVB presente en su organismo (Houe, 1995; Grooms, 2004), por lo que permanecen seronegativos pero eliminando virus en forma constante a través de sus secreciones. No se supo con exactitud la edad de los cuatro animales PI, pero estuvieron dentro del grupo de animales en riesgo. Los animales PI usualmente mueren dentro del primer año de vida por infecciones secundarias (Houe, 1995) o son eliminados por su pobre condición física, aunque en algunos casos pueden tener condición normal y llegar a la etapa reproductiva, pero sin duda, la cría que generen tendrá igualmente la condición de PI (Duffel y Harkness, 1985). Los animales de pobre condición física constituyen un problema para el ganadero por lo que son eliminados tempranamente, en la mayoría de las veces, sin saber que fueron PI.
La detección de sólo 5.3% (3/57) de animales PI en de los hatos estudiados en la segunda fase podría deberse a varios factores que evitaron la detección de estos PI, tales como su eliminación temprana del hato o muerte por infecciones secundarias o porque no fueron identificados al usarse un muestreo aleatorio. Si bien, la prueba de ELISA de captura tiene un alta especificidad (98%) y sensibilidad (97%), no garantiza la detección de todos los animales PI si durante la toma de muestra no hubiera suficiente antígeno o virus circulante (Mars y Van Maanen, 2005). Cabe la posibilidad de que hubiera más animales PI, ya que los datos sobre la presencia de estos animales mostrados en el presente estudio, son sólo referenciales y demostrativos.
Existen reportes que indican que los animales PI pueden generar anticuerpos si se exponen a virus antigénicamente diferentes a la cepa viral que dio origen al animal PI, ya que la inmunotolerancia en los Pestivirus es específica al virus infectante (Bruschke et al., 1998). Los animales PI detectados en este estudio no presentaron anticuerpos contra el virus sugiriendo que no fueron reinfectados con cepas del VDVB antigénicamente diferentes. Similares resultados se han obtenido en otros animales PI (H. Rivera, comunicación personal). Algunos animales normales (no PI) presentaron títulos bajos (1:4), e incluso uno fue negativo a anticuerpos, lo que significa que un animal seronegativo no es necesariamente PI.
La amplia distribución del VDVB en los animales de Majes puede deberse a varios factores, tales como la cercanía de los potreros en donde pastan los animales, introducción al hato de animales sin un análisis clínico y de laboratorio, falta de información de los ganaderos acerca de la enfermedad y de animales PI, entre otros (Valle et al., 1999). Los resultados encontrados concuerdan con los reportes que indican que la presencia de animales PI es determinante para la diseminación y mantenimiento del VDVB en las poblaciones bovinas (Houe, 1995). Debido a este concepto, la identificación y eliminación del animal PI del hato, conjuntamente con rígidas medidas de bioseguridad, representa la estrategia principal en el control y erradicación de la enfermedad DVB en varios países nórdicos (Lindberg y Alenius, 1999).
Dinamarca, Finlandia y Suecia, entre otros, están llevando a cabo exitosos programas gubernamentales de control de la DVB (Lindberg y Alenius, 1999). Estos programas incluyen métodos de diagnóstico como el ELISA en leche, por la facilidad de colección, la importancia de la información que proporciona, su menor costo, etc. Por ello, su uso en los programas de control - erradicación de la DVB ha sido recomendado (Pritchard, 2001; Ståhl et al., 2002; Mars y Van Maanen, 2005).
En el presente trabajo se utilizó leche de porongo como alternativa al suero sanguíneo debido a dos razones fundamentales. La primera, que existe buena correlación entre las concentraciones de anticuerpos presentes en el suero y la leche con respecto a infecciones por VDVB y otros agentes (Pritchard, 2001), al ser la IgG la principal inmunoglobulina presente en leche y calostro (Tizard, 2002). La segunda, que la obtención de muestras de leche de porongo es una alternativa de muestreo muy ventajosa ya que se hace a menor costo, evita el estrés de manejo, promueve la bioseguridad del hato al restringir el muestreo individual de los animales, etc. (Pritchard, 2001). El muestreo de leche permite también realizar la vigilancia epidemiológica de la DVB a nivel de hato. Por ejemplo, los cuatro hatos que resultaron negativos a anticuerpos contra el VDVB indican que estos no estuvieron expuestos al virus, información que es obtenida con rapidez y sin la necesidad de muestrear los animales individualmente.
CONCLUSIONES
-
El VDVB se encuentra ampliamente diseminado entre los hatos de bovinos productores de leche de la Irrigación de Majes, Arequipa.
-
Los animales PI fueron detectados en hatos donde los animales tuvieron altos títulos de anticuerpos contra el VDVB.
-
La leche puede ser utilizada para la detección de anticuerpos contra el VDVB en animales productores de leche.
Agradecimientos
Los autores agradecen a los ganaderos de Majes por su colaboración en la toma de las muestras. Así mismo, al Ing. César Ortiz por su valioso apoyo en el aspecto logístico.
El presente estudio fue parcialmente financiado por el Consejo Superior de Investigaciones de la UNMSM.
LITERATURA CITADA
1. Andresen H. 2001. Lechería en la región andina: algunos aspectos de producción y salud pública. [Internet]. [acceso 01 setiembre 2006]. Disponible en: http://capra.iespana.es/capra/datos/andes.html
2. Bruschke C, Haghparast A, Hoek A, Rutten V, Wentink G, Van Rijn P, Van Oirschot J. 1998. The immune response of cattle, persistently infected whith noncytopathic BVDV, after superinfection with antigenically semi-homologous cytopathic BVDV. Vet Immunol Immunopathol 62: 37-50.
3. Contreras G, Ståhl K, Arana C, Rivera H. 2000. Anticuerpos contra el virus de la diarrea viral bovina en muestras de leche de bovinos del valle del Mantaro (Jauja, Concepción y Huancayo). Rev Inv Vet, Perú 11(1): 58-65.
4. Chacón J, Benito A, Rivera H. 2003. Detección de animales portadores del virus de la diarrea viral bovina en un establo vacunado y en otro sin vacunar del valle de Lima. Rev Acad Peru Cienc Vet 3(1): 14-23.
5. Daniel W. 1996. Bioestadística: Base para el análisis de la ciencias de la salud. 3ª ed. México: Ed. Limusa. p 198-206.
6. Duffel S, Harkness J. 1985. Bovine virus diarrhoea-mucosal disease infection in cattle. Vet Rec 117: 240-245.
7. Fredriksen B, Sandvick T, Løken T. Odegaard S. 1999. Level and duration of serum antibodies in the cattle infected experimentally and naturally with bovine virus diarrhoea virus. Vet Rec 144: 111-114.
8. Grooms D. 2004. Reproductive consequences of infection with bovine viral diarrhoea virus. Vet Clin North Am: Food Anim Pract 20: 5-19.
9. Houe H. 1995. Epidemiology of bovine virus diarrhoea. Vet Clin North Am: Food Anim Pract 11(3): 521-548.
10. Houe H. 1999. Epidemiological features and economical importance of bovine viral diarrhoea virus (BVDV) infections. Vet Microbiol 64: 89-107.
11. Houe H. 2003. Economic impact of BVDV infection in diaries. Biologicals 31: 137-143.
12. Jayashi C, Gaviria C, Araínga M, Manchego A, Rivera H. 2005. Dinámica de seroconversión en hembras bovinas post eliminación de animales portadores del virus de la diarrea viral bovina. Rev Inv Vet, Perú 16(1): 56-64.
13. Lindberg A, Alenius A. 1999. Principles for eradication of bovine viral diarrhoea virus (BVDV) infection in cattle populations. Vet Microbiol 64: 197-222.
14. Mars M, Van Maanen C. 2005. Diagnostic assays applied in BVDV control in the Netherlands. Prev Vet Med 72: 43-48.
15. [MINAG] Ministerio de Agricultura, Perú. 1996. Producción pecuaria e industria avícola. Presidencia de la República. Documento de consulta. Lima: MINAG.
16. Morales S, Benito A, Rivera H. 2003. Terneros persistentemente infectados con el virus de la diarrea viral bovina en dos hatos lecheros de la provincia de Arequipa. Rev Acad Peru Cien Vet 3(1): 8-13.
17. Niskanen R. 1993. Relationship between the levels of antibodies to bovine viral diarrhoea virus in bulk tank milk and the prevalence of cows exposed to the virus. Vet Rec 133: 341-344.
18. Olivera L. 2001. Sanidad del ganado lechero de la cuenca del sur. Rev Inv Vet, Perú 12(2): 78-86.
19. Pritchard G. 2001. Milk antibody testing in cattle. Farm Anim Pract 2001: 542-549.
20. Rivera H, Huamán K, Benito A, Díaz A, Arana C. 2003. Prevalencia del virus de la diarrea viral bovina y animales portadores del virus en un hato lechero del valle del Mantaro. Rev Acad Peru Cienc Vet 3(1): 1-7.
21. Ståhl K, Rivera H, Vågsholm J, Moreno-López J. 2002. Bulk milk testing for antibody seroprevalences to BVDV and BHV-1 in a rural region of Peru. Prev Vet Med 56: 193-202.
22. Ståhl K, Björkman C, Emanuelson U, Rivera H, Zelada A, Moreno-López J. 2006. A prospective study of Neospora caninum and BVDV infections on bovine abortions in a dairy herd in Arequipa, Peru. Prev Vet Med 75: 177-188.
23. Thrusfield M. 1990. Epidemiología veterinaria. Zaragoza: Ed. Acribia. p 228-230.
24. Tizard I. 2002. Inmunología veterinaria. 6ª ed. México: Ed. McGraw-Hill Interamericana. 517 p.
25. Valle P, Martin S, Tremblay R, Bateman K. 1999. Factors associated with being a bovine-virus diarrhoea (BVD) seropositive dairy herd in the More and Romsdal County of Norway. Prev Vet Med 40: 165-177.