Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.19 n.2 Lima jul./dic. 2008
Comparación productiva de pollos de carne criados en camas nuevas vs. Cama reutilizada por cinco campañas
Productive performance of broilers reared on new litters vs. Reused litters during five flocks
María del Pilar Vejarano R.1, Mónica Alba Ch.1,2, Pablo Reyna S.1,3 y Eva Casas A.4
1 Laboratorio de Patología Aviar
2 Dirección actual: San Fernando S.A., Lima, Perú
3 E-mail: reynapa2002@yahoo.com
4 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
RESUMEN
Se evaluó el rendimiento productivo y la calidad sanitaria de pollos de carne criados sobre cama nueva y cama reutilizada. Se crió 250 pollos machos de la línea Ross 308, 125 en cama nueva y 125 en cama reutilizada por cinco campañas. Semanalmente se obtuvo datos de parámetros productivos, nivel de amoniaco, recuento de ooquistes por gramo de cama y recuento de UFC/g de cama de coliformes, mesófilos y hongos en ambos grupos. Además, se evaluó el nivel de anticuerpos mediante ELISA para bronquitis infecciosa, Newcastle, Gumboro, anemia infecciosa y reovirus al inicio y al final de la crianza (día 49). No hubo diferencia estadística entre grupos con relación a los parámetros productivos. Tampoco se encontró diferencias estadísticas en los niveles de amoniaco y recuento de ooquistes, pero el recuento de UFC/g de mesófilos fue mayor en cama nueva (p<0.05). Los resultados de serología no mostraron seroconversión contra los virus en estudio. Se concluye que camas provenientes de crianzas sin historia de problemas infecciosos, y con un correcto manejo de las condiciones medio ambientales del galpón, podrían ser reutilizadas de una manera segura hasta por cinco o más campañas.
Palabras clave: cama, bronquitis infecciosa, Newcastle, Gumboro, anemia infecciosa, reovirus, mesófilos
ABSTRACT
The aim of this study was to evaluate the performance and sanitary status of broilers chickens raised in new and reused litters. For this purpose, 125 male broilers from the Ross 308 line were raised in a new and 125 in a litter that has been reused during 5 flocks. Growth data was weekly collected, as well as ammonia levels, oocysts count per gram of litter, and count of coliformis bacteria, fungi and mesofilic bacteria (CFU per gram of litter) in both groups. Level of antibodies against infectious bronchitis, Newcastle disease, infectious bursal disease, chicken anemia virus, and avian reoviruses were evaluated by ELISA test at the beginning and ending of the flock (day 49). No statistical difference was found between groups on growth rate, ammonia levels and oocysts count, however, the CFU count for mesofilic bacteria was higher in birds on new litter (p<0.05). The serology results did not show any seroconversion to the analyzed virus. Based on the results, it would be expected that litters coming from poultry farms without a history of infectious problems and with an adequate handling of environmental conditions in the farm could be safely reused for up to 5 flocks.
Key words: litter, infectious bronchitis, Newcastle disease, infectious bursal disease, chicken infectious anemia virus, reovirus, mesofilic bacteria
INTRODUCCIÓN
La búsqueda de alternativas para reducir los costos de producción, sin perjudicar el desempeño productivo ni el aspecto sanitario de la producción de pollos de carne, a fin de obtener mejores resultados económicos es una preocupación constante de la industria avícola (Clementino, 2000).
La calidad de la cama afecta la expresión del potencial genético de las aves, debido a su continuo y estrecho contacto (Tabler, 2000; Lacy, 2002). El manejo de la cama debería ser tan importante como la ventilación, la nutrición, el programa de luz, la calidad del agua y la eficiencia del programa sanitario; sin embargo, existe poca información publicada al respecto a pesar de las experiencias realizadas en campo (Bland y Ghazikhanian, 1998).
Por razones de costo, la práctica de reutilización de la cama durante varias campañas en la crianza de pollos de carne es cada vez más frecuente (Esmail, 2003). En el Perú, la viruta de madera es uno de los materiales de cama que más se utiliza, y dados los inconvenientes para su recambio entre campañas, tales como la disponibilidad, época, y costo, los avicultores han optado por cambiar la cama después de varias campañas.
La reutilización de la cama requiere de un buen manejo para ser exitosa. Uno de los problemas es el amoniaco proveniente de las deyecciones del ave que, en altas concentraciones y por periodos prolongados puede producir serios problemas (Sampaio et al., 1999; Lacy, 2002; Esmail, 2003). Por otro lado, la reutilización de la cama puede ser una fuente potencial de transmisión de patógenos como Gumboro, Reovirus, Adenovirus, y anemia infecciosa (Jones, 2003; Lukert y Saif, 2003; McFerran, 2003; Schat, 2003). Otras enfermedades que se diseminan fácilmente en camas contaminadas son la influenza aviar, laringotraqueitis, bronquitis infecciosa, dermatitis gangrenosa, botulismo y salmonelosis, además de hongos y parásitos (coccidias). Por lo tanto, muchos expertos en el área recomiendan la limpieza y remoción total de la cama después de cada campaña (Tabler, 2000; Lacy, 2002; McDougald, 2003; Paganini, 2004), toda vez que los efectos adversos de su reutilización se incrementan con un mayor nivel de uso (Shane, 1999; Esmail, 2003).
Debido a la controversia sobre los beneficios y desventajas de la reutilización de la cama en la crianza de pollos de carne, y la escasez de estudios sobre el efecto que ejerce la cama reutilizada sobre los parámetros productivos de las aves, el presente trabajo tuvo como objetivo evaluar el desempeño productivo y la calidad sanitaria de pollos de carne criados con dos tipos de cama: material de cama nuevo y material reutilizado por cinco campañas.
MATERIALES Y MÉTODOS
Lugar del Estudio y Animales
El experimento se realizó en los ambientes de la unidad de experimentación del Laboratorio de Patología Aviar de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima; entre los meses de julio y agosto del 2003.
Se crió 250 pollos de carne machos de la línea Ross 308, divididos en dos grupos: 125 en cama nueva y 125 en cama reutilizada de quinta campaña. Se administró alimento ad libitum elaborado con fórmulas convencionales para pollos de carne. Las aves fueron vacunadas contra la enfermedad de Newcastle con una cepa enterotrópica el 1er día de edad, vía spray en planta de incubación, y en el día 15 de edad por vía ocular.
Evaluación de la Cama
La cama nueva fue de viruta de madera y la reutilizada de viruta de madera utilizada previamente en cinco campañas. La cama reutilizada fue facilitada por una empresa avícola de una granja de pollos con historia sanitaria sin problemas infecciosos. La cama fue sometida a un tratamiento de fermentación previamente a su empleo en el presente estudio.
Se tomó pequeñas cantidades de cama de varios sitios del galpón en una bolsa plástica y se transportaron al laboratorio. Las muestras se procesaron de acuerdo a las técnicas de recuento de ooquistes utilizados en la evaluación internacional de anti coccidiales, recomendadas por Long y Rowell (1975). Asimismo se les realizó las siguientes pruebas microbiológicas:
- Contaje de coliformes, mesófilos y hongos (ITINTEC, 1990).
- Aislamiento de Salmonella sp. según el método descrito por Andrews y Hammack (2003) y Pietzsch (1985). El nivel superficial de amoniaco en las camas del galpón se midió tres veces al día y en forma diaria, a través de un detector electrónico en dos puntos diferentes del área de crianza de cada grupo.
Evaluación Productiva
En ambos grupos, se midió semanalmente el peso corporal, índice de conversión alimenticia (ICA), índice de eficiencia productiva europeo (IEPE), uniformidad, y mortalidad diaria y semanal.
Detección de Anticuerpos
Los títulos de anticuerpos se determinaron con un kit de ELISA comercial (IDEXX) al inicio y al final de la campaña, y se expresaron en promedio geométrico total (PGT) y coeficiente de variación (CV) para Newcastle (ENC), Bronquitis Infecciosa (BI), Gumboro, Anemia infecciosa (AI) y Reovirus (REO).
Análisis de Datos
El peso corporal y los niveles de anticuerpos se evaluaron estadísticamente con la prueba de t Student de independencia para determinar las diferencias entre grupos. El ICA, IEPE, uniformidad, recuento de ooquistes por gramo de cama, nivel de amoniaco, y el número de UFC/g de cama de coliformes, mesófilos y hongos se evaluaron con la prueba de Kolmogorov-Smirnov de dos muestras (K-S II). En ambas pruebas se utilizó el programa STATA.
RESULTADOS
Las aves criadas en cama nueva presentaron una mayor mortalidad, no significativa, que las criadas en cama reutilizada (4.0 vs. 3.2%), especialmente en las dos primeras semanas y al final de la campaña. Las causas de muertes fueron edema pulmonar, ascitis, onfalitis, asfixia y muerte súbita.
Las diferencia de peso entre las aves criadas en cama nueva versus cama reutilizada fue solamente de 48 g al final de la campaña (3.923 kg ± 0.07 vs. 3.875 kg ± 0.06 de peso final, respectivamente). También presentaron un mejor ICA (2.07 vs 2.09) y una ligera diferencia en el IEPE (367.21 vs 363.77). En ningún caso se encontró diferencia estadística entre los grupos. Por otro lado, el grupo criado sobre cama nueva presentó mejor porcentaje de uniformidad las primeras seis semanas, mientras que las aves de cama reutilizada mostraron mejor uniformidad (3.33%) al finalizar la campaña.
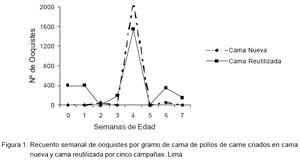
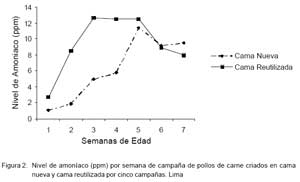
El contaje de ooquistes en la cama reutilizada mostró niveles más altos en la primera y tercera semana, así como en las dos últimas semanas, aunque sin diferencia estadística significativa (Fig. 1). Así mismo, el nivel de amoniaco en las primeras cinco semanas fue mayor en la cama reutilizada que en la cama nueva, pero igualmente sin diferencia estadística (Fig. 2).
La cama nueva presentó durante casi toda la campaña mayores recuentos de UFC de coliformes y hongos, aunque estas diferencias fueron únicamente significativas al término del estudio para el caso de las coliformes (p<0.05). El contaje de UFC de mesófilos fue similar y sin diferencia estadística entre grupos. Por otro lado, el aislamiento de Salmonella sp. en las muestras semanales de ambas camas resultó siempre negativo.
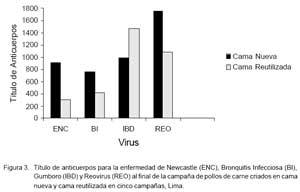
Los títulos de anticuerpos maternales al primer día de edad evidenciaron una buena protección de las aves para ENC, BI, Gumboro, Reovirus y AI. Así mismo, los niveles de anticuerpos para ENC, BI, Gumboro, REO y CAV al final del estudio evidenciaron que las aves no sufrieron desafíos de campo con ninguno de estos agentes. Se encontró diferencias estadísticas entre los títulos de anticuerpos para BI y REO en las aves que fueron criadas en la cama nueva y la reutilizada (p<0.05), mientras que no hubo diferencias para ENC y Gumboro.
DISCUSIÓN
Las causas de mortalidad fueron por desórdenes metabólicos, lo cual implicó que el porcentaje de mortalidad acumulada fuera similar entre ambos grupos. Así mismo, se encontró dentro de los rangos esperados para una crianza comercial de pollos.
El crecimiento de los pollos fue similar entre los grupos, donde las aves criadas sobre cama nueva presentaron una ligera ventaja en peso corporal, no significativa, sobre las aves criadas en cama reutilizada, debido probablemente al cuadro entérico que presentó el grupo de cama reutilizada durante la primera semana (Esmail, 2003). Este trastorno digestivo podría estar relacionado al comportamiento innato de las aves de consumir material de cama desde los primeros días de vida y asociado a la posible presencia de agentes patógenos o toxinas inespecíficas en dicho material. Sin embargo, en el presente estudio se observó que este grupo recuperó el peso debido a un efecto compensatorio, presentando mayor peso corporal que las aves criadas sobre cama nueva de la segunda a la cuarta semana de edad.
Los resultados del ICA, IEPE y uniformidad no mostraron diferencias significativas entre grupos aunque en términos generales, las aves en cama nueva presentaron los mejores valores, comportamiento que ha sido observado por otros autores (North, 1984; Esmail, 2003).
Las aves de los dos grupos no presentaron evidencia clínica de coccidiosis durante la crianza. La presencia de ooquistes en la cama desde el primer día de crianza puede estimular tempranamente el sistema inmune de las aves, desarrollando inmunidad competente contra coccideas durante las semanas de mayor susceptibilidad a la infección (3ra a 5ta semana de edad). Esto ha sido demostrado por Long y Joyner (1996) quienes demostraron que el uso de cama reutilizada confiere resistencia a desafíos con Eimeria tenella. Los resultados del conteo de ooquistes de cama indicaron que la cama reutilizada estuvo contaminada al inicio del experimento (400 ooquistes/g de cama), cantidad considerada como moderada (Caiña, 2000).
Existe controversia en relación al efecto de cama nueva o reutilizada en relación a las coccidias. Long (1981) observó un mayor desafío por coccidia como resultado de la reutilización de la cama. Reyna et al. (1983) encontraron que cantidades aproximadas de 25,000 ooquistes sin esporular por gramo de cama no afectan los parámetros productivos, si es que estos factores son correctamente manipulados para evitar la manifestación de coccidiosis. De otro lado, Villegas (1983) concluyó que el número de ooquistes en el contenido fecal no siempre debe ser interpretado como un factor para evaluar la severidad de la coccidiosis en la parvada.
Durante las cinco primeras semanas del experimento, la cama reutilizada presentó mayor nivel de amoniaco, aunque no existió diferencia estadística significativa en comparación con la cama nueva, habiendo niveles similares de amoniaco para los dos grupos durante las dos últimas semanas. La producción de amoniaco requiere de heces, humedad y calor (Noll, 1992), lo cual explica los mayores niveles de amoniaco emitidos por la cama reutilizada durante las primeras semanas. Prueba de esto fue la presencia de estornudos durante la primera semana en el 10% de aves criadas sobre cama reutilizada, debido al daño del aparato mucociliar del sistema respiratorio de las aves. La cama reutilizada tiene poca capacidad de absorción; además, los procesos de degradación se aceleran con el calor proveniente de la calefacción artificial proporcionado a las aves durante las primeras semanas de vida.
El bajo nivel de UFC de coliformes durante las primeras seis semanas en la cama reutilizada (p<0.05) puede explicarse por el proceso de fermentación producido con el tratamiento al que fue sometida la cama reutilizada antes de su empleo en el presente estudio. De igual forma, la cama nueva presentó un mayor número de UFC de hongos, no significativo, durante casi toda la crianza, por lo que se puede sugerir que camas reutilizadas y fermentadas presentan menor contaminación bacteriana y de hongos que una cama nueva, como también lo sugieren los estudios de Paganini (2004).
Los resultados serológicos al primer día de edad indican que las aves estuvieron protegidas pasivamente contra los virus de EN, BI, IBD, REO y CAV. Los resultados serológicos realizados a los 49 días de edad mostraron bajos títulos de anticuerpos contra ENC, BI, IBD y REO, así como ausencia de anticuerpos contra CAV, indicando que las aves no fueron expuestas a dichos agentes durante la etapa de crianza y que la cama reutilizada no transmitió ningún agente patógeno de las enfermedades de riesgo evaluadas en el presente estudio. Ha sido señalado que cuando los pollos de carne son expuestos a un desafío con virus patogénico durante su crianza, el promedio geométrico de los títulos de anticuerpos (PGT) al final de la campaña son elevados y el coeficiente de variación es estrecho.
Estudios previos que incluyen evaluaciones serológicas en aves no vacunadas y desafiadas mostraron elevados títulos en las aves al final de la campaña para BI y ENC (Silva, 1997; Jove, 2004), aunque también hay reportes que mostraron un bajo PGT para IBDV (Pérez, 2005). En el presente estudio, los títulos de anticuerpos contra IBD, aun cuando fueron considerados de bajo PGT, fueron mayores en las aves criadas sobre cama reutilizada. Esto puede sugerir que en este grupo hubo un desafio con este agente, pero de bajo nivel y probablemente por las mismas cepas vacunales.
CONCLUSIONES
-
El comportamiento productivo de las aves criadas sobre cama nueva y cama reutilizada fueron estadísticamente similares, aunque se notó una ligera ventaja en términos de peso corporal, y obtuvieron mejores parámetros productivos tales como índice de conversión alimenticia, índice de eficiencia productiva europeo, uniformidad para las aves criadas en cama nueva.
-
Los niveles de amoniaco fueron similares en los dos grupos, aunque ligeramente superiores en la cama reutilizada durante las primeras seis semanas de crianza.
LITERATURA CITADA
1. Andrews W, Hammack T. 2003. Bacteriological analytical manual. 8th ed. U.S. Department of Health and Human Services, U.S. Food & Drug Administration, Center for Food Safety & Applied Nutrition. Chapter 5: 1-20.
2. Bland M, Ghazikhanian Y. 1998. Litter management and poultry health. Nebraska Department of Veterinary and Biomedical Sciences Extension Newsletters, USA. 8 p.
3. Caiña P. 2000. Recuento de ooquistes de Eimeria sp. en cama nueva y su relación con la pigmentación en pollos de carne. Tesis de Médico Veterinario. Lima: Facultad de Medicina Veterinaria, Univ. Nacional Mayor de San Marcos. 46 p.
4. Clementino E. 2000. Avaliação de alguns materiais usados como cama sobre o desempenho de frangos de corte. Cienc Agrotec, Brasil 14: 1024-1030.
5. Esmail SHM. 2003. Ideas inspiradas para invertir en casetas de pollos de engorda. Industria avícola 50(5): 33-36.
6. [ITINTEC] Instituto de Investigación Tecnológica Industrial y de Normas Técnicas. 1990. Norma técnica nacional. Leche y productos lácteos. Ensayos microbiológicos. Lima: ITINTEC. 202.083. 90.09-26. p 1-24.
7. Jones R. 2003. Infectious bursal disease. In: Saif YM (eds). Disease of poultry. Iowa: Iowa State Press. p 293-298.
8. Jove AL. 2004. Evaluación de las cepas H120 y M48 en programas de vacunación contra bronquitis infecciosa aviar en pollos de carne. Tesis de Médico Veterinario. Lima: Facultad de Medicina Veterinaria, Univ. Nacional Mayor de San Marcos. 78 p.
9. Lacy M. 2002. Litter quality and broiler performance. USA: College of Agricultural & Environmental Sciences, University of Georgia. 4 p.
10. Long PL. 1981. Epidemiological studies on coccidiosis in chickens. In: International Congress of the World Veterinary Poultry Association. Proc Western Poultry Disease Conference. Oslo: WVPA. p 83.
11. Long PL, Joyner LP. 1996. Progress of coccidiosis research. In: Profiles of coccidiologists. 2nd ed. Faculty Healthcare Sciences, Kingston University and St Georges Hospital Medical School. [Internet] Disponible en: http://www.iah.bbsrc.ac.uk/Eimeria/new_new_page_4.htm
12. Long PL, Rowell JG. 1975. Sampling broiler house litter for coccidial oocysts. Brit Poultry Sci 16: 583-592.
13. Lukert D, Saif YM. 2003. Infectious bursal disease. In: Saif YM (eds). Disease of poultry. Iowa: Iowa State Press. p 161-179.
14. McDougald L. 2003. Protozoal Infections. In: Saif YM, Barnes HJ, Glisson JR, Fadly AM, McDougald LR, Swayne DE (eds). Disease of Poultry. 11th ed. Ames: Iowa State University Press. p 973-990.
15. McFerran JB. 2003. Adenovirus Infections. In: Saif YM (eds). Disease of poultry. Iowa: Iowa State Press. p 213-227.
16. Noll S. 1992. Interacciones entre el manejo de la cama y la salud de la parvada. Avicultura Profesional 10(1): 42-43.
17. North MO. 1984. Broiler, roster, and capon management. In: Commercial chicken production manual. 3rd ed. Westport, Connecticut: Avi Publishing Company. p 357-397.
18. Paganini F. 2004. Manejo de cama. En: Produção de Frangos de Corte. Brasil: Facta. p 108-115.
19. Pérez CM. 2005. Evaluación de 2 programas de vacunación que contiene la cepa 2512 de la enfermedad de Gumboro frente a la infección experimental con la cepa F52170. Tesis de Médico Veterinario. Lima: Facultad de Medicina Veterinaria, Univ. Nacional Mayor de San Marcos. 66 p.
20. Pietzsch O. 1985. Methods of the detection of Salmonella - standardization and harmonization of the procedure. In: Proc International Symposium on Salmonella. New Orleans, USA. p 7-15.
21. Reyna PS, McDougald LR, Mathis GF. 1983. Survival of coccidian in poultry litter and reservoirs of infection. Avian Dis 27: 464-473.
22. Sampaio MA, Schocken-Iturrino RP, Sampaio AM, Berchielli SC, Biondi A. 1999. Estudo da população de amonia da cama de frangos tratada com gesso agrícola. Arq Bras Med Vet Zootec 51: 559-564.
23. Schat K. 2003. Chicken infectious anemia. In: Saif YM (eds). Disease of poultry. Iowa: Iowa State Press. p 182-198.
24. Shane S. 1999. En los EUA se prefiere el acondicionamiento de la cama. Industria Avícola 46(4): 24-25.
25. Silva BAM. 1997. Inmuno-protección por vacuna oleosa y/o viva frente a una infección experimental de la enfermedad de Newcastle en pollos de carne. Tesis de Médico Veterinario. Lima: Facultad de Medicina Veterinaria, Univ. Nacional Mayor de San Marcos. 84 p.
26. Tabler T. 2000. Importance of litter quality to broiler producers. Avian Advice 2(2): 3-5.
27. Villegas P. 1983. Coccidiosis. En: Memorias del V Seminario Internacional de Patología Aviar. Athens, Georgia. p 114-121.