Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.20 n.2 Lima 2009
Inmovilización química, evaluación hematológica y coproparasitología de Leopardus colocolo en Khastor, Potosí, Bolivia
Chemical Immobilization and hematologyc and Endoparasitologic Evaluation of Leopardus colocolo in Khastor, Potosí, Bolivia
L. Fabián Beltrán S.1,2 ; Rodolfo Nallar G.1 ; Ma. Lilian Villalba M.3 ; Eliseo Delgado E.4 ; Mauricio Berna M.4
1 Wildlife Conservation Society, Programa de Conservación del Gran Paisaje Madidi, Field Veterinary Program. Casilla 3-35181, La Paz, Bolivia.
2 E-mail: fabeltrans@yahoo.com
3 Alianza Gato Andino, Colección Boliviana de Fauna, La Paz, Bolivia.
4 Reserva Nacional de Fauna Andina Eduardo Avaroa, Potosí, Bolivia.
RESUMEN
En mayo de 2005 y abril de 2006, en la región de Khastor, Potosí, Bolivia, se realizó la captura y recaptura de un ejemplar hembra de gato de las pampas (Leopardus colocolo) a quien se le colocó un radiocollar. Se probó la eficacia de un protocolo de inmovilización química para maniobras, evaluación clínica y colecta de muestras biológicas para estudios de laboratorio. Se utilizó una combinación de clorhidrato de ketamina (KH) + clorhidrato de medetomidina (MH), y este último se antagonizó con atipamezole (AH). En el 2005 se empleó 4.38 mg/kg de KH + 0.04 mg/kg de MH, requiriendo 2 dosis sucesivas de 1.75 mg/kg de KH. En el 2006 se empleó 5.0 mg/kg de KH + 0.05 mg/kg de MH. El MH se antagonizó con 0.22 y 0.25 mg/kg de AH en el 2005 y 2006, respectivamente. El tiempo de inducción e inmovilización química en ambas campañas fue similar pero el tiempo de recuperación anestésica en 2006 fue menor que en 2005. La evaluación clínica indicó aparente buen estado de salud y físico. Los hemogramas presentaron valores dentro de los rangos normales para felinos domésticos. Se halló huevos de Toxascaris leonina y Uncynaria sp.
Palabras clave: Leopardus colocolo, anestesia e inmovilización, hematología, coproparasitología, Bolivia
.
ABSTRACT
In May 2005 and April 2006, in the region of Khastor, Potosi, Bolivia, a female pampas cat (Leopardus colocolo) was captured. The efficacy of a protocol for chemical immobilization for animal handling, clinical evaluation and collection of biological samples was evaluated. It was used ketamine hydrochloride (KH) + medetomidine hydrochloride (MH), and antagonized the latter with atipamezole (AH). In 2005 were administered 4.38 mg/kg of KH + 0.04 mg/kg of MH, requiring 2 successive doses of 1.76 mg/kg of KH. In 2006 were administered 5.0 mg/kg of KH + 0.05 mg/kg of MH. MH was antagonized with 0.22 and 0.25 mg/kg of AH in 2005 and 2006 respectively. The induction time and chemical immobilization in both campaigns were very similar but the recovery time from anesthesia in 2006 was shorter than in 2005. The clinical evaluation indicated adequate health and physical status. The hemograms showed values within the normal range for domestic felines. Eggs of Toxascaris leonina and Uncynaria sp. were found.
Key words: Leopardus colocolo, anesthesia and immobilization, hematology, coproparasitology, Bolivia.
INTRODUCCIÓN
El gato de las pampas o de pajonal Leopardus colocolo (Molina 1782), es un felino silvestre pequeño de amplia distribución geográfica, encontrándose en Ecuador, Perú, Bolivia, Chile, Argentina y la región sur-este de Brasil, Paraguay y Uruguay, desde los 00º 30º S hasta los 51º S (Garcia-Perea, 1994). Ocupa una variedad de hábitats, como pastizales de altura, praderas cálidas de altitud moderada, bosques secos y húmedos, y sabanas de tierras bajas. Se caracteriza por la presencia de dos o tres bandas oscuras en las patas anteriores pero la coloración del manto varía según su hábitat (Garcia-Perea, 1994; Nowell y Jackson, 1996; Sanchez-Soto, 2007). En la región altiplánica y alto andina tiene una coloración rojiza o amarillenta, con manchas más oscuras dispuestas a ambos lados de su cuerpo, aparentando líneas oblicuas u horizontales y presenta en la espalda pelos largos oscuros a manera de crin. Por su apariencia, es frecuentemente confundido con el gato andino (Leopardus jacobita Cornalia 1865) en aquellas zonas donde ambas especies son simpátricas.
A pesar de su amplia distribución, el gato de las pampas es uno de los felinos menos conocidos del continente. Su estado de conservación es de "Casi amenazada" según la Unión Internacional para la Conservación de la Naturaleza (www.iucnredlist.org);
sin embargo, poblaciones de algunas zonas parecen estar seriamente amenazadas (Cossíos et al., 2007). Se encuentra en el apéndice II de CITES (http://www.cites.org).No se dispone de información específica sobre protocolos de inmovilización química, valores hematológicos y estudios copro-parasitológicos en esta especie felina. Existen estudios donde se realizaron capturas con trampas jaula y anestesia en otras especies de pequeños felinos silvestres de América. Para la inmovilización química de kodkod Leopardus guigna (Molina 1782), ocelotes Leopardus pardalis (Linnaeus 1758 ) y linces Linx rufus (Schreber 1777), se han usado combinaciones de clorhidrato de ketamina (KH) y clorhidrato de xilacina (XH) en Chile y USA (Acosta-Jamett et al., datos no publicados; Beltrán y Tewes, 1995); clorhidrato de tiletamina (TH) y clorhidrato de zolazepam (ZH) en ocelotes de Texas (Shindle y Tewes, 2000); KH y medetomidina (MH) revirtiendo esta última con el antagonista específico Atipamezole (AH) en gatos monteses (Leopardus geoffroyi dOrbigny & Gervais 1844) y ocelotes de Argentina y Bolivia (Fiorello et al., 2004a; Uhart et al., 2005; R. Nallar, Bolivia, datos no publicados).
Investigaciones recientes sobre sanidad y epidemiología de endoparásitos gastrointes-tinales en felinos silvestres de vida libre y en cautiverio fueron reportados en base a huevos de helmintos y ooquistes de coccidias (Figueiroa et al., 2001; Fiorello et al., 2004b; Beldomenico et al., 2005; Tantaleán y Michaud, 2005) y necropsias para taxonomía de helmintos (Pence et al., 2003; Beldo-menico et al., 2005; Foster et al., 2006).
El objetivo de este trabajo fue probar por vez primera, la eficacia de un protocolo de inmovilización química para maniobras y obtención de muestras biológicas aprovechando la captura y recaptura de un ejemplar de gato de las pampas (Leopardus colocolo) para el colocado y posterior retiro de un radio collar en la región de Khastor (sur de Potosí, Bolivia). Asimismo, se reporta los resultados hematológicos y parasitológicos obtenidos en este animal.
MATERIALES Y MÉTODOS
Área de Captura y Recaptura
El área de investigación se localiza en la región de Khastor, al sur del departamento de Potosí. El 9 de mayo de 2005 se realizó la captura de un ejemplar de gato de las pampas Leopardus colocolo (19K 0698551 – UTM 7533998; altitud: 4,722 m) y el 26 de abril de 2006 se realizó la recaptura del ejemplar con radio collar (19K 0700644 – UTM 7534140; altitud: 4,810 m) (Fig. 1).

Metodología de Captura y Recaptura
En las semanas previas se hizo un rastreo de señales como huellas, letrinas, cuevas utilizadas en roquedales, además del uso de cámaras trampas, para establecer su presencia en la zona. En la segunda campaña se empleó, además, radio seguimiento. Luego, se instaló trampas jaula plegables de 42 x 15 x 20" (# 209.5) (Tomahawk Live Trap Co., USA) cebadas cada 1-2 días con carnada muerta, sin activarlas durante el pre-trampeo. Cuando el equipo veterinario ingresó a la zona, las trampas jaula fueron activadas con revisiones cada 12 horas. En la campaña de 2005, el animal cayó al día siguiente, mientras que en la campaña de 2006 cayó dos días después. En ambas ocasiones, las trampas se cubrieron con una tela para tranquilizar al animal y evitar auto-laceraciones (Uhart et al., 2005).
La evaluación médica antes de la inducción anestésica consistió en evaluar tiempo de ayuno (<8, 8-24, 24-48, >48 h) considerando el tiempo aproximado que permaneció la gata dentro la trampa jaula; actividad (calmo, activo, excitado) y actitud (deprimida, alerta, agresiva, miedo) (registro MedArks: ISIS, 12101 Johnny Cake Rd., Apple Valley, MN 55124, USA).
Inmovilización Manual y Química
La gata fue inmovilizada físicamente dentro de la trampa jaula con tubos PVC formando paredes falsas y luego con una tabla de madera y mango central a modo de pared hasta tenerla contra la parte posterior de la trampa jaula.
La inmovilización química se realizó con una combinación de anestesia disociativa KH (Ketaset®, 100 mg/ml) y el sedante-relajante muscular MH (Domitor®, 20 mg/ml) (Fiorello et al., 2004a). El peso corporal se estimó en 4 kg. En el periodo de inducción anestésica, se aplicó pomada oftálmica (Puralube®) como lubricante ocular y se cubrió los ojos con tela. Además, se le aplicó oxitetraciclina (10 mg/kg por vía IM) para prevenir infecciones por depresión inmunológica por estrés de captura. Al finalizar, se administró el antagonista alfa 2 adrenérgico AH (Antisedan®, 5 mg/ml) (Fiorello et al., 2004a).
Revisión Clínica y Toma de Muestras
Se realizó una evaluación clínica, y se determinó la temperatura corporal, frecuencias cardiaca y respiratoria, estado físico, condición corporal (registro MedArks: ISIS, 12101 Johnny Cake Rd., Apple Valley, MN 55124, USA) (Günther et al., 1979; Marull y Uhart, 2003).
En la campaña de 2005 se obtuvo una muestra fecal fresca recogida de la jaula que fue conservada en formol al 10%, así como sangre por venipunción yugular en tubo con anticoagulante EDTA. En la campaña de 2006 se obtuvo una muestra de sangre por punción de la vena safena (Ueno y Gutierrez, 1983; Marull y Uhart, 2003).
Hematología y Análisis Coprológico
Se prepararon frotices sanguíneos y se fijaron con metanol 100% durante 5 minutos para su posterior tinción con Wright–Giemsa (Dip Quick Stain®) y recuento diferencial (Marull y Uhart, 2003; Fiorello et al., 2004a). El hematocrito se determinó a través de la técnica de microhematocrito. El recuento general de eritrocitos y leucocitos se realizó con el sistema Unopette (Unopette®) con hemocitómetro Neubauer. Las proteínas totales se determinaron con un refractómetro expresando el resultado en g/dl (Marull y Uhart, 2003; Fiorello et al., 2004). En la interpretación de los valores hemáticos y la morfología eritrocitaria y leucocitaria, se utilizaron los criterios descritos por Kraft y Schillinger (1998) y Rebar et al. (2005). El análisis de laboratorio se realizó en campo y posteriormente en la ciudad de La Paz, Bolivia.
Para el análisis coproparasitológico se utilizó el método de flotación de Willis con solución sobresaturada de cloruro de sodio y el de sedimentación modificada de Niah (Ueno y Gutierrez, 1983), en el Laboratorio de Investigación y Diagnóstico Veterinario (LIDIVET) en la ciudad de Santa Cruz de la Sierra, Bolivia.
RESULTADOS Y DISCUSIÓN
El examen clínico en ambas capturas mostró un buen estado general de salud y físico, sin estar en periodo de celo o preñez y con las glándulas mamarias involucionadas. En la primera campaña (2005), las constantes fisiológicas se mantuvieron estables al monitoreo (Frecuencia cardiaca: 70-60/min; Frecuencia respiratoria: 40-60/min) mientras que en la segunda campaña (2006) se observó inicialmente un incremento de la frecuencia cardiaca (124/min) y respiratoria (57/min) probablemente por el estrés de captura; pero a medida que la inducción química producía el efecto esperado los valores se fueron estabilizando.
La inducción completa desde la aplicación de la combinación KH + MH en las campañas de 2005 y 2006 fueron de 9 y 12 minutos, respectivamente. En la primera campaña se empleó una menor dosis de KH combinada con MH, de modo que se requirió dos dosis adicionales de KH para lograr una inducción completa (Cuadro 1). En la segunda campaña se aplicó una dosis mayor de KH y MH de modo que no requirió dosis de refuerzo (Cuadro 2). Esta combinación anestésica ha sido utilizada con éxito en Argentina para gatos monteses con dosis de 5.78 mg/kg de KH y 0.95 mg/kg de MH (Uhart et al., 2005); en Bolivia para ocelotes y gatos monteses con dosis de 5.8 y 5.3 mg/kg de KH, y 0.06 y 0.08 mg/kg de MH, respectivamente (Fiorello et al., 2004a) y para ocelotes con dosis de 4.5 mg/kg de KH y 0.045 mg/kg de MH (Nallar, datos no publicados).
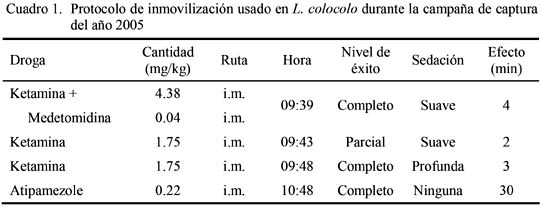

El tiempo de anestesia hasta la aplicación del antagonista AH fue de 01:05 a 01:09 horas en los dos casos y el tiempo de recuperación desde la aplicación del antagonista AH para anular el efecto de MH fue de 30 y 23 minutos en la campaña de 2005 y 2006, respectivamente. Esto demuestra que la mayor pero única dosis de KH y MH usada durante la recaptura permitió una recuperación más rápida. Uhart et al. (2005) obtuvieron la recuperación de la anestesia en gatos monteses con AH en dosis de 0.5 mg/kg a los 30 min, mientras que Nallar (datos no publicados) observó la recuperación de ocelotes a los 10.4 min, considerando que este último requirió menor cantidad de KH y MH. Por otro lado, en Bolivia, Fiorello et al. (2004a) utilizaron dosis promedio de 0.30 mg/kg y 0.38 mg/kg para ocelotes y gatos monteses, respectivamente. En ambas campañas, el animal fue liberado de la trampa sin inconvenientes encontrando la salida por cuenta propia.
Los valores de hematocrito, recuento de eritrocitos y leucocitos (total y diferencial) (Cuadro 3) estaban dentro los rangos normales para felinos domésticos (Kraft y Schillinger, 1998). Asimismo, el hematocrito fue similar al de gatos monteses en Bolivia (Fiorello et al., 2004a) y en Argentina (Uhart et al., 2005), mientras que fueron superiores al de ocelotes y yaguarundí (Puma yaguarundi Lacépedè 1809) (Fiorello et al., 2004a). Asimismo, los valores de proteínas totales (Cuadro 3) estaban dentro los rangos normales para felinos domésticos (Kraft y Schillinger, 1998), mientras que inferiores en relación a ocelotes, gatos monteses y un yaguarundí registrados por Fiorello et al. (2004a) y gatos monteses registrados por Uhart et al. (2005).
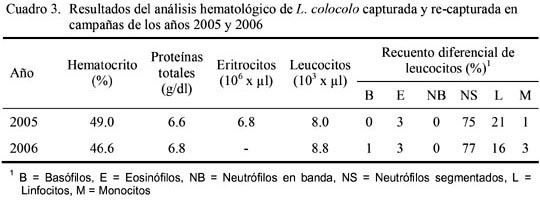
El recuento de eritrocitos fue inferior en relación a un yaguarundí y gatos monteses registrados por Fiorello et al. (2004a) y Uhart et al. (2005), respectivamente. En ambos años se observó acantocis leve, debido al manipuleo de la muestra y por tanto no tiene significación patológica (Kraft y Schillinger, 1998; Rebar et al., 2005). Asimismo, el recuento fue inferior en relación a ocelotes, gatos monteses y un yaguarundí registrados por Fiorello et al. (2004a) y superiores a los registrados por Uhart et al. (2005) en gatos monteses. El conjunto de resultados hematológicos encontrados en ambas campañas puede ser considerado normal al encontrarse en aparente buen estado general de salud y físico.
En el análisis parasitológico se identificaron dos géneros de la clase Nematoda. El primero fue Toxascaris leonina (v. Linstow 1902) (tamaño del huevo: 83.3 x 75.0 µm) hallado en poca cantidad. Este es un nemátodo propio de felinos y caninos silvestres con distribución cosmopolita y de ciclo evolutivo directo, localizándose en el lumen del intestino delgado de estos carnívoros. El segundo fue un huevo de la Superfamilia Ancylostomatoidea (Chabaud 1965), Uncynaria sp. (Tamaño del huevo: 83.3 x 43.3 µm), que es un endoparásito de caninos y felinos silvestres y domésticos con distribución mundial y de ciclo evolutivo directo, que se localiza en el lumen del intestino delgado, donde los adultos son hematófagos (Soulsby, 1987; Masi et al., 1990; Figueiroa et al., 2001) (Fig. 2).
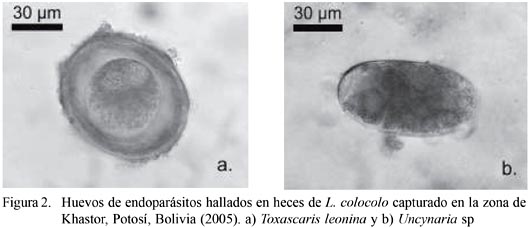
Se ha documentado que la capacidad migratoria y abandono de madrigueras de las especies silvestres puede estar estrechamente relacionada a los altos índices parasitarios como estrategia evasiva a los mismos (Suzan-Azpiri et al., 2000). Considerando que los escasos hallazgos de formas parasitarias podrían deberse a este comportamiento natural y al encontrarse esta ejemplar clínicamente en aparente buen estado general de salud y físico, se considera que posiblemente presentó parasitismo o simbiosis co-evolutiva con los endoparásitos registrados.
AGRADECIMIENTOS
Colección Boliviana de Fauna, Reserva Nacional de Fauna Andina "Eduardo Avaroa", Alianza Gato Andino, Wildlife Conservation Network (USA), Wildlife Conservation Research Unit (UK), Field Veterinary Program de la Wildlife Conservation Society y Gordon and Betty Moore Foundation. El Servicio Nacional de Áreas Protegidas y la Dirección General de Biodiversidad y Medio Ambiente otorgaron los permisos y autorizaciones de capturas.
CONCLUSIONES
-
Esta es la primera captura realizada para L. colocolo en Bolivia.
-
El método de rastreo, armado y captura con trampas jaula resultaron exitosos para L. colocolo.
-
El protocolo de inmovilización con las modificaciones efectuadas en la re-captura logró el plano anestésico deseado.
LITERATURA CITADA
1. Beldomenico PM, Kinsella JM, Uhart MM, Gutierrez GL, Pereira J, Ferreyra H, Marull C. 2005.
Helminths of geoffroys cat, Oncifelis geoffroyi (Carnivora, felidae) from the monte desert, central Argentina. Acta Parasitol 50(3): 263-266.2. Beltrán JF, Tewes ME. 1995. Immobilization of ocelots and bob cats with ketamine hidrocloride and xilazine hidrocloride. J Wildlife Dis 31(1): 43-48.
3. Cossíos ED, Madrid A, Condori JL, Fajardo U. 2007.
Update on the distribution of the Andean cat Oreailurus jacobita and the pampas cat Lynchailurus colocolo in Peru. Endangered Species Res 3: 313-320.4. Figueiroa M, de Oliveira JB, de Brito Cavalcanti MD, de Oliveira RA, Sobrinho AE. 2001. Perfil copro-parasitológico de mamíferos silvestres en cautiverio en el Estado de Pernambuco, Brasil. Parasitol Día 25: 3-4.
5. Fiorello CV, Deem SL, Noss AJ, Maffei L, Poppenga RH, Dubovi EJ, Dierenfeld ES. 2004a.
Health evaluation of small canids and felids in a tropical dry forest of Bolivia: Hematology, serum biochemistry, vitamins, minerals and toxicology. In: Fiorello CV. Disease ecology of wild and domestic carnivores in Bolivia. Doctoral Thesis. USA: Columbia University. 79-113 p.6. Fiorello CV, Wade SE, Maffei L, Robbins RG. 2004b.
Parasite fauna of free-ranging small canids and felids in the bolivian Chaco. In: Fiorello CV. Disease ecology of wild and domestic carnivores in Bolivia. Doctoral Thesis. USA: Columbia University. 134-150 p.7. Foster GW, Cunningham MW, Kinsella JM, McLaughlin G, Forrester DJ. 2006. Gastrointestinal helminths of free-ranging Florida panthers (Puma concolor coryi) and the efficacy of the current anthelmintic treatment protocol. J Wildlife Dis 42(2): 402-406.
8. Garcia-Perea R. 1994. The Pampas Cat Group (Genus Lynchailurus Severtzov, 1858) (Carnivora: Felidae), a systematic and biogeographic review. American Museum Novitates. Nº 3096. 35 p.
9. Günther M, Fahr P, Lachmann G, Wujanz G, Schulz J, Furll M. 1979.
Diagnóstico clínico veterinario (Con atención especial a la anestesiología). España: Acribia. 256 p.10. Kraft H, Schillinger D. 1998. Métodos de laboratorio clínico en medicina veterinaria de mamíferos domésticos. España: Acribia. 295 p.
11. Marull C, Uhart M. 2003. Manual: colección y manejo de muestras para diagnóstico (mamíferos, aves, reptiles y anfibios). Curso taller sobre medicina veterinaria de vida silvestre y su papel en la conservación de la biodiversidad.
Wildlife Conservation Society – The New York Community Trust. Santa Cruz, Bolivia.12. Masi R, Enriquéz J, Rebollo C, Maciel S, Rodríguez A, Jiménez T. 1990 Nematodes de los vertebrados del Paraguay y otros parásitos del Nuevo Mundo. Paraguay: EFACIM. Universidad Nacional de Asunción. 689 p.
13. Nowell K, Jackson P. 1996.
Status survey and conservation action plan. Wild Cats. IUCN/SSC Cat Specialist Group. 382 p.14. Pence DB, Tewes ME, Laack LL. 2003. Helminths of the ocelot from southern Texas. J Wildlife Dis 39(3): 683-689.
15. Rebar AH, McWilliams PS, Feldman BF, Metzger FL, Pollock RV, Roche J. 2005. A guide to hematology in dogs and cats. International Veterinary Information Service, Ithaca NY [Internet].
Available in: http://www.ivis.org16. Sanchez-Soto S. 2007. Nuevo registro de Oncifelis colocolo (Felidae) para el Pantanal de Brasil.
Nota científica. Rev Mex Biodiver 78: 211-212.17. Shindle DB, Tewes ME. 2000. Immobilization of wild ocelots with tiletamine and zolazepam in southern Texas.
J Wildlife Dis 36 (3): 546-550.18. Soulsby EJ. 1987. Parasitología y enfermedades parasitarias de los animales domésticos. México: Interamericana. 823 p.
19. Suzan-Azpiri G, Galindo F, Ceballos G. 2000. La importancia del estudio de enfermedades en la conservación de fauna silvestre. Vet Mex 31(3): 223-230.
20. Tantaleán M, Michaud C. 2005. Huéspedes definitivos de Spirometra mansonoides (Cestoda, Diphyllobot-hriidae) en el Perú. Rev Per Biol 12(1): 153-157.
21. Ueno H, Gutierrez VC. 1983. Manual para diagnóstico das helmintoses de rumiantes. Brasil: Facultade de Medicina Veterinaria, Universidade Federal do Rio Grande do Sul Porto Alegre. JICA. 176 p.
22. Uhart M, Pereira J, Ferreyra H, Marull C, Beldoménico P, Fracassi N, Aprile G, Mcaloose D. 2005.
Health assessment of Geoffroyis cats (Oncifelis geoffroyi) in Argentina. In: Wildlife Dis Assoc, International Conference. Cairns, Queensland, Australia. 135 p.













