Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.21 no.1 Lima 2010
ARTÍCULOS PRIMARIOS
Refrigeración de semen canino utilizando glucosa, fructosa, trehalosa o sacarosa para prolongar la supervivencia espermática
Refrigeration of canine semen using glucose, fructose, trehalose or sucrose to extend sperm survival
Jonathan Flores A.1, Víctor Fernández A.2, Héctor Huamán U.3, Luis Ruiz G.1, Alexei Santiani A.1,4
1 Laboratorio de Reproducción Animal,
2 Clínica de Animales Menores,
3 Laboratorio de Bioquímica, Nutrición y Alimentación Animal, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
4 E-mail: asantiani@hotmail.com
RESUMEN
Se evaluó el efecto la glucosa, fructosa, trehalosa y sacarosa, como componentes del diluyente, sobre la viabilidad espermática en semen canino refrigerado a 5 °C. La fracción espermática de 16 eyaculados de perro fue distribuida en cinco alícuotas conteniendo un diluyente a base de Tris - ácido cítrico - yema de huevo, pero con un azúcar distinto, además del control sin azúcar. Los cinco tratamientos se evaluaron a las 24, 48, 72 y 96 horas de refrigeración en base a motilidad progresiva e integridad funcional de membrana mediante la prueba hipoosmótica (HOS). En todos los grupos, a excepción del grupo control, la motilidad espermática se mantuvo dentro de rangos aceptables durante el estudio (90% en el día 0 hasta cerca de 60% en el día 4). Sin embargo, la integridad de membrana se mantuvo ligeramente superior en los grupos con azúcar (87-90%) en comparación con el grupo control (83-85%). La glucosa y sacarosa mostraron mejores resultados de motilidad y HOS. Se concluye que no se genera un daño significativo sobre la membrana espermática durante la refrigeración a 5 °C del semen canino, y que la utilización de cualquiera de los azúcares como sustrato energético para los espermatozoides, en especial glucosa y sacarosa, es de gran importancia para el mantenimiento de niveles apropiados de motilidad espermática e integridad funcional de membrana.
Palabras clave: semen refrigerado, canino, glucosa, fructosa, trehalosa, sacarosa, monosacáridos, disacáridos
ABSTRACT
The effect of glucose, fructose, trehalose, and sucrose, as components of the extender, was evaluated on canine sperm viability during refrigeration at 5 °C. The spermatic fraction of 16 dog ejaculations were distributed in 5 aliquots containing an extender based on Tris – citric acid – egg yolk, but differing in the presence of one of the sugars, plus a control without sugar. The five treatments were evaluated after 24, 48, 72, and 96 hours of refrigeration in relation to progressive motility and functional integrity of the membrane by the hypoosmotic swelling test (HOS). All groups, with the exception of the control group, the sperm motility maintained within acceptable ranges during the study (90% on day 0 and 60% on day 4). The integrity of the membrane remained slightly superior in groups with sugar (87-90%) in comparison with the control group (83-85%). The glucose and sucrose showed the best results in motility and HOS. It is concluded that no significant damage occurred on the sperm membrane while keeping semen at 5 °C, and that the use of any of the tested sugars as energy-giving substrate for the sperm cells (especially glucose and sucrose) is of great importance for the maintenance of appropriate levels of sperm motility and functional integrity of the membrane.
Key words: refrigerated semen, canine, glucose, fructose, trehalose, sucrose, monosaccharide, disaccharide
INTRODUCCIÓN
El interés creciente por la práctica de la inseminación artificial en la reproducción de los caninos demanda la búsqueda de protocolos de preservación de semen que permitan un mayor tiempo de viabilidad espermática. Esto permite el transporte de semen hacia lugares geográficamente distantes, así como reducir el número de colecciones de semen en un macho de alto valor genético.
Se han desarrollado diversos protocolos para la criopreservación de semen canino (Farstad, 2000; Stornelli et al., 2001; Romagnoli, 2002; Hori et al., 2003); no obstante, se obtienen tasas de fertilidad muy inferiores a las obtenidas con semen diluido y conservado bajo condiciones de refrigeración (Linde-Forsberg, 1991; Pinto et al., 1999). Adicionalmente, se tiene una tendencia a producir un efecto negativo en el tamaño de la camada (Michelsen et al., 1993; Pinto et al., 1999); de allí que en la práctica de la inseminación artificial en caninos se sigue optando por el empleo de semen fresco, directamente o luego de ser conservado en refrigeración.
Ha sido ampliamente demostrado que la composición de los diluyentes utilizados en los procesos de conservación de semen canino puede afectar el tiempo de almacenamiento y la calidad de los espermatozoides (Sirivaidyapong et al., 2000). En tal sentido, Yildiz et al. (2000) sugieren que los azúcares, además de servir como fuente de energía para la célula espermática, permiten el mantenimiento de la presión osmótica y cumplen una acción crioprotectora. En base a esto, es de esperar que la inclusión de azúcares en los dilutores podría servir para la preservación de la motilidad espermática y el mantenimiento de la viabilidad e integridad del acrosoma y de la membrana espermática (Yildiz et al.; 2000; Rigau et al., 2001). El objetivo del estudio fue evaluar el efecto de la adición de glucosa, fructosa, trehalosa y sacarosa como parte de la composición del dilutor de semen en el proceso de conservación en refrigeración del semen canino.
MATERIALES Y MÉTODOS
Lugar de Estudio y Animales
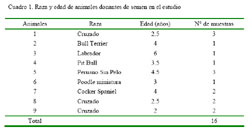
El estudio se llevó a cabo en el Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima. Se emplearon nueve caninos machos adultos, de dos a seis años de edad, a quienes se colectó 16 muestras de semen (Cuadro 1), con un intervalo de, al menos, una semana entre colecciones consecutivas.
Colección de Semen
Se empleó el método de manipulación digital, consistente en aplicar masajes suaves y de manera alternada sobre el cuerpo del pene del animal ejerciendo una ligera presión sobre el bulbo del pene cada tres segundos, hasta lograr una erección parcial; luego se retrae el prepucio y se sujeta el bulbo con la mano enguantada, ejerciendo una constante presión sobre el mismo, para lograr una total turgencia y marcado movimiento o reflejo pélvico; y cuando el perro levanta alguna de sus extremidades posteriores, se dirige el pene hacia atrás (rotación de 180 grados) para colectar el eyaculado.
Para la recolección del semen se utilizó un tubo falcón graduado, estéril y temperado, obviando la primera fracción de eyaculado (dos o tres gotas). Solo se utilizaron los eyaculados con al menos 70% de motilidad espermática, una concentración de 100×106 espermatozoides/ ml, y un mínimo de 90% de reactantes positivos al HOS. La concentración espermática se estandarizó a un promedio de 100 millones de espermatozoides por mililitro, para minimizar variabilidad entre muestras.
Tratamientos y Diseño Experimental
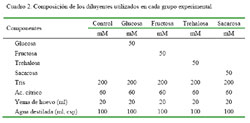
Cada una de las muestras se distribuyó en cinco grupos experimentales (Cuadro 2):
a) Grupo Control: 0.5 ml semen + 0.5 ml del diluyente control
b) Grupo Glucosa: 0.5 ml semen + 0.5 ml del diluyente con glucosa
c) Grupo Fructosa: 0.5 ml semen + 0.5 ml del diluyente con fructosa
d) Grupo Trehalosa: 0.5 ml semen + 0.5 ml del diluyente con trehalosa
e) Grupo Sacarosa: 0.5 ml semen + 0.5 ml del diluyente con sacarosa
Se utilizó un diseño de tratamientos simultáneos en una misma unidad experimental (eyaculado). En cada una de las 16 muestras se empleó el set de cinco dilutores. Cada submuestra con el dilutor correspondiente se llevó inmediatamente a refrigeración (5 °C). Cada 24 horas (24, 48, 72 y 96 horas), previa homogenización, se tomó 100 μl del semen diluido y se colocó en la estufa a 37 °C durante 5 minutos para su evaluación. Se determinó el porcentaje de motilidad progresiva y porcentaje de espermatozoides con membrana plasmática funcionalmente íntegra (HOS+).
Parámetros Evaluados
Motilidad progresiva
Se depositó 25 μl de cada muestra de semen en una lámina portaobjeto, se colocó la lámina cubreobjeto, ambas temperadas a 37 °C, y se observó al microscopio a 40x. Se calculó de manera subjetiva el porcentaje de espermatozoides que presentaron un movimiento continuo hacia adelante.
Integridad funcional de membrana
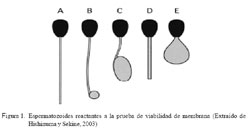
Se empleó la prueba hipoosmótica (HOS: hypoosmotic swelling test) descrita para espermatozoides caninos (Sánchez et al., 2002), en la cual se mide la capacidad que presenta la membrana de las células espermáticas de permitir el flujo de iones y de agua al interior de la célula (Hishinuma y Sekine, 2003). Se determinó el porcentaje de espermatozoides con la membrana plasmática dañada (no presentaron modificaciones en la cola, Fig. 1-A) y el porcentaje de espermatozoides con membrana plasmática funcionalmente íntegra (aquellos que, como respuesta al estrés hipoosmótico, presentaron algún tipo de hinchazón en la cola, sea esta en lugar distal o en alguna parte de la misma) (Fig. 1).
Análisis estadístico
Los resultados porcentuales de motilidad y HOS (+) se transformaron a valores angulares para acercar los datos a la distribución normal.
Se empleó un análisis de medidas repetidas, teniendo como variables explicativas a los tratamientos, animales, muestras y fracción de muestra; así mismo, como covariables a los valores de motilidad y HOS del semen fresco, la concentración espermática, el volumen eyaculado y la semana de experimentación. El tiempo en horas al cual fue analizado cada tratamiento (t: 24, 48, 72 y 96) fue la variable intrasujetos que se utilizó para el análisis. Se estimaron las medias marginales de los efectos principales y de las interacciones que fueron significativas realizándose una comparación por pares mediante la prueba de comparaciones múltiples de Bonferroni. El análisis estadístico se llevó a cabo mediante el uso del software SPSS 15.0 para Windows.
RESULTADOS
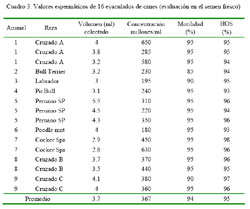
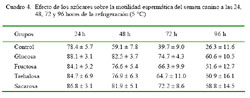
Los valores iniciales al momento de la colección de semen fueron de 3.7 ml, 367 millones de espermatozoides/ml, 93.7% de motilidad y 95.2% HOS (Cuadro 3). La motilidad espermática, en todos los grupos con azúcar, se encontró dentro de rangos aceptables durante las 96 horas de duración del experimento con valores cercanos al 90% (día 0) y 60% (día 4), mientras que en el grupo control disminuyó hasta 26% (p<0.05, Cuadro 4). Al evaluar los dos tipos de monosacáridos (glucosa y fructosa) y disacáridos (trehalosa y sacarosa), se encontró que los mayores porcentajes de motilidad correspondieron a los grupos glucosa y sacarosa (p<0.05).
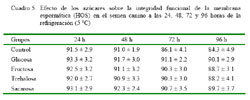
En el Cuadro 5 se presentan los resultados de la prueba de HOS. La integridad funcional de membrana se mantiene relativamente estable durante el estudio. El HOS al inicio del experimento fue de 93% y luego de 96 horas en refrigeración disminuyó solamente en 10%. Asimismo, la integridad de membrana se mantuvo ligeramente superior en los grupos con azúcares (87-90%) en comparación con el grupo control (83-85%). Todos los grupos con azúcares se diferencian significativamente del grupo control (sin azúcar), siendo glucosa y sacarosa quienes mantienen los valores más altos (Cuadro 6). En el caso del grupo control, la integridad funcional de membrana se mantuvo estable por 48 h.
DISCUSIÓN
Los resultados sobre refrigeración de semen canino son ligeramente superiores a los descritos por Rota et al. (1995), Messias (2000) y Manosalva et al. (2005), quienes describen valores de motilidad de 53 y 45% a las 96 horas, y 82% a las 24 horas, respectivamente, y valores de HOS de 84-86%.
Este estudio es el primero en describir el efecto de varios monosacáridos (glucosa y fructosa) y disacáridos (trehalosa y sacarosa) sobre parámetros de función y viabilidad espermática durante la refrigeración a 5 °C de semen canino. Al no existir reportes locales previos sobre refrigeración de semen canino, se tomó como referencia el estudio de Yildiz et al. (2000). En general, se encontró que la motilidad espermática desde las 0 hasta las 96 horas disminuyó en 30%, mientras que los valores de integridad funcional de membrana (HOS+) variaron muy poco con respecto a los valores iniciales, describiendo una tendencia distinta a los valores para motilidad. Si bien, todos los azúcares utilizados presentaron valores superiores a los del grupo control (sin azúcar), tanto glucosa como sacarosa ofrecieron mejores resultados en cuanto a motilidad y HOS.
Los resultados podrían explicarse porque durante la refrigeración de semen, la función principal de los azúcares es proveer el sustrato energético requerido por los espermatozoides para el desempeño normal de sus funciones, siendo la glucosa uno de los azúcares mejor utilizados por la célula espermática (Rigau et al. 2002) y células en general (Guyton y Hall, 2000). El efecto benéfico de la sacarosa se explicaría por la posible existencia de sitios de unión específicos para este disacárido.
Fernández-Novell et al. (2004) observaron en espermatozoides de perro que la glucosa, pero no la fructosa, puede activar específicamente la proteína quinasa AKT, implicada en la regulación de varios procesos metabólicos celulares importantes. Esto implica que la glucosa activaría directamente todos los caminos AKT-regulados del espermatozoide canino. Por lo tanto, se puede asumir que, en el caso del canino, los azúcares pueden actuar no solo como substratos propios del metabolismo, sino, además, como moduladores directos de la función espermática.
Los estudios realizados por Rigau et al. (2002), indican que los distintos efectos funcionales de la glucosa y la fructosa sobre el espermatozoide canino, son el resultado de diferencias en las rutas metabólicas que mantienen el equilibrio de su estatus energético. La fructosa, con respecto a la glucosa, mostró un incremento de velocidad en las rutas metabólicas y, por lo tanto, en la formación de ATP. La fructosa, al aumentar el índice de consumo de ATP relacionado a motilidad, da lugar a un patrón específico más rápido y linear que el observado con la glucosa (Rigau et al., 2001), dedicándose la mayor parte del consumo de energía del espermatozoide al mantenimiento de dicha motilidad.
El efecto de la fructosa sobre la motilidad, se encontraría relacionado a un fuerte aumento en el índice de fosforilación de las hexosas con respecto a la glucosa. Este aumento, sumado al consumo de ATP en la fosforilación de tirosina, podría llevar al establecimiento del substrato que completa el ciclo en el cual se genera la energía que se pierde inmediatamente. Una caída en los niveles intracelulares de ATP induciría lógicamente, a un incremento inmediato del ADP, el cual a su vez activaría el ritmo glucolítico y aumentaría la formación de ATP. Cuando el ATP recobrara niveles altos, se produciría una bajada simultánea de los niveles de ADP, con la consecuente disminución en el ritmo glucolítico (Hammersted y Lardy, 1983). Este fenómeno de retroalimentación causaría una tasa elevada en el consumo y posible agotamiento de la fructosa aportada en el diluyente. Eso indica la importancia de escoger el tipo y concentración adecuada de azúcar, puesto que pequeñas variaciones podrían originar grandes cambios en el estado funcional, y por lo tanto en la capacidad de supervivencia de los espermatozoides almacenados en refrigeración.
La marcada caída (5%) en los valores de HOS del grupo control entre las 48 y 72 horas (Cuadro 5), podría deberse a la carencia de un agente crioprotector en el medio diluyente con respecto a los demás grupos, y a la falta de un sustrato energético exógeno que permita suplir las exigencias propias del metabolismo espermático.
CONCLUSIONES
-
La refrigeración de semen canino a 5 °C por 96 h no produce un daño significativo en la membrana espermática, pero se recomienda el uso de azúcares (glucosa, fructosa, trehalosa o sacarosa) como sustrato energético de los espermatozoides para el mantenimiento de niveles apropiados de motilidad espermática.
-
La glucosa y la sacarosa son los azúcares que brindan la mejor protección de membrana espermática.
LITERATURA CITADA
1. Farstad W. 2000. Assisted reproductive technology in canid species. Theriogenology 53: 175-186.
2. Fernández-Novell JM, Ballester J, Medrano A, Otaegui P, Rigau T, Guinovart J, Rodríguez-Gil JE. 2004. The presence of a high-Km hexokinase activity in dog, but not in boar, sperm. FEBS Lett 570: 211-216.
3. Guyton A, Hall J. 2000. Tratado de fisiología médica. 10a ed. Madrid: McGraw-Hill-Interamericana. 1280 p.
4. Hammersted RH, Lardy HA. 1983. The effects of substrate cycling on the ATP yield of sperm glycolysis. J Biol Chem 258: 8759-8768.
5. Hishinuma M, Sekine J. 2003. Evaluation of membrane integrity of canine epididymal spermatozoa by short hypoosmotic swelling test with ultrapure water. J Vet Med Sci 65: 817-820.
6. Hori T, Ichikawa M, KawakamI E, Tsutsui T. 2003. Artificial insemination of frozen epididymal sperm in Beagle dogs. J Vet Med Sci 66: 37-41.
7. Linde-Forsberg C. 1991. Achieving canine pregnancy by using frozen or chilled extended semen. Vet Clin N Am- Small 21:467-485.
8. Manosalva I, Cortés C, Leyva V, Valdivia M, De los Reyes M, Barros C, Moreno R. 2005. Efecto de la refrigeración sobre la motilidad, integridad de membrana acrosomal y reacción acrosomal en espermatozoides caninos. Rev Inv Vet, Perú 16(2): 114-128.
9. Medrano A. 2006. Estudio del metabolismo energético de los espermatozoides porcinos y su repercusión en el diseño de diluyentes optimizados para la conservación de semen refrigerado. Tesis Doctoral. Bellaterra, España: Universidad Autónoma de Barcelona. 250 p.
10. Messias C. 2000. Algumas características do sêmen do cão após diluição e resfriamento. Grau de Mestre. Curitiba, Brazil: Ciências Agrárias, Universidade Federal do Paraná. 47 p.
11. Michelsen WD, Memon MA, Anderson PB, Freeman DA. 1993. The relationship of semen quality to pregnancy rate and litter size following artificial insemination in the bitch. Theriogenology 39: 553-560.
12. Pinto CR, Eilts BE, Paccamonti DL. 1999. Fertility in bitches artificially inseminated with extended, chilled semen. Theriogenology 52: 609-616.
13. Rigau T, Farré M, Ballester J, Mogas T, Peña A, Rodríguez-Gil JE. 2001. Effects of glucose and fructose on motility patterns of dog spermatozoa from fresh ejaculates. Theriogenology 56: 801-815.
14. Rigau T, Rivera M, Palomo MJ, Fernández-Novell JM, Mogas T, Ballester J, Peña A, et al. 2002. Differential effects of glucose and fructose on hexose metabolism in dog spermatozoa. Reproduction 123: 579-591.
15. Romagnoli S. 2002. Canine artificial insemination with fresh, refrigerated and frozen semen. En: Congreso de Ciencias Veterinarias, SPCV. Oeiras, Portugal. p 167-170.
16. Rota A, Strom B, Linde-Forsberg C. 1995. Effects of seminal plasma and three extenders on canine semen stored at 4 °C. Theriogenology 44: 665-900.
17. Sanchez A, Rubilar J, Gatica R. 2002. Uso de la prueba hipoosmótica en la evaluación de la fertilidad potencial de semen canino fresco y congelado. Arch Med Vet 34(Supl 1): 131-134.
18. Sirivaidyapong S, Cheng FP, Marks A, Voorhout WF, Bevers MM, Colenbrander B. 2000. Effect of sperm diluents on the acrosome reaction in canine sperm. Theriogenology 53: 789-802.
19. Stornelli MA, Stornelli MC, Arauz MS, De La Sota L. 2001. Inseminación artificial con semen fresco, refrigerado y congelado. Aplicación y desarrollo en caninos. Analecta Vet 21(1): 58-66.
20. Yildiz C, Kaya A, Aksoy M, Tekeli T. 2000. Influence of sugar supplementation of the extender on motility, viability and acrosomal integrity of dog spermatozoa during freezing. Theriogenology 54: 549-585.