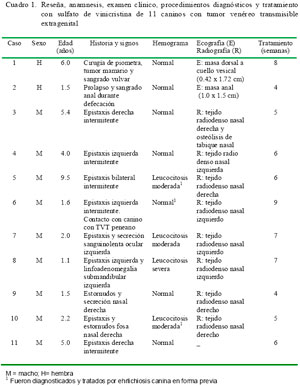
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.22 n.4 Lima oct./dez. 2011
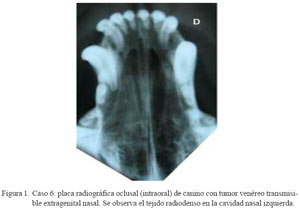
Tumor venéreo transmisible canino extragenital: estudio retrospectivo de 11 casos
Extragenital transmissible venereal tumor: retrospective study of 11 cases
Ricardo Grandez R.1,2, Claudia Miguel de Priego G.1, Pedro Yi A.3, Luis Torres P.3
1 Clínica Veterinaria Cayetano Heredia, 3 Laboratorio de Histología y Patología, Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia, Lima
2 E-mail: rgrandez@hotmail.com
RESUMEN
Se realizó el seguimiento médico a 11 pacientes caninos atendidos entre junio de 2003 y agosto 2009 con historia o signos clínicos compatibles con tumor venéreo transmisible (TVT) canino de ubicación extragenital. Se les hizo pruebas radiográficas y ecográficas, y se les tomó muestras para análisis citológicos, histopatológicos y de laboratorio clínico. La presentación de TVT en cavidad nasal fue la más frecuente (9/11), donde la epistaxis unilateral fue el signo clínico más común (7). Solo se observó un caso de epistaxis bilateral. La descarga sanguinolenta fue el único signo observado en los casos donde la lesión se ubicó en muñón uterino (1) o en el ano (1). La duración de los signos clínicos fue de 2.8 meses (0.5 a 12 meses). Los procedimientos ecográficos y radiográficos fueron de gran ayuda para determinar la presencia, ubicación y tamaño de las lesiones; la citología e histopatología fueron los procedimientos de elección para el diagnóstico del TVT extragenital; y la quimioterapia con sulfato de vincristina, por 6.5 semanas (4 a 9 semanas), fue efectiva en todos los casos, observándose remisión de los signos clínicos y disminución o desaparición de las alteraciones imagenológicas.
Palabras clave: canino, tumor venéreo transmisible, extragenital
ABSTRACT
A medical follow-up on 11 patients with clinical signs compatible with extra-genital canine venereal transmissible tumor was conducted from June 2003 to August 2009. The canines were evaluated and further medical procedures such as radiographies, ultrasounds, cytology and histopathology were performed to confirm the diagnosis. The nasal tumor was the most common presentation (9/11) and unilateral epistaxis was the most common clinical sign (7). Only one case of bilateral epistaxis was observed. Bloody discharge was the only clinical sign observed in cases where the lesion was located in the uterine stump (1) or anus (1). The clinical signs lasted in average 2.8 months (0.5-12 months). The ultrasound and radiographic procedures were helpful in determining the presentation, location and size of the lesions; the cytology and histopathology showed to be suitable clinical procedures to determine the final diagnosis; and treatment with vincristina sulfate, used for 6.5 weeks (4 to 9 weeks) proved to be effective in all cases as imagenological alterations decreased or disappeared.
Key words: dogs, tramsmissible venereal tumor, extragenital
INTRODUCCIÓN
El tumor venéreo transmisible canino (TVT), llamado también tumor de Sticker, sarcoma de Sticker o granuloma venéreo, es una neoplasia benigna con baja tasa de metástasis, y transmisible sexualmente por pasaje de células exfoliadas intactas. La implantación tumoral requiere una mucosa genital receptora previamente lesionada, como ocurre en el coito (Martínez et al., 2002; Park et al., 2006; Spugnini et al., 2008), constituyendo un aloinjerto natural de células neoplásicas exfoliadas (Ortega-Pacheco et al., 2003).
El TVT está ampliamente distribuido a nivel mundial, predominando en los países tropicales donde los perros callejeros tienen un rol importante en la diseminación (Mikaelian y Girard, 1998; Ortega-Pacheco et al., 2003). Los animales más afectados son aquellos que tienen un mayor tiempo de exposición al contagio por contacto con animales vagabundos sin control sexual (Ortega- Pacheco et al., 2003; Mello et al., 2005). Se ha descrito una alta prevalencia en países africanos, alcanzando hasta el 34% de la población, en tanto que en América Latina se ha reportado 2.6% de prevalencia en perros callejeros en Mérida, México (Mello et al., 2005).
Los tumores primarios se localizan en la mucosa de los genitales externos, afectándose principalmente los animales jóvenes sexualmente maduros (Rogers et al., 1998; Mello et al., 2005). Otras formas de transmisión están dadas por medio del olfateo y el lamido que permiten la implantación de las células tumorales en zonas extragenitales como la piel (Bolio et al., 2002; Martínez et al., 2002), las vías nasales (Levy et al., 2006), la cavidad oral, el ojo (Rodrigues et al., 2001) y la región peri-anal (Ortega-Pacheco et al., 2003; Mello et al., 2005; Park et al., 2006). Asimismo, se ha reportado casos de implantación extragenital primaria sin compromiso genital previo (Papazoglou et al., 2001; Marcos et al., 2006). La presentación de metástasis es poco frecuente, afectando mayormente los ganglios linfáticos regionales (Rogers et al., 1998; Mello et al., 2005).
El TVT se caracteriza por ser una masa blanda multilobulada sangrante con forma de coliflor, friable, de color rosado, que puede estar ulcerada e infectada y, en muchos casos, con apariencia necrótica (Martínez et al., 2002; Ortega-Pacheco et al., 2003; Mello et al., 2005). El signo más importante es la descarga sanguinolenta o sangrado prepucial o vaginal. La localización más frecuente en machos es desde la parte caudal del pene hasta el bulbo del glande, y en hembras en la conjunción de la vagina y el vestíbulo; donde los signos asociados con el tumor pueden ser confundidos con el celo o con afecciones como cistitis, prostatitis o uretritis (Rogers et al., 1998; Mello et al., 2005).
El origen de las células neoplásicas no está bien definido, pero los estudios inmunohistoquímicos indican que el tumor es de origen histiocítico; presentando entre 57 a 64 cromosomas, número menor al de la especie (78). El diagnóstico convencional se basa en el examen físico y los hallazgos citológicos típicos: células pequeñas redondeadas con núcleo grande y citoplasma prominente, pu diéndose observar vacuolización citoplasmática e imágenes de mitosis (Liao et al., 2003; Mello et al., 2005). En la actualidad se dispone de otras técnicas diagnósticas de gran eficacia como la inmuno-histoquímica y la reacción en cadena de la polimerasa (PCR) (Park et al., 2006).
Si bien se ha determinado que la inmunidad juega un rol importante en el control de la enfermedad (Pérez et al., 1998), se debe emplear la quimioterapia como medida de control. Diversos reportes señalan a la monoquimioterapia con sulfato de vincristina como el tratamiento más efectivo (Gonzalez et al., 2000; Mello et al., 2005; Nak et al., 2005; Scarpelli et al., 2010). Los procedimientos quirúrgicos no se consideran efectivos pues presentan un 33.4% de recurrencia, especialmente con metástasis a nódulos linfáticos regionales (Rogers et al., 1998).
El presente estudio muestra los resultados del seguimiento médico de ocho casos con historia o signos clínicos compatibles con TVT de ubicación extragenital, y tratados con sulfato de vincristina como único agente quimioterápico.
MATERIALES Y MÉTODOS
Se realizó el seguimiento médico a 11 pacientes caninos de la Clínica Veterinaria Cayetano Heredia de la Facultad de Veterinaria y Zootecnia (FVZ), Universidad Peruana Cayetano Heredia (UPCH), atendidos entre junio de 2003 y marzo 2009, con historia o signos clínicos compatibles con tumor venéreo transmisible canino de ubicación extragenital. Se hicieron pruebas radiográficas y ecográficas, y se tomaron muestras para análisis citológico, histopatológico y de laboratorio clínico.
Casos Clínicos
- Caso 1 (C1): Siberian Husky hembra de 6 años, derivado con historia de piometra y tratada mediante ovario histerectomía tres meses antes. A partir de la cirugía, la paciente evidenció un sangrado vulvar con características de celo.
- Caso 2 (C2): Mestizo hembra de 2 años, con historia de un posible prolapso rectal y sangrado rectal intermitente por tres meses, siendo evidente en la defecación.
- Caso 3 (C3): Mestizo macho de 5 años, con historia de epistaxis profusa intermitente del orificio nasal derecho desde hace 4 meses. El paciente recibió tratamiento a base de anticoagulantes con mejora inicial.
- Caso 4 (C4): Mestizo macho de 4 años, con historia de epistaxis copiosa del orificio nasal izquierdo desde hace 2 meses.
- Caso 5 (C5): Samoyedo macho de 10 años, con historia de epistaxis profusa de ambas fosas nasales y asociada a diagnóstico serológico y tratamiento desde hace 2 semanas por ehrlichiosis, enfermedad que cursa con epistaxis.
- Caso 6 (C6): Labrador macho de 2 años de edad, con historia de sangrado nasal izquierdo asociado a un diagnóstico de ehrlichiosis, tratado desde hace un mes. Presentó historia de contacto con canino con diagnóstico de TVT peneano.
- Caso 7 (C7): Siberiano macho de 2 años de edad, con historia de sangrado nasal y ocular izquierdo desde hace un año.
- Caso 8 (C8): Mestizo macho de 1 año, derivado con historia de epistaxis nasal izquierda desde hace un mes.
- Caso 9 (C9): Mestizo macho de 1.5 años, con historia de molestia nasal, estornudos y secreción nasal derecha desde hace un mes.
- Caso 10 (C10): Poodle macho de 2.2 años, con historia de epistaxis y estornudo nasal derecho desde hace 1.5 meses, asociado a un diagnóstico serológico y tratamiento de ehrlichiosis y anaplasmosis canina desde hace un mes.
- Caso 11 (C11): Labrador macho de 5 años, con historia de epistaxis derecha desde hace 2 meses y tratado sintomáticamente con coagulantes.
Procedimientos Diagnósticos
Análisis clínico patológico. Se tomó muestras de sangre de la vena cefálica para estudios de hemograma (C1-C11); bioquímica sérica (C3, C6, C7, C10, C11), y pruebas pre operatorias completas (C1, C2). Las muestras se procesaron en el Laboratorio de Patología Clínica, FVZ-UPCH.
Procedimientos imagenológicos. Se hizo una evaluación ecográfica abdominal en C1 y perianal en C2 con un equipo de ultrasonido Pie Medical 100 Falco con transductor dual multifrecuencial de 5-7.5 MHz, previo rasurado de las zonas a evaluar. En C3 a C10 se procedió a la toma de placas oclusal (intraoral) dorso ventral de cavidad nasal y placa dorso ventral de cabeza, con un equipo de Rayos X Polymobil Plus SIEMENS, con revelado manual y lectura en negatoscopio convencional.
Citología. En C3 a C11 se hicieron estudios citológicos mediante hisopado nasal (Belford y Lumsden, 2000). Las muestras se extendieron en láminas portaobjetos y fueron coloreadas con Tinción 15®. La toma de muestra del ganglio linfático submandibular (C8) se hizo con aspiración con aguja fina (Morris y Dobson, 2001).
Histopatología. Se realizaron procedimientos quirúrgicos de celiotomía exploratoria y biopsia de masa neoplásica (C1), y escisión de masa neoplásica anal (C2). Las piezas operatorias se colocaron en formol al 10%. Las muestras fueron sometidas a técnicas histopatológicas convencionales en el Laboratorio de Patología, FVZ-UPCH, seccionadas a 5 o 6 μm y coloreadas con hematoxilina eosina para su evaluación microscópica.
Procedimientos terapéuticos. Establecido el diagnóstico de TVT, se procedió con un protocolo quimioterápico en base a sulfato de vincristina en dosis de 0.5 mg/m2 (Plumb, 2006) por semana hasta la remisión de las lesiones. El quimioterápico fue suministrado vía endovenosa, previa colocación de un catéter abocat 22G x 1½, para la aplicación de ClNa 0.9 % a razón de 35 ml/kg de peso vivo.
RESULTADOS
Todos los canes tenían dueño y, además, contacto frecuente con perros callejeros. La edad promedio fue de 3.6 años (1.1 a 9.5) y el peso promedio de 24.9 kg (13.0 a 52.0). Los nueve casos de TVT nasal correspondieron a caninos machos (Cuadro 1).
El signo clínico prevalente en los casos de TVT nasal fue la epistaxis unilateral intermitente, aunque uno presentó sangrado bilateral (C5). En un caso (C7) se observó, además, secreción ocular sanguinolenta, y en otro (C8) estuvo acompañada de linfoadenomegalia submandibular; ambas lesiones al mismo lado de la epistaxis. Asimismo, la descarga vaginal sanguinolenta y la presencia de una masa vaginal sangrante de 1.0 x 1.2 cm fue observado en C1, donde la lesión se ubicó en el muñón uterino; y sangrado anal y con presencia de una masa nodular sangrante de 1.0 x 1.5 cm protruyendo del esfínter anal interno fue observado en C2, donde la lesión se ubicó en el ano. La duración de los signos clínicos fue de 0.5 a 12 meses.
Se encontró leucocitosis moderada en tres casos (C5, C7 y C10) y severa en uno (C8) (Cuadro 1). Los casos C5 y C6, con historia de diagnósticos positivos previos a ehrlichiosis mediante la prueba de ELISA, y C10 con diagnóstico positivo a ehrlichiosis y anaplasmosis mediante la misma prueba, no mostraron alteraciones hematológicas compatibles con persistencia de esta patología. Los resultados de la bioquímica sérica (C3, C6, C7, C10 y C11) y análisis prequirúrgicos (C1 y C2) estuvieron dentro de los rangos aceptables para la especie.
La evaluación ecográfica de C1 evidenció la presencia de una masa heterogénea de bordes irregulares de 0.42 x 1.72 cm en el muñón uterino, dorsal al cuello vesical. En la celiotomía exploratoria se encontró una masa irregular, de bordes imprecisos, friable y de color rojo oscuro que involucraba el muñón uterino. La evaluación ecográfica y exploración rectal en C2 evidenció una masa de 1.0 x 1.5 cm de forma irregular y friable en el esfínter anal.
La evaluación radiológica en C3 a C10 mostró la presencia de tejido radiodenso y pérdida del patrón turbinado trabecular nasal unilateral, siendo cuatro casos en el lado derecho (C3, C5, C9 y C10) y los otros cuatro en el lado izquierdo (C4, C6, C7 y C8) (Cuadro 1, Fig. 1). En C3 se observaron lesiones compatibles con osteólisis del tabique nasal. No se realizó el estudio radiográfico complementario en C11.
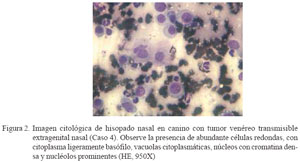
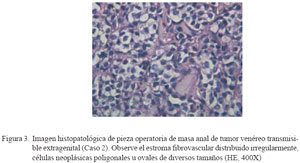
Las muestras de hisopado nasal (C3 a C11) revelaron la presencia de abundantes células redondas con citoplasma ligeramente basofílico o pálido y abundancia de vacuolas citoplasmáticas, en tanto que el núcleo se caracterizó por presentar cromatina densa, nucléolo prominente y figuras de mitosis en cantidad variable (Fig. 2). En los cortes histológicos (C1 y C2) se observó un tejido infiltrado por células neoplásicas redondas o poliédricas formando masas compactas infiltradas por bandas de tejido fibrovascular (Fig. 3). El extendido del ganglio linfático submandibular (C8) mostró un cuadro de hiperplasia reactiva linfocítica.
La quimioterapia semanal con sulfato de vincristina hasta la remisión de los signos clínicos y disminución o desaparición de las alteraciones imagenológicas se hizo por 6.1 semanas en promedio (4 a 9 semanas).
DISCUSIÓN
Los resultados del presente estudio concuerdan con otros reportes que indican que los caninos mestizos, las razas grandes, los machos sexualmente activos (1 a 5 años) y los perros callejeros son los más afectados (Gonzalez et al., 2000; Papazoglou et al., 2001). En este estudio, no obstante, los canes contaban con propietarios pero tenían contacto frecuente con perros callejeros.
Los nueve casos de TVT nasal corresponden a machos, los cuales pueden sufrir la implantación de células viables durante el olfateo vigoroso con ejemplares hembra o machos con TVT genital (Papazoglou et al., 2001). Se indica que la afección de la cavidad nasal puede ser uni o bilateral, siendo la signología más frecuente la epistaxis del lado afectado (Ortega-Pacheco et al. 2003; Park et al., 2006), fenómeno que se corrobora con los nueve casos de TVT nasal en estudio, donde este signo estuvo presente en todos los animales. Asimismo, ninguno de los caninos con TVT nasal presentó lesiones primarias en órganos genitales, de modo que se les considera como implantaciones primarias (Papazoglou et al., 2001; Marcos et al., 2006).
La presentación anal es una de las ubicaciones menos frecuente de presentación extragenital, y usualmente sigue un patrón de implantación primaria debido al olfateo, estornudo o lamido de ejemplares afectados con TVT nasal u oral (Papazoglou et al., 2001). Los casos de TVT intrauterino son muy ra ros, habiéndose encontrado solo un reporte (Aprea et al., 1994). En este caso, se podría postular que la propagación al muñón uterino se debió al manejo quirúrgico iatrogénico de la ovario histerectomía, sin la ubicación previa del tumor venéreo vaginal primario.
La ecografía resultó eficaz para la detección de las masas sospechosas en tejidos internos, así como la radiografía para determinar la presencia, ubicación y tamaño de las lesiones nasales. Asimismo, ambas técnicas permitieron evaluar la evolución de las lesiones durante el tratamiento. La patología clínica mostró resultados variables, indicadores de efectos secundarios de la neoplasia, sin ser determinantes para el diagnóstico de TVT.
El diagnóstico microscópico del TVT canino, a partir de improntas para citología o histopatología constituyeron el procedimiento de elección, como reportan Liao et al. (2003) y Mello et al. (2005), siendo las características microscópicas concluyentes. La terapia con sulfato de vincristina fue efectiva en todos los casos, no habiéndose observado efectos secundarios o resistencia a la droga durante el tratamiento. El periodo de tratamiento varió de acuerdo a la magnitud de la lesión, sin llegar a superar las 9 semanas.
CONCLUSIONES
-
La presentación de TVT en cavidad nasal fue la presentación más común de la ubicación extragenital, siendo el signo clínico más común la epistaxis.
-
La citología e histopatología fueron los procedimientos de elección para el diagnóstico del TVT extragenital, y los procedimientos ecográficos y radiográficos fueron de gran ayuda para determinar la presencia, ubicación y tamaño de las lesiones.
-
La quimioterapia con sulfato de vincristina fue efectiva en el tratamiento y curación de la neoplasia.
LITERATURA CITADA
1. Aprea AN, Allende MG, Idiard R. 1994. Tumor venéreo transmisible intrauterino: descripción de un caso. Vet Argentina 103: 192-194.
2. Belford C, Lumsden J. 2000. Citopatología. En: Davidson M, Rodereick E, Lumsden J (eds). Manual de patología clínica en pequeños animales. Madrid: Ed Harcourt. p 169-193.
3. Bolio ME, Sauri CH, Acevedo CM, Ortega-Pacheco A, Gutiérrez E, Miranda JA, et al. 2002. Tumor venéreo transmisible extragenital: caso clínico en un perro. Consulta Difus Vet: 96: 75-77.
4. Gonzalez CM, Griffey SM, Naydan DK, Flores E, Cepeda R, Cattaneo G. 2000. Canine transmissible venereal tumour: a morphological and immunohistochemical study of 11 tumours in growth phase and during regression after chemotherapy. J Comp Path 122: 241-248.
5. Levy E, Mylonakis ME, Saridomichelakis MN, Polizopoulou ZS, Psychogios V, Koutinas AF. 2006. Nasal and oral masses in a dog. Vet Clin Pathol 35:115-118.
6. Liao KW, Lin ZY, Pao HN, Kam SY, Wang FI, Chu RM. 2003. Identification of canine transmissible venereal tumor cells using in situ polymerase chain reaction and the stable sequence of the long interspersed nuclear element. J Vet Diag Invest 15: 399-406.
7. Marcos R, Santos M, Marrinhas C, Rocha E. 2006. Cutaneous transmissible venereal tumor without genital involvement in a prepubertal female dog. Vet Clin Pathol 35: 106-109.
8. Martínez MM, Ballut JC, Cardona, JA. 2002. Tumor venéreo transmisible (TVT) de localización extragenital. MVZ-Cordoba 7: 168-170.
9. Mello MI, Ferreira de Souza F, Gobello C. 2005. The canine transmissible venereal tumor: etiology, pathology, diagnosis and treatment. In: Concannon PW, England G, Verstegen III J, Linde-Forsberg C (eds). Recent advances in small animal reproduction. International Veterinary Information Service, Ithaca NY. [Internet].[8 enero 2009]. Disponible en: http://www.ivis.org
10. Mikaelian I, Girard C. 1998. Transmissible venereal tumor: a consequence of sex tourism in a dog. Can Vet J 39: 591.
11. Morris J, Dobson J. 2001. Diagnosis and staging. In: Small animal oncology. Malden USA: Blackwell Science. p 15-30. 12. Nak D, Nak Y, Cangul IT, Tuna B. 2005. A clinico-pathological study on the effect of vincristine on transmissible venereal tumour in dogs. J Vet Med A 52: 366-370.
13. Ortega-Pacheco A, Acevedo-Arcique M, Sauri-Arceo C, Bolio-González M, Gutiérrez-Blanco E. 2003. Prevalencia de tumor venéreo transmisible en perros callejeros de la ciudad de Mérida, Yucatán, México. Rev Biomed 14: 83-87.
14. Papazoglou LG, Koutinas AF, Plevraki AG, Tontis D. 2001. Primary intranasal transmissible venereal tumour in the dog: a retrospective study of six spontaneous cases. J Vet Med A 48: 391-400.
15. Park MS, Kim Y, Kang MS, Oh SY, Cho DY, Shin NS, Kim DY. 2006. Disseminated transmissible venereal tumor in a dog. J Vet Diag Invest 18: 130- 133.
16. Pérez J, Day MJ, Mozos E. 1998. Immunohistochemical study of the local inflammatory infiltrate in spontaneous canine transmissible venereal tumour at different stages of growth. Vet Immunol Immunop 64: 133-147.
17. Plumb C. 2006. Veterinary drug handbook. 5th ed. Wisconsin, USA: Blackwell Publishing. 927 p.
18. Rodrigues GN, Alessi AC, Laus JL. 2001. Intraocular transmissible venereal tumor in a dog. Ciência Rural, Santa Maria: 31: 141-143.
19. Rogers KS, Walker MA, Dillon HB. 1998. Transmissible venereal tumor: a retrospective study of 29 cases. J Am Anim Hosp Assoc 34: 463-470.
20. Scarpelli KC, Valladão ML, Metze K. 2010. Predictive factors for the regression of canine transmissible venereal tumor during vincristine therapy. Vet J. 183: 362-363.
21. Spugnini EP, Dotsinsky I, Mudrov N, Citro G, DAvino A, Baldi A. 2008. Biphasic pulses enhance bleomycin efficacy in a spontaneous canine genital tumour model of chemoresistance: Sticker sarcoma. J Exp Clin Cancer Res 27: 58 [Internet] [15 April 2009]. Available in: http://www.jeccr.com/content/27/1/58