Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.1 Lima 2012
Desarrollo postnatal del páncreas endocrino de cuyes (Cavia Porcellus) lactantes
Postnatal development of the endocrine pancreas of lactating guinea pigs (Cavia Porcellus)
José Rodríguez G.1,4, Sergio Cueva M.1, María Vásquez C.1, Boris Lira M.1, Luis Olivera S.3, Juan Espinoza B.2
1 Laboratorio de Fisiología Animal,
2 Laboratorio de Farmacología y Toxicología Veterinaria, Facultad de Medicina Veterinaria, Lima
3 Laboratorio de Patología, Servicio Nacional de Sanidad Agraria – SENASA, Lima, Perú
4 E-mail: joserodriguezmv@gmail.com
RESUMEN
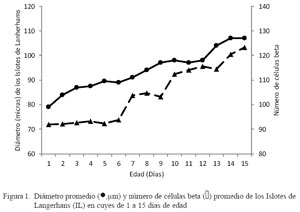
Se estudió el desarrollo postnatal del páncreas endocrino en 45 cuyes de 1 a 15 días de edad. El diámetro de los islotes de Langerhans aumentó desde 71.9 ± 13.2 μm en el primer día de edad hasta 103.3 ± 32.5 μm a los 15 días de edad, mostrando un incremento lineal, aunque sin diferencia estadística por efecto del día de edad. En forma similar, el número de células aumentó desde 99.0 ± 29.7 hasta 127 ± 29 células entre el día 1 y el día 15 de edad, sin diferencia estadística por efecto del día de edad. Los resultados señalan que el desarrollo del páncreas endocrino en crías lactantes de cuyes, determinado por el diámetro de los islotes de Langerhans y el número de células , tiene tendencia a aumentar con la edad de los animales.
Palabras clave: páncreas endocrino, cuyes lactantes
ABSTRACT
The postnatal development of the endocrine pancreas was studied in 45 guinea pigs of 1 to 15 days of age. The diameter of the Langerhanss islets increased from 71.9 ± 13.2 μm at first day of age to 103.3 ± 32.5 μm at 15 days of age, showing a linear increase, but without statistical differences due to age. Similarly, the number of the cells varied from 99.0 ± 29.7 at first day of age to 127 ± 29 cells at 15 days of age, and without significant differences due to age. The results shows that the endocrine pancreas development of lactating guinea pigs, determined by the diameter of the Langerhanss islets and cell number, tend to develop according to the age of the animals.
Key words: endocrine pancreas, lactating guinea pigs
INTRODUCCIÓN
La glucosa es la principal fuente de energía que utiliza la célula. En los mamíferos, la regulación de la concentración del azúcar en sangre es esencial para el organismo, ya que estados de hiperglucemia o hipoglucemia extremos pueden ser críticos para la supervivencia del animal. Esta regulación se realiza mediante un equilibrio entre el flujo de glucosa dentro y fuera del espacio extracelular, a través de la secreción coordinada de insulina y glucagón (Unger, 1991; DeFronzo, 1997). Los cuyes, como otras especies animales, especialmente en la etapa de lactación, son susceptibles de sufrir afecciones si no reciben la cantidad necesaria de energía en su dieta o por trastornos durante el metabolismo de los carbohidratos.
Después de la ingestión de alimentos, el mantenimiento de la homeostasia de la glucosa depende de tres procesos que ocurren simultáneamente de una manera coordinada. Primero, en respuesta al incremento de la glucosa plasmática, se estimula la producción y secreción de insulina por parte de las células ß del páncreas; segundo, los incrementos de la glucemia y de la insulinemia inducen la captación de glucosa por los tejidos periféricos (hígado, músculo y tejido adiposo); y tercero, se inhibe la secreción de glucagón, lo que suprime la producción hepática de glucosa. Durante el ayuno, la captación de glucosa ocurre en tejidos insulino-independientes, especialmente en cerebro. La normoglucemia se mantiene gracias a la acción del glucagón y de otros factores hormonales y nerviosos, a través de un incremento en la producción de glucosa por parte del hígado (mediante la estimulación de la gluconeogénesis y de la glucogenólisis). Alteraciones funcionales a nivel de célula ß, hígado, músculo o tejido adiposo, pueden conducir a trastornos en la homeostasis de la glucosa, al desarrollo de intolerancia a la glucosa e incluso, a diabetes mellitus (DeFronzo, 1997).
La morfogénesis y la diferenciación del páncreas y sus tipos celulares son muy conservados entre los vertebrados durante el desarrollo fetal. El páncreas se desarrolla como estructura de yemas simples en el tubo del intestino primitivo a un órgano muy ramificado con muchos tipos de células especializadas (Kim y MacDonald, 2002). El páncreas maduro es un órgano bifuncional constituido principalmente por tejido exocrino organizado en acinos que segregan zimógenos con fines digestivos en la luz intestinal; en tanto que la otra porción pancreática, incorporado dentro del tejido exocrino, está conformada por los islotes de Langerhans, que albergan los distintos tipos de células endocrinas (Slack, 1995).
Todas las células de los islotes provienen de células progenitoras pluripotentes, tanto en el desarrollo como más adelante, durante la vida del animal. El desarrollo de las células endocrinas del páncreas depende de una compleja acción secuencial de varios factores de transcripción que garantizan la organogénesis normal y la posterior diferenciación de los diversos tipos de células endocrinas. La organogénesis del páncreas consiste en una cascada secuencial de eventos de inducción en asociación con la activación de factores de transcripción específicos, siendo el más importante el Pdx1 (pancreas duodenum homeobox 1) (Wang et al., 2001; Iype et al., 2005).
La compleja estructura de los islotes pancreáticos se compone de varios tipos de células endocrinas que secretan varias hormonas que juegan un papel vital en el mantenimiento de la homeostasis. Aquí radica la importancia del páncreas endocrino, al ser el centro de control de la homeostasia de la glucosa en el organismo. Para conseguirlo, debe estar muy vascularizado e inervado, de manera tal que pueda responder a los estímulos metabólicos, endocrinos o nerviosos que constantemente se producen en el organismo.
Los islotes de Langerhans consisten en cordones de células poliédricas que se encuentran cercanos a los capilares fenestrados, y revestidos por una membrana basal en la región próxima a dichos capilares. Los islotes contienen un número variado de células, que mediante técnicas de inmunohistoquímica y procedimientos de tinción especializados, se pueden identificar tres tipos principales: células alfa (), beta () y delta (), que son irregulares, y se encuentran mezcladas y dispersas por todo el islote (Cabrera et al., 2006). Además, hay otros tipos celulares en menor proporción, como las células de secreción de polipéptido pancreático (PP) y las células dendríticas. Las secreciones producto de estas células son las siguientes: célula , glucagón; célula , somatostatina y gastrina; célula dendrítica, antígeno clase II con capacidad fagocítica (Leprini et al., 1987); célula PP, polipéptido pancreático; y célula , insulina y el polipéptido amiloide del islote (IAPP); sin embargo, no todas las células secretan IAPP (Iki y Pour, 2006).
El objetivo del estudio fue describir y evaluar el desarrollo postnatal del diámetro del páncreas endocrino (Islotes de Langerhans) y el número de células beta pancreáticas.
MATERIALES Y MÉTODOS
Se utilizaron tres cuyes (Cavia porcellus) por cada día de edad, entre 1 y 15 días de edad, tomados al azar de acuerdo a su fecha de nacimiento, del bioterio de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima.
Los cuyes fueron pesados en una balanza electrónica, y sacrificados por sobredosis de pentobarbital sódico intracardiaco. Se realizó el sangrado por incisión en la vena yugular y se removió el páncreas. En la masa pancreática se hizo cortes transversales de 0.5 cm2 en la cabeza, cuerpo y cola, y se les colocó en formol al 10%. Las muestras fueron remitidas al Laboratorio de Patología del Servicio Nacional de Sanidad Agraria (SENASA) para su procesamiento. Se obtuvo láminas histológicas teñidas con Hematoxilina-Eosina (HE) y con la técnica histoquímica de Tricrómico de Gomori (específica para páncreas endocrino).
Las láminas con HE se usaron para evaluar el crecimiento microscópico de los Islotes de Langerhans (IL), mediante el uso de un microscopio Carl Zeiss y el programa Axion Vision (software de medición bidimensional), evaluándose el diámetro (en micras) de 10 IL dentro de un campo de 100X. Con las láminas teñidas con Tricrómico de Gomori (Gomori, 1941) se determinó el número de células beta de los IL, en un campo de 1000X (Lis et al., 2003).
Para determinar diferencias entre el diámetro de los IL y el número de células beta, se aplicó la prueba de análisis de varianza de una sola vía, con un nivel de confianza del 95%.
RESULTADOS Y DISCUSIÓN
Las células beta fueron observadas desde el primer día de edad (Fig. 1). Los valores promedios del diámetro (μm) y el número de células beta de los islotes de Langerhans (Fig. 1) en el páncreas de cuyes de 1 a 15 días de edad se incrementaron con la edad. El número de células beta representó el 65% del total de células contadas dentro del IL, en todas las edades. El diámetro de los islotes de Langerhans aumentó desde 71.9 ± 13.2 al primer día de edad hasta 103.3 ± 32.5 μm en el día 15; sin embargo, estas diferencias no fueron estadísticamente diferentes, debido en parte, a la gran variabilidad individual. Estos resultados guardan una estrecha relación con el estudio de Skau et al. (2001), quienes al evaluar la masa y el volumen del páncreas endocrino en la etapa postnatal de ratas determinaron una relación directa con la edad de los animales.
En forma similar, el número de células beta aumenta desde el primer día de vida (99.0 ± 29.9) hasta los 15 días de edad (127 ± 29 células), aunque con algunas mesetas, lo que demuestra que el crecimiento de los islotes de Langerhans ocurre en forma paralela con la diferenciación y aumento de los tipos celulares, en este caso, las células beta. Svenstrup et al. (2002) obtuvieron resultados similares en la rata. Asimismo, en cerdos, el volumen promedio de las células beta aumentó progresivamente en el periodo postnatal, llegando a una meseta a los 60 días de edad (Bock et al., 2003). La fase de mesetas representaría un periodo de remodelación del páncreas endocrino por mecanismos aún no explicados que tendrían que ver con la homeostasis glucostática, lo que también ha sido demostrado en ratas (Montanya et al., 2000).
La homeostasis glucémica se debe principalmente al correcto funcionamiento del páncreas endocrino, a través de sus secreciones hormonales como son la insulina y el glucagón. Alteraciones en este sistema endocrino causarán trastornos metabólicos hipo o hiperglucémicos (DeFronzo, 1997). Estos trastornos, en animales lactantes pueden llegar a ocasionar la muerte, debido a que no están fisiológicamente maduros y, por lo tanto, no pueden compensar los posibles desórdenes que se presenten.
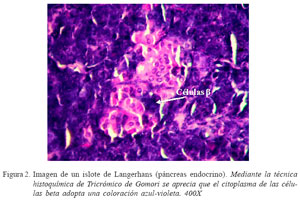
La identificación de las células beta desde el primer día de edad mediante la tinción específica de Tricrómico de Gomori (Fig. 2), indica que en el cuy, en forma similar a la mayoría de mamíferos, el proceso de diferenciación celular en el páncreas endocrino comienza en la etapa fetal. Este proceso de diferenciación celular se debe a la proteína PDX1, la cual genera la maduración de las células de los islotes. Es conocido que PDX- 1 se expresa en células precursoras que se encuentran en los compartimentos endocrinos y exocrinos del páncreas y es esencial para su desarrollo (Jonsson et al., 1993; Harrison et al., 1999), para la diferenciación de las células (Ferber et al., 2000; Kojima et al., 2002; Imai et al., 2005), y para el mantenimiento de la madurez y función de las células mediante la regulación de varios genes relacionados con estas células (Petersen et al., 1994; Holland et al., 2005). En una fase temprana del desarrollo embrionario, PDX-1 es expresado inicialmente en la región intestinal cuando el endodermo del intestino anterior se convierte en células precursoras pancreáticas. La expresión de PDX-1 se mantiene en las células precursoras durante el desarrollo del páncreas, pero cuando el páncreas madura se restringe a las células . En ratones, la falta del gen PDX1 trajo como consecuencia el desarrollo de hiperglucemia perinatal mortal, lo que indica que PDX-1 juega un papel crucial en la formación de células endocrinas y exocrinas, en especial las células (Jonsson et al., 1993).
CONCLUSIONES
-
El páncreas endocrino en cuyes de hasta 15 días de edad, determinado por el diámetro de los islotes de Langerhans y el número de células beta, desarrolla con la edad.
-
Los patrones de desarrollo del páncreas endocrino en el cuy están altamente conservados como sucede en otras especies, como la rata y el cerdo.
LITERATURA CITADA
1. Bock T, Kyhnel A, Pakkenberg B, Buschard K. 2003. The postnatal growth of the b-cell mass in pigs. J. Endocrinology 179: 245-252.
2. Cabrera O, Berman D, Kenyon N. 2006. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proc Natl Acad Sci USA 103: 2334-2339.
3. DeFronzo R. 1997. Pathogenesis of type 2 diabetes, metabolic and molecular implications for identifying diabetes genes. Diab Rev 5: 177-269.
4. Ferber S, Halkin A, Cohen H, Ber I, Einav Y, Goldberg I, Barshack I, et al. 2000. Pancreatic and duodenal homeobox gene 1 induces expression of insulin genes in liver and ameliorates streptozotocin-induced hyperglycemia. Nat Med 6: 568-572.
5. Gomori G.1941. Gomoris chromium haemotoxylin phloxine stain. Am J Pathol 17: 398-399.
6. Harrison K, Thaler J, Pfaff S, Gu H, Kehrl J. 1999. Pancreas dorsal lobe agenesis and abnormal islets of Langerhans in Hlxb9-deficient mice. Nat Genet 23: 71–75.
7. Holland A, Gonez L, Naselli G, MacDonald R, Harrison L. 2005. Conditional expression demonstrates the role of the homeodomain transcription factor Pdx1 in maintenance and regeneration of beta-cells in the adult pancreas. Diabetes 54: 2586-2595.
8. Iki K, Pour P. 2006. Distribution of pancreatic endocrine cells, including IAPP expressing cells in non diabetic and type 2 diabetic cases. J Histochem Cytochem 55: 111-118.
9. Imai J, Katagiri H, Yamada T, Ishigaki Y, Ogihara T, Uno K, Hasegawa Y, et al. 2005. Constitutively active PDX1 induced efficient insulin production in adult murine liver. Biochem Biophys Res Commun 326: 402-409.
10. Iype T, Francis J, Garmey J, Schisler J, Nesher R, Weir G, Becker T, et al. 2005. Mechanism of insulin gene regulation by the pancreatic transcription factor Pdx-1: application of pre-mRNA analysis and chromatin immunoprecipitation to assess formation of functional transcriptional complexes. J Biol Chem 280: 16798-16807.
11. Jonsson J, Carlsson L, Edlund T, Edlund H. 1993. Insulin-promoter-fac tor 1 is required for pancreas development in mice. Nature 37: 606-609.
12. Kim S, MacDonald R. 2002. Signaling and transcriptional control of pancreatic organogenesis. Curr Opin Genet Dev 12: 540-547.
13. Kojima H, Nakamura T, Fujita Y, Kishi A, Fujimiya M, Yamada S, Kudo M, et al. 2002. Combined expression of pancreatic duodenal homeobox 1 and islet factor 1 induces immature enterocytes to produce insulin. Diabetes 51: 1398-1408.
14. Leprini A, Valente U, Celada F. 1987. Morphology, cytochemical features and membrane phenotype of HLADR+ interstitial cells in the human pancreas. Pancreas 2: 127135.
15. Lis A, Barra F, Beltramino F, Peralta C. 2003. Páncreas: diferencias microestructurales y de indicadores funcionales. Sitio Argentino de Produccion Animal. [Internet]. [29 de marzo 2003]. Disponible en: http://www.produccionanimal.com.ar/informacion_tecnica/destete/58-pancreas.pdf
16. Montanya E, Nacher V, Biarnes M, Soler J. 2000. Linear correlation between beta-cell mass and body weight throughout the lifespan in Lewis rats: role of beta-cell hyperplasia and hypertrophy. Diabetes 49: 1341-1346.
17. Petersen H, Serup P, Leonard J, Michelsen B, Madsen O. 1994. Transcriptional regulation of the human insulin gene is dependent on the homeodomain protein STF1/IPF1 acting through the CT boxes. Proc Natl Acad Sci USA 91: 10465-10469.
18. Slack J. 1995. Developmental biology of the pancreas. Development 121: 1569- 1580.
19. Skau M, Pakkenberg B, Buschard K, Bock T. 2001. Linear correlation between the total islet mass and the volume-weighted mean islet volume. Diabetes 50: 1763-1770.
20. Svenstrup K, Skau M, Pakkenberg B, Buschard K, Bock T. 2002. Postnatal development of beta-cells in rats. Proposed explanatory model. Acta Patholog Microb 110: 372-378.
21. Unger R. 1991. Diabetic hyperglycemia: link to impaired glucose transport in pancreatic beta cells. Science 251: 1200-1205.
22. Wang H, Maechler P, Ritz-Laser B, Hagenfeldt K, Ishihara H, Philippe J, Wollheim C. 2001. Pdx1 level defines pancreatic gene expression pattern and cell lineage differentiation. J Biol Chem 276: 25279-25286.