Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.1 Lima 2012
Presencia de escherichia coli o157 en crías de alpacas (vicugna pacos)
Presence of escherichia coli o157 in young alpacas (vicugna pacos)
Elvis Silvera C.1, Rosa Perales C.1,6, Jorge Rodríguez B.4, Teresa López U.2, César Gavidia C.3, Juan Agapito P.5, César Palacios E.1
1 Laboratorio de Histología, Embriología y Patología Veterinaria,
2 Laboratorio de Microbiología y Parasitología Veterinaria,
3 Laboratorio de Medicina Veterinaria Preventiva, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
4 Unidad de Biotecnología Molecular, Universidad Peruana Cayetano Heredia, Lima
5 Laboratorio de Genómica, Instituto Peruano de Energía Nuclear, Lima
6 E-mail: rperales_fmv@hotmail.com
RESUMEN
El estudio tuvo como objetivo evaluar la presencia de E. coli O157 (gen rfb O157) en crías de alpacas (Vicugna pacos) con y sin diarrea, así como los genes que codifican la intimina (gen eae), toxina Shiga 1 (gen Stx1) y toxina Shiga 2 (gen Stx2). Se utilizaron cepas de E. coli provenientes de un ensayo previo realizado en Puno, Perú. Se evaluaron 55 y 52 cepas de E. coli provenientes de crías de alpacas con y sin diarrea. Las cepas fueron procesadas mediante la prueba de reacción en cadena de la polimerasa (PCR). Ambos grupos resultaron negativos a la presencia de E. coli O157. En el grupo de crías de alpacas sin diarrea, 7 cepas fueron positivas para el gen eae y 4 para Stx2. En el grupo de crías de alpacas con diarrea 2 cepas resultaron positivas para los genes eae y Stx1, 1 para eae y Stx2, 5 para eae, 1 para Stx1 y 5 para Stx2. El estudio no identificó la presencia del serogrupo E. coli O157; sin embargo, se identificó la presencia de los genes eae y Stx, lo que demuestra que esta especie doméstica podría estar actuando como reservorio de E. coli enterohemorrágica.
Palabras clave: Escherichia coli O157, toxina Shiga, intimina, alpaca, Vicugna pacos, rfb O157, eae, Stx, PCR
ABSTRACT
The study aimed to evaluate the presence of E. coli O157 (rfb O157 gene) in young alpacas (Vicugna pacos) with and without diarrhea, and the genes that codify their main factors of virulence such as intimin (eae gene), Shiga toxin 1 (gene Stx1) and Shiga toxin 2 (Stx2 gene). Strains of E. coli from a previous study in Puno, Peru were used. A total of 55 and 52 strains of E. coli from young alpacas with and without diarrhea respectively were used. Strains were processed by the polymerase chain reaction (PCR) technique. Both groups resulted negative for the presence of E. coli O157. In the group of alpacas without diarrhea, 7 strains were positive for the gene eae and 4 for Stx2. In the group of alpacas with diarrhea 2 strains were positive for the genes eae and Stx1, 1 for eae and Stx2, 5 for eae, 1 for Stx1 and 5 for Stx2. The survey did not identify the presence of serogroup E. coli O157; however identified the presence of Stx and eae genes which shows that this species might be acting as domestic reservoir of enterohaemorrhagic E. coli.
Key words: Escherichia coli O157, Shiga toxin, intimin, alpaca, Vicugna pacos, rfbO157, eae, Stx, PCR
INTRODUCCIÓN
Escherichia coli enterohemorrágica (EHEC) es un agente zoonótico emergente de gran impacto a nivel mundial (Armstrong et al., 1996) que causa serias enfermedades en el humano como la colitis hemorrágica (CH) y el síndrome urémico hemolítico (SUH). Dentro de esta especie se encuentra como serogrupo más importante la E. coli O157 debido a los serotipos O157:H7 y O157:H- (Griffin y Tauxe, 1991).
E. coli O157 se transmite por vía fecaloral y tiene una dosis infectiva muy baja (menos de 100 bacterias por gramo) (Karmali, 1989). Los vehículos más frecuentes para la infección humana son los alimentos y el agua (Tanaro et al., 2006), pero se ha demostrado la transmisión de persona a persona, la transmisión en el laboratorio y por contacto directo con animales (OIE, 2004).
El primer aislamiento de E. coli enterohemorrágica O157:H7 en el Perú se reportó en el 2001, en un lactante de 11 meses de edad con un cuadro de diarrea disentérica (Huapaya et al., 2001; Huguet et al., 2002). Estudios posteriores realizados en Lima demostraron la presencia de Escherichia coli O157:H7 en alimentos (Mora et al., 2007).
Los rumiantes son el reservorio de EHEC O157 (Armstrong et al., 1996), siendo el ganado bovino la principal especie implicada. Este serogrupo también ha sido aislado de varias especies de mamíferos, aves y animales silvestres (OIE, 2004). En camélidos sudamericanos solo se ha reportado la presencia de E. coli enterohemorrágica O26:H11 en un guanaco (Lama guanicoe) de dos meses de edad, que presentaba una severa diarrea acuosa (Mercado et al., 2004).
En el país se reportan numerosos casos de diarrea con sangre y SUH en humanos, cuadro clínico asociado a EHEC O157; sin embargo, no siempre se llega a la identificación del agente causal. Estos reportes sugieren la presencia de E. coli O157 en animales reservorios. El objetivo del presente estudio fue evaluar la posible presencia de E. coli O157 en muestras de heces de crías de alpaca (Vicugna pacos) con y sin diarrea, así como la caracterización genotípica de sus factores de virulencia.
MATERIALES Y MÉTODOS
Se trabajó con 112 cepas de E. coli de crías de alpacas con diarrea (56) y sin diarrea (56), cepas que provienen de un estudio realizado en el 2007 en la empresa EPS Rural Alianza-Macusani y Huaripiña, y comunidades cercanas, ubicadas en la provincia de Carabaya (4700 msnm), departamento de Puno. Las crías de alpacas eran de ambos sexos con edades entre 1 a 60 días.
Las cepas estuvieron conservadas a -20 ºC desde agosto del 2007, en el Laboratorio de Bacteriología de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, en un medio que contenía leche descremada, glicerol y triptona.
Se comprobó la viabilidad de las cepas almacenadas mediante su inoculación en Agar tripticasa soya (TSA), incubadas a 37 °C por 24 horas, y extracción del ADN de las colonias. El ADN genómico bacteriano se extrajo utilizando el Wizard genomic DNA purification kit (PROMEGA), siguiendo las instrucciones del fabricante. La calidad y cantidad del ADN se determinó mediante espectrofotometría. El ADN genómico aislado se colocó en tubos de microcentrífuga de 1.5 mL de capacidad y se almacenó a -20 °C hasta su procesamiento.
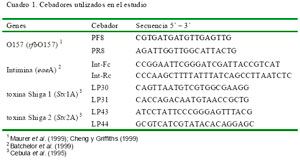
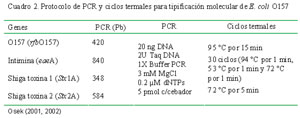
Mediante PCR se amplificó cuatro genes de E. coli O157 correspondientes a los genes rfb O157 (antígeno somático 0157), Stx1 (gen de la toxina Shiga 1), Stx2 (gen de la toxina Shiga 2) y eae (gen de la intimina). Los cebadores, las condiciones de PCR y los ciclos termales se detallan en los cuadro 1 y cuadro 2. La resolución de los fragmentos se hizo por electroforesis en gel de agarosa al 2% y se les visualizó mediante fluorescencia del bromuro de etidio a través de luz ultravioleta.
RESULTADOS
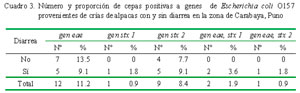
Se obtuvieron 107 cepas viables de las 112 disponibles, donde 55 y 52 correspondieron a cepas provenientes de crías de alpacas con y sin diarrea. La cantidad de ADN genómico obtenido a partir de 1 mL de cultivo varió entre 10.4 y 18.8 μg con una media de 16.8 μg. La pureza y calidad del ADN analizada a través de la proporción de absorbancia a 260/280 y 260/230 mostraron valores promedio de 1.8 (ADN puro) y 1.9 (ADN libre de contaminantes).
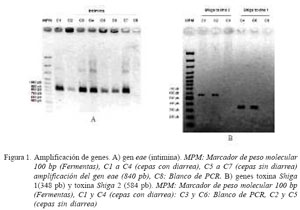
Los resultados expresados en proporción y cantidad de cepas que resultaron positivas se muestran en el Cuadro 3. El 11.2% de las 107 cepas presentaban el gen eae, de las cuales, siete correspondieron a cepas de alpacas sin diarrea (Fig. 1A). Asimismo, una cepa contenía el gene stx1 y nueve cepas el gen stx 2 (Fig. 1B). No se logró identificar la presencia del gen rfb O157.
DISCUSIÓN
Existen muy pocos reportes con respecto a la presencia de serogrupo E. coli O157 en alpacas. No se identificó la presencia del gen rfb O157 que codifica el antígeno somático O157 (E. coli O157) en cepas de crías de alpacas, aunque ha sido reportado en esta especie (VLA, 2009). En ese estudio, las alpacas compartían espacios con ovinos, equinos y cerdos que también resultaron positivos a E. coli O157, lo cual podría haber favorecido la diseminación de la E. coli O157 (Hancock et al., 2001; LeJeune et al., 2001; Davis et al., 2003).
En el Perú se ha identificado E. coli enterohemorrágica O157 proveniente de personas con diarrea sanguinolenta y síndrome urémico hemolítico (Huguet et al., 2002; MINSA, 2005). Además, se ha reportado la presencia de este serogrupo en alimentos en un estudio realizado en Lima (Mora et al., 2007); de allí la importancia de realizar estudios para identificar los reservorios animales.
El gen eae codifica una proteína de membrana externa llamada intimina que tiene como función la adherencia de la bacteria a la mucosa intestinal y esta asociado principalmente a la lesión de adhesión y borrado (AE: attaching and effacing) (Law, 2000). Ese gen se detectó en siete alpacas sin diarrea y cinco con diarrea, lo cual sugiere la presencia de otros grupos patógenos como la E. coli enteropatógena que también presenta el gen eae (Batchelor et al., 1999).
Huget et al. (2002) aislaron E. coli O157:H7 que no presentó ningún tipo de toxina Shiga, planteando la posibilidad de que estas cepas puedan haber portado en un primer momento el gen y posteriormente haberlo perdido, fenómeno similar al descrito por Feng et al. (2001). La toxina Shiga es el principal factor de virulencia de E. coli productor de toxina Shiga y de E. coli enterohemorrágica. Un estudio realizado por Arainga et al. (2008), en Huancavelica, con muestras de hisopados rectales de alpacas jóvenes con diarrea, reportó la presencia de Stx1 (57%) y Stx2 (60%) en proporciones mucho más altas que las del presente estudio.
La presencia del gen Stx2 en alpacas sin diarrea demuestra que esta especie está actuando como un reservorio de la E. coli productor de toxina Shiga; semejante a los roles desempeñados por el bovino, ovino, porcino y otras especies (OIE, 2004).
Es necesario resaltar la mayor proporción de Stx2 en comparación con Stx1, en los dos grupos de muestras, ya que las cepas de E. coli enterohemorrágica que presentaron la toxina Shiga 2 son más patógenas y producen un cuadro clínico más severo en humanos comparadas con las cepas que poseen toxina Shiga 1, y las cepas que poseen toxina Shiga 1 y 2 (Pickering et al., 1994).
CONCLUSIONES
-
No se identificó la presencia de Escherichia coli O157 en crías de alpacas (Vicugna pacos) en las cepas de E. coli provenientes de la Empresa EPS Rural Alianza.
-
Las alpacas son una fuente de E. coli que presentan los genes que codifican los principales factores de virulencia (eae y Stx) de la E. coli enterohemorrágica.
-
La identificación del gen eae demuestran que esta especie podría ser un reservorio asintomático de E. coli enteropatógena.
Agradecimientos
Los autores agradecen a la International Foundation for Science (IFS), por su apoyo en el financiamiento de este trabajo de investigación.
LITERATURA CITADA
1. Arainga MA, Taguchi T, Morales SM, Portilla KV, Villacaqui ER, Valencia N, Rivera H, Yamasaky S. 2008. Detección de genes de E. coli enterohemorrágica productora de toxina Stx1 y Stx2 en alpacas (Lama pacos) con diarrea. En: XIX Congreso Nacional de Ciencias Verinarias. Perú.
2. Armstrong GL, Hollingsworth J, Morris JG. 1996. Emerging food borne pathogens: Escherichia coli O157:H7 as a model of entry of a new pathogen into the food supply of the developed world. Epidemiol Rev 18(1): 29-51.
3. Batchelor MS, Knutton S, Capricoli AA, Hutter V, Zanial M, Dougen G, Frankel G. 1999. Development of a universal intimin antiserum and PCR primers. J Clin Microbiol 32: 3822-3827.
4. Cebula TW, Payne WI, Feng P. 1995. Simultaneous identification of strains of Escherichia coli serotype O157:H7 and their shiga-like toxin type by mismatch amplification mutation assay-multiplex PCR. J Clin Microbiol 33: 248-250.
5. Chen J, Griffiths MW. 1999. Cloning and sequencing of the gene encoding universal stress protein from Escherichia coli O157:H7 isolated from Jack-in-a- Box outbreak. Lett Appl Microbiol 29(2): 103-107.
6. Davis MA, Hancock DD, Rice DH, Call DR, DiGiacomo R, Samadpour M, Besser TE. 2003. Feedstuffs as a vehicle of cattle exposure to Escherichia coli O157:H7 and Salmonella enterica. Vet Microbiol 95: 199-210.
7. Feng P, Dey M, Abe A, Takeda T. 2001. Isogenic strain of Escherichia coli O157:H7 that has lost both Shiga toxin 1 and 2 genes. Clin Diagn Lab Immunol 8: 711-717.
8. Griffin PM, Tauxe RV. 1991. The epidemiology of infections caused by Escherichia coli O157:H7, other enterohemorrhagic E. coli, and the associated hemolytic uremic syndrome. Epidemiol Rev 13: 60-98.
9. Hancock D, Besser T, LeJeune J, Davis M, Rice D. 2001. The control of VTEC in the animal reservoir. Int J Food Microbiol 66: 71-78.
10. Huapaya B, Huguet J, Suárez V, Torres Y, Montoya Y, Salazar E, Torres Y, et al. 2001. Primer aislamiento de Escherichia coli O157:H7 enterohemorágica en el Peú. Rev Med Exp 18(1-2): 38-39.
11. Huguet J, Huapaya B, Salazar E. 2002. Determinación de factores de virulencia asociados a Escherichia coli enterohemorrágica en cepas peruanas aisladas entre 1999-2001. Rev Med Exp Salud Pública 19(2): 63-67.
12. Karmali MA. 1989. Infection by verocytotoxin-producing Escherichia coli. Clin Microbiol Rev 2: 15-38.
13. Law D. 2000. Virulence factors of Escherichia coli O157 and other Shiga Toxin-producing E. coli. J Appl Microbiol 88: 729-745.
14. LeJeune J, Besser TE, Hancock DD. 2001. Cattle water troughs as reservoirs of Escherichia coli O157. Appl Environ Microbiol 67: 3053-3057.
15. Maurer JJ, Schmidt D, Petrosko P, Sanchez S, Bolton L, Lee MD. 1999. Development of primers to O-antigen biosynthesis genes for specific detection of Escherichia coli O157 by PCR. Appl Environ Microbiol 65: 2954-2960.
16. Mercado EC, Rodríguez SM, Elizondo AM, Marcoppido G, Parreño V. 2004. Isolation of shiga toxin-producin Escherichia coli from a South American camelid (Lama guanicoe) with diarrhea. J Clin Microbiol 42: 4809-4811.
17. [MINSA] Ministerio de Salud. 2005. Etiología de la diarrea con sangre en poblaciones de zonas de riesgo E. coli Enterohemorrágica (ECEH) y otras E. coli Shigatoxina (STEC). Perú: Ministerio de Salud. Serie Informes Técnicos Nº 85.
18. Mora A, León S, Blanco M, Blanco JE, López C, Dahbi G, Echeita A, et al. 2007. Phage types, virulence genes and PFGE profiles of Shiga toxinproducing Escherichia coli O157:H7 isolated from raw beef, soft cheese and vegetables en Lima (Perú). Int J Food Microbiol 114: 204-210.
19. [OIE] Organización Mundial de Sanidad Animal. 2004. Escherichia coli verotoxigénica. Manual de la OIE sobre animals terrestres. Cap. 2.10.13. [Internet], [13 marzo 2009]. Disponible: www.oie.int/esp/normes/mmanual/pdf_es/2.10.13_Escherichia_coli_verociotoxigenica_ruth.pdf
20. Osek J. 2001. Multiplex polymerase chain reaction assay for identification of enterotoxigenic Escherichia coli strains. J Vet Diagn Invest 13: 308-311.
21. Osek J. 2002. Rapid and specific identification of shiga toxin producing Escherichia coli in faeces by multiplex pcr. Lett Appl Microbiol 34: 304-310.
22. Tanaro J, Lound L, Domínguez M. 2006. Detección de Escherichia coli O157:H7 en aguas abiertas, heces y rumen de bovinos en las proximidades del casco urbano. Ciencia, Docencia y Tecnologia 32: 207-218 p.
23. Pickering LK, Obrig TG, Stapleton FB. 1994. Hemolytic-uremic syndrome and enterohemorrhagic Escherichia coli. Pediatr Infect Dis J 13: 459-476.
24. [VLA] Veterinary Laboratories Agency. 2009. Non-Statutory Zoonoses. Quarterly Report July – September. [Internet], [28 abril 2009]. Disponible en: www.defra.gov.uk/vla/reports/docs/rep_zoo0308.pdf