Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.1 Lima 2012
COMUNICACIÓN
Harina de yacón (smallanthus sonchifolius) como prebiótico en dietas de patos muscovy (cairina moschata) en etapa de engorde
Yacon meal (smallanthus sonchifolius) as prebiotic in rations of muscovy (cairina moschata) ducks during the fattening phase
Nadia Fuentes N.1, Edgardo Figueroa T.1.3, Fernando Carcelén C.2, Teresa Arbaiza F.2
1 Laboratorio de Producción Avícola y Especies Menores,
2 Laboratorio de Bioquímica, Nutrición y Alimentación Animal, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
3 E-mail: edgardoft@gmail.com
RESUMEN
El objetivo del presente trabajo fue evaluar el efecto de la harina de yacón como prebiótico en el engorde de patos Muscovy. Se emplearon 150 patos machos de siete semanas de edad, agrupados en cinco tratamientos: T0, control (sin yacón, sin antibiótico); T1, zinc bacitracina 0.035%; T2, T3 y T4, harina de yacón al 0.25, 0.50 y 0.75, respectivamente. Los tratamientos T1, T3 y T4 obtuvieron mayores ganancias de peso que el T0 (p<0.05). No se observó diferencias entre tratamientos en relación al consumo de alimento. El índice de conversión alimenticia (ICA) fue mejor en T1, T3 y T4 en relación a T0 (p<0.05). El costo de alimento por unidad de peso vivo ganado fue más bajo en T1, T2, T3, T4 frente a T0. Se concluye que la inclusión de 0.75% de harina de yacón en la ración podría ser a una alternativa al uso del antibiótico promotor de crecimiento en la dieta de patos en la etapa de engorde.
Palabras clave: yacón, prebiótico, engorde, pato
ABSTRACT
The purpose of the study was to evaluate the effect of yacon meal as a prebiotic in rations for Muscovy ducks. One hundred and fifty male ducks of seven weeks of age were used. The ducks were grouped in five treatments: T0, control (without yacon and antibiotic); T1, zinc bacitracin 0.035%; T2, T3 and T4, yacon meal at 0.25, 0.50 and 0.75% respectively. Treatments T1, T2 and T4 resulted in higher body weight gain as compared to T0 (p<0.05). No differences were observed between treated groups and T0 on feed consumption. Feed conversion index was significantly better in T1, T3 and T4 as compared to T0 (p<0.05). The cost of feed per unit of body weight gain was lower in T1, T2, T3 and T4 as compared to T0. The inclusion of 0.75% of yacon meal in the diet would be an alternative to the use of antibiotics in rations of ducks during the fattening phase.
Key words: yacon, prebiotic, fattening, duck
INTRODUCCIÓN
Existe una constante preocupación sobre los patógenos que se transmiten desde los animales de consumo hacia la población. La mayoría de los intentos por controlar la flora microbiana de las aves se ha realizado en base a antibióticos de amplio espectro, pero la controversia sobre su efecto en el hombre a través de la carne de aves ha conducido a su prohibición en varios países (Patterson y Burkholder, 2003). Como alternativas para la sustitución de antibióticos promotores de crecimiento (APC) se vienen empleando los prebióticos (fibra dietética y oligosacáridos); componentes que escapan de la digestión del hospedero pero que se encuentran disponibles para el metabolismo de los microorganismos benéficos, conduciendo a una mejora en los parámetros productivos de los animales de consumo (Gibson y Roberfroid, 1995; Apajalahti y Kettunen, 2002) y disminución de riesgo para la salud humana y animal.
Entre los prebióticos más importantes se encuentran los productos de los fructooligosacáridos (FOS), oligofructosa e inulina (Monsan y Paul, 1995). Estos productos son resistentes a la acción de las enzimas del intestino y del páncreas y, por lo tanto, no son degradados a nivel del estómago ni del intestino delgado (Niness, 1999); sin embargo, las bacterias gram negativas del colon logran sintetizar una serie de enzimas sacarolíticas que los pueden metabolizar. Dicho proceso fermentativo es efectuado principalmente por bacterias lácticas, bifidobacterias, y ciertas bacterias productoras de butirato (Hold et al., 2003), produciendo una disminución de pH por efecto de los productos generados (ácidos carboxílicos, lactato y acetato entre otros), lo que a su vez, ocasiona una alta mortalidad de patógenos intestinales sensibles a la acidificación, tales como Salmonella typhimurium, S. enteritidis, S. aereus, E. coli, Clostridium perfringens, Campylobacter jejuni, Shigella sp y Clostridium difficile (Perrin, 2001), disminuyendo sus posibilidades de colonización (Gibson y Roberfroid, 1995; Manrique, 2003).
Los oligosacáridos han sido extensamente estudiados por la habilidad que tienen de mejorar la salud y el rendimiento productivo de las aves (Patterson y Burkholder, 2003). Catala et al. (1999), determinaron que con el uso de oligofructosa y lactosa en la dieta de codornices se alcanzaron altas concentraciones de bifidobacterias y reducción de E. coli asociada a enterocolitis necrotizante. Chen et al. (2005), utilizaron la achicoria como fuente de oligofructosa e inulina en la dieta de gallinas Leghorn blanca, en dosis de 1.0 y 1.3%, obteniendo un incremento de la producción semanal de huevo en un 13.4 y 10.7%, respectivamente, sin afectar las cualidades del huevo; mientras que Li et al. (2007), mejoraron la producción de huevos, consumo y conversión alimenticia en gallinas de postura Lohmann Brown a través del consumo de 2 g/kg de fructooligosacáridos en la dieta.
El yacón (Smallanthus sonchifolius) es una planta altoandina, a cuyas raíces se atribuyen propiedades beneficiosas para la flora microbiana debido a su alto contenido de fructooligosacáridos (Seminario et al., 2003). El yacón y plantas relacionadas fue ron originalmente clasificadas bajo el género de Polymnia (Asteraceae, Heliantheae, Melampodinae); sin embargo, el género Smallanthus (Asteraceae, Heliantheae) fue redescubierto por Robinson en 1978 con otras 21 especies (Grau y Rea, 1997). Las raíces del yacón contienen entre 10 y 14% de materia seca, y cerca del 90% de carbohidratos en base seca, donde el 50 a 70% son fructooligosacaridos (Ohyama et al., 1990; Nieto, 1991). Al yacón se le han atribuido efectos benéficos a nivel gastrointestinal, en la mejora de la flora microbiana previniendo infecciones intestinales, así como mejoras en la absorción de calcio y otros minerales, síntesis de vitaminas del complejo B, y fortalecimiento de la respuesta del sistema inmunológico (Roberfroid, 1999).
El pato Muscovy (Cairina moschata) es un ave de crianza tradicional, que se inclina hacia una crianza intensiva en el país, donde ya se ha iniciado el empleo de líneas mejoradas (Comotto, 2003). Esta ave se caracteriza, además, por su capacidad de crecimiento compensatorio en la última etapa de crianza (Lázaro et al., 2004). Se han realizado pocos trabajos sobre el uso de sustitutos de antibióticos en esta especie, por lo que se llevó a cabo el presente estudio a fin de evaluar el desempeño del pato Muscovy sometido a dietas con harina de yacón como aditivo en la etapa de engorde.
MATERIALES Y MÉTODOS
El estudio se realizó en el galpón de aves del Laboratorio de Producción Avícola y Especies Menores de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima, Perú. Se trabajó con 150 patos Muscovy, línea francesa, machos, de 49 días de edad, que se asignaron al azar en cinco tratamientos de 30 patos cada uno, donde cada tratamiento tuvo cinco unidades experimentales compuesta de seis patos. Cada unidad experimental estuvo en un corral provisto de bebedero automático y comedero tipo tolva.
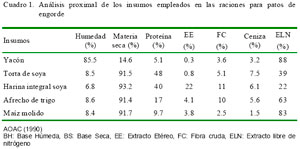
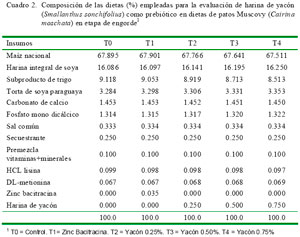
En la ración se empleó maíz nacional molido, torta de soya, harina integral de soya, afrecho y yacón. Cada insumo fue sometido a un análisis químico proximal previo al experimento (AOAC, 1990) (Cuadro 1). La dieta se formuló con el programa Z-Mix, de acuerdo a los requerimientos nutricionales en la etapa de engorde para patos (Lázaro et al., 2004).
El estudio se llevó a cabo durante las cuatro últimas semanas de la etapa de engorde, dentro de las cuales se considera una semana previa para el acondicionamiento de los animales al alimento. El peso inicial del estudio, a la 7° semana para los tratamientos T0, T1, T2, T3 y T4 fue de 2.817, 2.838, 2.751, 2.854 y 2.788 kg, sin haber diferencia estadística entre grupos.
Los tratamientos (Cuadro 2) fueron T0, control (sin antibiótico, sin harina de yacón); T1, antibiótico (zinc bacitracina 0.035%); T2, harina de yacón (0.25%); T3, harina de yacón (0.50%); y T4, harina de yacón (0.75%). Se evaluó la ganancia de peso, consumo de alimento, índice de conversión alimenticia (ICA), y costo de alimentación por unidad de peso vivo producido. La primera semana del estudio fue de acondicionamiento al alimento.
Para el análisis estadístico se empleó un diseño completamente al azar, empleándose el análisis de varianza para determinar diferencias entre grupos, y la prueba de Duncan para determinar diferencias entre promedios. Las variables cuantitativas se presentan como promedio y desviación estándar. Se utilizó el paquete estadístico SPSS 13.0®.
RESULTADOS Y DISCUSIÓN
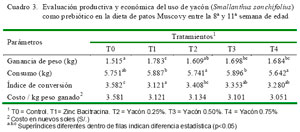
Los resultados de estudio se resumen en el Cuadro 3. Los grupos T1, T3 y T4 obtuvieron incrementos de peso en 17.7, 12.1 y 11.2%, respectivamente frente a T0 (p<0.05), mientras que el leve incremento de peso del T2 no fue estadísticamente diferente a T0. En el caso de T1, la presencia del antibiótico actuaría modificando cuantitativa y cualitativamente la flora microbiana, conduciendo a una disminución de los microorganismos causantes de enfermedades subclínicas; asimismo, se reduce la flora normal que compite con el hospedero por los nutrientes, conduciendo a una mejora en el comportamiento productivo (Torres y Zarazaga, 2002). Además, el empleo de antibióticos promotores de crecimiento produce cambios en la morfología de las vellosidades intestinales, lo cual favorecería a la absorción de los nutrientes (Miles, 2006).
Por otro lado, el incremento de peso en los casos de T3 y T4 se debería a la presencia de fructooligosacáridos. Sin embargo el efecto de la dosis puede verse afectado por la especie, edad, y condiciones climáticas, entre otros, como en el caso de estudios en broilers realizado por Shan y Wang (2002), quienes no hallaron diferencia en la ganancia del peso al emplear fructooligosacaridos al 1.5% en comparación con el uso de zinc bacitracina.
El consumo de alimento no fue afectado por la incorporación de yacón en la dieta, dado que fue similar al consumo del grupo control.
El índice de conversión alimenticia, relación entre el consumo de alimento y la ganancia de peso, fue similar entre el grupo control (3.582 ± 0.3l) y el T2 (3.408 ± 0.26); sin embargo los grupos T1, T3 y T4 (3.121 ± 0.11, 3.353 ± 0.08 y 3.280 ± 0.15) presentaron mejores índices de conversión respecto a T0 (3.582 ± 0.23) (p<0.05). El relativo mejor nivel de conversión en T1 se atribuye al efecto de promotor de crecimiento del antibiótico, que contribuye a una mejor asimilación del alimento; sin embargo, en otro estudio con yacón en pollos de carne no se encontró diferencias entre yacón y zinc bacitracina (Cieza y Del Carpio, 2003).
Los resultados observados para los grupos T3 y T4 pueden estar relacionados a la acción del yacón, como fuente de FOS, sobre la flora bacteriana (Xu y Xia, 2003), ya que ocurre un aumento de bifidobacterias y Lactobacillus ocasionando un descenso del pH (Hold et al., 2003), que ocasiona una inhibición de Escherichia coli y otras bacterias patógenas a nivel de intestino delgado y ciegos. El descenso del pH en íleo y ciegos se observó en pavos BUT (British United Turkeys) con el uso de FOS (0.5, 1 y 2%) (Juskiewicz et al., 2006).
La proporción de yacón empleada en T2 no presentó una respuesta significativa en términos de ganancia de peso, pero esto podría estar relacionado al tiempo de empleo, de modo que habría que evaluarlo durante toda la etapa de engorde. Un estudio en pollos de carne donde se empleó 0.25% de yacón durante toda la campaña obtuvo resultados similares al uso de zinc bacitracina (Cieza y Del Carpio, 2003).
El costo de alimento por unidad de peso vivo producido fue inferior en los grupos tratados en comparación con el grupo control, y bastantes similares entre los grupos de yacón con el de zinc bacitracina. Estos resultados indican que se podría usar la harina de yacón como alternativa al antibiótico. Cabe considerar que el precio en el mercado de la harina de yacón es elevado debido a una producción en baja escala como planta medicinal; sin embargo, se podría promocionar su cultivo a mayor escala como promotor de crecimiento en la producción animal en reemplazo de antibióticos, con el fin de disminuir la ocurrencia de bacterias resistentes.
Los resultados de índice de conversión en los grupos T3 y T4 podrían ser empleados como alternativas al promotor de crecimiento; sin embargo desde el punto vista económico y considerando crianzas a gran escala, los valores de T4 son relevantes, ya que las mejoras en el índice de conversión implican una disminución en la cantidad de alimento por unidad de producto final (carne), y en consecuencia, una reducción en los costos de producción.
CONCLUSIÓN
Se concluye que la dosis de harina de yacón al 0.75% puede ser empleada como alternativa al uso de zinc bacitracina en la ración de patos Muscovy en la etapa de engorde.
LITERATURA CITADA
1. [AOAC] Association of Official Analytical Chemists. 1990. Official methods of analysis. 15th ed. Arlington: AOAC. 1230 p.
2. Apajalahti J. Kettunen A. 2002. Efecto de la dieta sobre la flora microbiana en el tracto gastrointestinal de aves. En: XVII Curso de Especialización FEDNA. Barcelona.
3. Catala I, Butel M, Bensaada M, Popot F, Tessedre A, Rimbault A, Szylit, O. 1999. Oligofructose contributes to the protective role of bifidobacteria in experimental necrotising enterocolitis in quails. J Med Microbiol 48: 89-94.
4. Cieza N, Del Carpio E. 2003. Sustitución del antibiótico promotor del crecimiento por el llacón (Smallanthus sonchifolius) en raciones de pollos de carne. Tesis de pregrado. Lambayeque, Perú: Facultad de Zootecnia, Universidad Nacional Pedro Ruiz Gallo. 66 p.
5. Chen YC, Nakthong C, Chen TC. 2005. Improvement of laying hen performance by dietary prebiotic chicory oligofructose and inulin. International J Poultry Sci 4: 103-108
6. Comotto G. 2003. Pato criollo: un interesante sistema de engorde. Agroenfoque 138: 72-74.
7. Gibson GR, Roberfroid MB. 1995. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotic. J Nutr 125: 1401-1412.
8. Grau A, Rea J. 1997. Yacon, Smallanthus sonchifloius (Poepp. & Endl) H. Robinson. In: Hermann M, Heller J (eds). Andean roots and tubers: Ahipa, arracacha, maca and yacon. Rome: IPK and IGRPI. p 200-242.
9. Hold GL, Schwietz A, Aminov RI, Blaut M. 2003. Oligonucleotides probes that detect quantitatively significant groups of butyrate-producing bacteria in human feces. Appl Environ Microbiol 69: 4320-4324.
10. Juskiewicz J, Jankowski J, Zdunczyk Z. 2006. Performance and gastro-intestinal tract metabolism of turkeys fed diets with different contents of fructooligosaccharides. Poultry Sci 85: 886-891.
11. Lázaro R, Vicente B, Capdevilla J. 2004. Nutrición y alimentación de avicultura complementaria: Patos. En: XX Curso de especialización FEDNA. Barcelona.
12. Li X, Liu L, Li K, Hao K. 2007. Effect of fructooligosaccharides and antibiotics on laying performance of chickens and cholesterol content of egg yolk. Br Poult Sci 48: 185-189.
13. Manrique I, Herman M. 2003. El potencial del yacón en la salud y nutrición. En: XI Congreso de Internacional de Cultivos Andinos. Cochabamba, Bolivia.
14. Miles R. 2006. Effect of antibiotic growth promoters on broiler performance, intestinal growth parameters, and quantitative morphology. Poultry Sci 85: 476-485.
15. Monsan P, Paul F. 1995. Oligosaccharide feed additives. In: Biotechnology in animal feed and animal feeding. New York: Ed VCH. p 233-245.
16. Nieto C. 1991. Estudio agronómico y bromatológico en jicama (Polimnia sonchifolia). Arch Latinoam Nutr 41: 213-221.
17. Niness K. 1999. Breakfast foods and the health benefits of inulin and oligofructose. Cereal Foods World 44: 79-81.
18. Ohyama T, Ito O, Yasuyoshi S. 1990. Composition of storage carbohydrate in tubers of yacón (Polymnia sonchifolia). Soil Sci Plant Nutr 36: 167-171.
19. Patterson JA, Burkholder KM. 2003. Application of prebiotics and probiotics in poultry production. Poultry Sci 82: 627-631.
20. Perrin S, Wharchol M, Grill J. 2001. Fermentations of fructooligosaccharides and their components by Bifidobacterium infantis ATCC 15697 on batch culture in semi synthetic medium. J Applied Microbiol 90: 859-865.
21. Roberfroid M. 1999. Concept in functional foods: The case of inulin and oligofructose. J Nutrit 129: 198-1401
22. Seminario J, Valderrama M, Manrique I. 2003. El yacón. Fundamentos para el aprovechamiento de un recurso promisorio. Lima: CIP-UNCCOSUDE. 60 p.
23. Shan A, Wang L. 2002. Effects of fructooligosaccharides compared with direct-fed microbial bacteria, and zinc bacitracin on cecal microbial populations and performance of broilers. J NE Agric Univ 9: 42-48.
24. Torres C, Zarazaga M. 2002. Antibióticos como promotores del crecimiento en animales. ¿Vamos por el buen camino? Gaceta Sanit 16(2): 109-112.
25. Xu Ch, Xia M. 2003. Effects of dietary fructooligosaccharide on digestive enzyme activities, intestinal microflora and morphology of male broilers. Poultry Sci 82: 1030-1036.