Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.2 Lima abril./jun 2012
IDENTIFICACIÓN INMUNOHISTOQUÍMICA DE TRANSPORTADORES DE GLUCOSA INTESTINAL Y ABSORCIÓN DE GLUCOSA DURANTE EL DESARROLLO Y MADURACIÓN DEL INTESTINO DELGADO DE CRÍAS DE ALPACAS
IMMUNOHISTOCHEMICAL IDENTIFICATION OF INTESTINAL GLUCOSE TRANSPORTERS AND GLUCOSE UPTAKE DURING DEVELOPMENT AND MATURATION OF THE SMALL INTESTINE OF BABY ALPACAS
José Rodríguez G.1,3, Sergio Cueva M.1, Boris Lira M.1, Juan Espinoza B.2, María Vásquez C.1
1 Laboratorio de Fisiología Animal, 2 Laboratorio de Farmacología y Toxicología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
3 E-mail: joserodriguezmv@gmail.com
RESUMEN
Fallas en los procesos absortivos de monosacáridos a nivel intestinal en la etapa postnatal temprana, a través de transportadores de glucosa SGLT-1 y GLUT-2, pueden conducir a la muerte del animal. El presente estudio se planteó con el objetivo de identificar la distribución de transportadores de hexosas SGLT-1 y GLUT-2 en el eje cripta-vellosidad de la mucosa del intestino y su relación con los niveles de glucemia en crías de alpacas. Se utilizaron 36 animales de 1 a 45 días de edad. La glucemia se determinó por análisis enzimático y la presencia de transportadores mediante inmunohistoquímica, para lo cual se usó anticuerpos policlonales de conejo anti SGLT- 1 y anti GLUT-2. La intensidad de la marcación (0: sin marcación; 1: marcación leve; 2: marcación fuerte) se observó en el eje cripta-vellosidad. Los resultados muestran una marcación generalmente leve (grado 1) desde el primer día de edad para los dos transportadores, tornándose fuerte (grado 2) hacia la semana 2, especialmente en la zona apical del eje a nivel de yeyuno. Además, SGLT-1 tuvo una marcación de mayor valor que GLUT-2 en todas las porciones del intestino, indistintamente de la edad. Los niveles de glucemia variaron de 150 mg/dL (día 1) a 176 mg/dL (semana 5), con diferencia significativa (p<0.05) entre los animales recién nacidos y crías de 3 a 5 semanas. Se concluye que SGLT-1 y GLUT-2 están presentes desde el nacimiento, lo que está relacionado a los altos niveles de glucemia en esa etapa; asimismo, se destaca la mayor presencia de los transportadores en el yeyuno, especialmente SGLT-1.
Palabras clave: alpaca, intestino delgado, SGLT-1, GLUT-2, glucosa, inmunohistoquímica
ABSTRACT
Failures in the absorptive process of monosaccharides during the early postnatal phase at intestinal level, through SGLT-1 and GLUT-2 glucose transporters could lead to animal death. The objective of this study was to determine the hexose transporters SGLT- 1 and GLUT-2 distribution in the gut and its relation with blood glucose levels in baby alpacas. A total of 36 alpacas between 1 to 45 days of age were used. Blood glucose level was determined by enzymatic test and the presence of transporters by immunohistochemistry, using rabbit policlonal antibody anti SGLT-1 and anti GLUT-2. The intensity of the dial (0: no dial, 1; mild dial; 2: strong dial) was evaluated in the axis villus-crypt. The results showed mostly mild dial (degree 1) from the day of birth for the two transporters towards strong (degree 2) by week 2, especially at the jejunum. In addition, SGLT-1 had a greater degree of dial than GLUT-2 in all portions of the intestine at all ages. The blood glucose levels varied from 150 mg/ dL (day 1) to 176 mg / dL (week 5), with significant differences between day of birth and animals at 3 to 5 weeks of age (p<0.05). It is concluded that SGLT1 and GLUT2 are present from birth and this is related to high blood glucose levels at this stage; moreover, the largest presence of these transporters occurs in the jejunum, especially SGLT-1.
Key words: alpaca, small intestine, SGLT-1, GLUT-2, glucose, immunohistochemistry
INTRODUCCIÓN
La alpaca, así como otras especies animales en la etapa de lactación, es susceptible de sufrir trastornos metabólicos, incluyendo fallas en los procesos absortivos de carbohidratos a nivel intestinal, que pueden ocasionar la muerte del animal. Estos procesos son muy importantes en la etapa neonatal de la alpaca.
El desarrollo de la mucosa y del sistema inmune intestinal depende del alimento consumido y de su calidad nutricional, así como de la implantación de la flora bacteriana en los primeros días de vida (Sklan, 2000; Ogra y Welliver, 2008). Las crías de la mayoría de especies de animales de producción nace con enterocitos inmaduros, impidiendo una adecuada absorción de nutrientes. El proceso de absorción de macromoléculas por endocitosis es el más afectado, y en menor grado, la pasiva absorción de nutrientes y el transporte dependiente del gradiente de concentración, tal como el de los ácidos grasos y de monosacáridos. Este último es el más importante en la etapa neontal, debido a que la glucosa aporta los requerimientos energéticos al neonato haciéndolo capaz de adaptarse a su nuevo ambiente (Buddington et al., 2001). Por otro lado, el ayuno y la exposición a patógenos causa una disminución en el crecimiento de las vellosidades intestinales, favoreciendo el predominio de enterocitos inmaduros, lo cual hace que el animal sea más susceptible a infecciones de microorganismos patógenos (Sauter et al., 2004).
Los carbohidratos son sustancias químicas orgánicas de amplia distribución en la naturaleza. Las hexosas como la glucosa, galactosa y fructosa cumplen funciones importantes en las células eucarióticas; siendo la glucosa, la principal fuente de energía que utiliza la célula para poder llevar a cabo importantes funciones como la oxidación y el almacenaje. La glucosa debe ingresar al interior de la célula para incorporarse a la vía metabólica que predomine según las condiciones hormonales y energéticas del momento. Estas moléculas son incapaces de difundir directamente a través de las membranas celulares por lo que requieren proteínas trans portadoras especializadas para entrar al interior de la célula. Dichas biomoléculas transportadoras pertenecen a un grupo constituido por dos familias de proteínas: la familia de los GLUT (Facilitador del Transporte de Glucosa) y la familia de los SGLT (Transportador de glucosa acoplado a Na+) (Barrett et al., 1999; Zierler, 1999; Scheepers et al., 2004; Kellet et al., 2008).
El enterocito, por su parte, solamente puede absorber monosacáridos, glucosa, galactosa y fructosa. La glucosa y galactosa se absorben mediante transporte activo dependiente de sodio. La proteína transportadora llamada SGLT-1 transporta una molécula de glucosa, otra de galactosa y dos de sodio. El transporte de fructosa es independiente y lo hace mediante difusión facilitada a través de la proteína transportadora GLUT-5. Las tres moléculas, glucosa, galactosa y fructosa, atraviesan la membrana del enterocito a través de una proteína transportadora, GLUT-2, mediante difusión facilitada, aunque algunas también lo hacen mediante difusión simple (Martínez de Victoria et al., 2005). En los mamíferos, la regulación de la concentración del azúcar en la sangre es esencial para el organismo, ya que estados de hiperglucemia o hipoglucemia extremos pueden ser críticos para la supervivencia. En los mamíferos en general, la regulación de la concentración de glucosa se realiza mediante un equilibrio entre el flujo de glucosa dentro y fuera del espacio extracelular a través de la secreción coordinada de insulina y el glucagón (Unger, 1991; DeFronzo, 1997).
Existen escasos estudios en el desarrollo funcional del tracto intestinal de las crías de alpacas, especialmente en la parte absortiva de sustancias como la glucosa; y es aquí donde se presenta la mayor incidencia de patologías en los primeros 45 días de edad causando hasta un 80% de mortalidad. Por tal motivo, el presente estudio tuvo como objetivo demostrar la presencia de transportadores de glucosa en el epitelio intestinal de crías de alpacas y su relación con los niveles de glucosa sérica.
MATERIALES Y MÉTODOS
Lugar de Ejecución
El estudio se llevó a cabo en comunidades alpaqueras de los departamentos de Puno y Cusco, a una altitud mayor a los 3800 msnm. El procesamiento de muestras y resultados se realizó en el Laboratorio de Fisiología Animal de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima.
Animales y Muestras
Se utilizaron 36 crías de alpacas, aparentemente sanas, comprendidas entre 1 a 45 días de edad y criadas bajo las mismas condiciones de manejo y alimentación. La edad se determinó a través de los registros existentes en cada localidad. Se consideró los siguientes grupos etarios: 0 (1 día de edad), 1, 2, 3, 4, 5, 6 y 7 semanas de edad.
Las crías fueron parte de los animales que los comuneros consideraron como saca para consumo humano. El manejo y sacrificio de los animales se realizó siguiendo los Principios Directrices Internacionales para la Investigación Biomédica que implique el Uso de Animales del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS), Ginebra, 1985.
Las muestras de sangre se colectaron a las 06:00 h aproximadamente, con los animales en ayuno de 12 horas, mediante punción de la vena yugular. La sangre colectada en vacutainers se dejó reposar para la obtención de suero. Luego, los animales fueron inmovilizados y sacrificados por sobredosis de pentobarbital sódico al 6.5%, vía vena yugular.
Determinación de Glucosa Sanguínea
La determinación de la glucemia se realizó con un kit comercial de glicemia enzimática (Wienner Lab, Argentina) (Ziegenhorn et al., 1977). La comparación de los valores de la glucemia con la edad se hizo mediante la prueba de análisis de varianza de una sola vía con un nivel de confianza del 95%.
Inmunohistoquímica en Muestras Intestinales
Una vez sacrificado el animal, se colocó en posición decúbito dorsal y se realizó un corte a nivel de la línea media del abdomen desde la región xifoidea hacia la parte anterior del pubis. Se seccionó la pared abdominal mediante cortes transversales desde la región umbilical hacia los lados derecho e izquierdo, entre el arco costal y la protuberancia pélvica, y se removió el omento mayor de su inserción natural. El intestino delgado fue dividido en sus tres porciones: duodeno, yeyuno e íleon. De cada porción se tomó una muestra de intestino de 3 cm, que fue colocada en frascos con formol tamponado al 10% (Martoja y Martoja, 1970).
Las muestras fueron incluidas en parafina. Se preparó dos láminas por muestra y se hicieron cortes de 5 μm de espesor, que fueron colocados en láminas portaobjetos embebidas en Poly-L-lysina (P8920, Sigma- Aldrich). Luego, se desparafinaron a través de alcoholes en niveles decrecientes e incubados con H2O2 en metanol por 30 min a temperatura ambiente para inhibir la actividad de la peroxidasa endógena. Posteriormente, las láminas fueron lavadas dos veces con solución salina tamponada con fosfato (PBS) y expuestas a recuperación antigénica en microondas usando solución buffer citrato a pH 6.0 (Taylor et al., 1996; Zanuzzi et al., 2010). Las láminas fueron incubadas con albúmina de suero bovino (BSA) al 1% en PBS por 30 min.
Un grupo de láminas fue incubado con el anticuerpo policlonal biotinilado de conejo anti SGLT-1 (Millipore, Temecula, California, EEUU), diluido a una concentración de 1:50 (Hwang et al., 1991) y el otro grupo de láminas fue incubado con el anticuerpo policlonal biotilinado de conejo anti GLUT-2 (Santa Cruz Biotechnology, INC, Santa Cruz, California, EEUU) (Eisenberg et al., 2005), diluido a una concentración de 1:50. Ambos grupos de láminas fueron incubadas por toda la noche. Como sistema de detección se usó el sistema ABC de conejo (Santa Cruz Biotechnology, INC, Santa Cruz, California, EEUU) por 30 min, luego se lavaron las láminas con PBS y fueron reveladas con DAB incubando entre 1 a 2 min. La coloración de contraste se hizo con Hematoxilina de Harris. La reacción positiva del DAB fue observada mediante la coloración marrón oscuro. Los controles positivos fueron en riñón de ratón y alpaca.
Análisis de Imágenes
Las láminas fueron leídas usando un microscopio trinocular (modelo Primo Star, Carl Zeiss, Alemania) para exámenes en campo claro en luz transmitida con un ocular WF 10x/20, objetivos de 10x y 40x, adicionado con cámara digital (Canon Powershot G9, 12 megapixels, Japón).
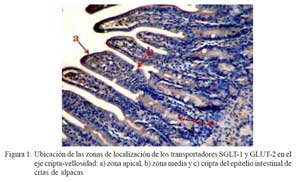
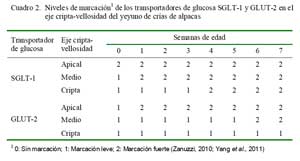
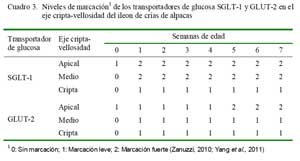
El estudio consistió en la marcación específica de SGLT-1 y GLUT-2 en el eje cripta- vellosidad del intestino delgado, para lo cual se dividió al eje en tres zonas de estudio: zona apical, zona media y cripta (Fig. 1) (Yang et al., 2011). La intensidad de la marcación se clasificó como 0) sin marcación; 1) marcación leve; y 2) marcación fuerte (Zanuzzi, 2010; Yang et al., 2011). De cada porción de intestino delgado de cada animal se analizaron 10 campos donde se identificó los ejes cripta-vellosidad y se realizó la identificación de la marcación.
RESULTADOS
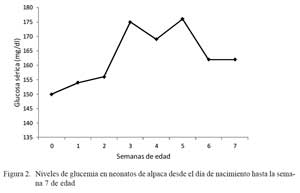
Los niveles de glucosa en sangre al nacimiento fueron de 150 ± 10 mg/dL, aumentaron hasta 175 ± 7 mg/dL en la semana 3 (p<0.05), para mantenerse constante hasta la semana 5 (176 ± 13 mg/dL), donde disminuyeron a niveles de 162 ± 12 mg/dL en la semana 6 (p<0.05) (Fig. 2)
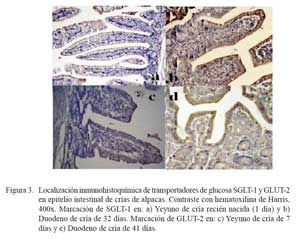
Los transportadores SGLT-1 y GLUT-2, así como la intensidad de la marcación pudieron ser observados con facilidad (Fig. 3). Los transportadores estaban ubicados en el borde externo de la vellosidad (zona apical y zona media).
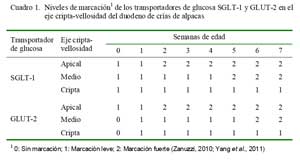
En el duodeno, el transportador SGLT-1 se observó con una marcación fuerte hacia la semana 2 en la zona apical y hacia la semana 5 en el eje medio, mientras que en las criptas se mantuvo como marcación leve en todas las edades (Cuadro 1). La presentación de GLUT-2 en el eje cripta-vellosidad se observó al nacimiento como una marcación leve a nivel de la zona apical, tornándose fuerte hacia la semana 2, mientras que en la zona media se observó marcación fuerte a partir de la semana 6 (Cuadro 1).
En el yeyuno, la marcación de SGLT-1 fue fuerte en la parte apical del eje criptavellosidad en todas las edades. En la parte media y cripta fue leve desde el nacimiento, tornándose fuerte desde la semana 2 y 4, res- pectivamente. Con referencia al transportador GLUT-2, la marcación fue fuerte desde la semana 2 en la zona apical y desde la semana 6 en la zona media, mientras que fue siempre leve en las criptas (Cuadro 2).
En el íleon, solo se observó una marcación leve para los dos transportadores en la zona apical al nacimiento; asimismo, se observó una marcación fuerte en la zona apical y zona media a partir de la primera semana para SGLT-1. El GLUT-2 presentó una marcación leve en la zona apical hasta las semana 4 y fuerte desde la semana 5, mientras que en la zona media y cripta fue leve desde la semana 1 (Cuadro 3).
DISCUSIÓN
En el presente estudio, se demuestra la presencia de los transportadores de glucosa SGLT-1 y GLUT-2 a nivel basolateral y apical desde el día del nacimiento en la alpaca. Estas proteínas de absorción de monosacáridos, de importancia vital en los primeros días de vida de los neonatos, se presentan en la rata (Kellett y Helliwell, 2000), ratón (Gouyon et al., 2003), oveja y cerdo (Cottrell et al., 2006), cuy (Brot-Laroche et al., 1986), e incluso en insectos (Caccia et al., 2007).
Las marcaciones efectuadas mediante inmunohistoquímica con los anticuerpos anti- SGLT-1 y anti-GLUT-2, muestran la presencia de los transportadores de glucosa SGLT-1 y GLUT-2 en el eje cripta-vellosidad del intestino delgado desde el primer día de edad, donde los resultados observados sobre la distribución de los transportadores de glucosa en los enterocitos coinciden con otros autores. Así, en trabajos con métodos inmunohistoquímicos, el transportador SGLT-1 fue encontrado en el borde en cepillo del enterocito en otras especies (Boshuizen et al., 2003; Khoursandi et al., 2004, Habold et al., 2005). Esta proteína está presente en la membrana apical de los enterocitos; sin embargo, también se ha demostrado que se encuentra en varias posiciones de las vellosidades y de las criptas. Este hecho es una respuesta indirecta a la inquietud de Drozdowski y Thomson (2006) sobre la posible localización del SGLT-1 en áreas específicas del borde en cepillo del epitelio intestinal.
Los resultados demuestran que la actividad biológica del transporte de monosacáridos en la alpaca por los transportadores SGLT-1 ocurre desde el primer día de edad a diferencia del transportador GLUT-2. Si bien es cierto que GLUT-2 se encuentra en algunos casos desde el nacimiento, su ubicación es básicamente basolateral y no apical, que es la posición de mayor actividad biológica para GLUT-2 durante esta etapa. Cabe indicar que la única posición en el eje criptavellosidad demostrada para SGLT-1 es sobre la superficie apical de los enterocitos; así, en lechones se ha demostrado que la expresión de SGLT-1 desde el nacimiento es muy elevada a nivel del eje cripta vellosidad en yeyuno (Yang et al., 2011). Sin embargo, no se dispone de literatura científica sobre la expresión y alta actividad apical de SGLT-1 a lo largo del eje cripta-villosidad en recién nacidos de otras especies.
En el presente estudio, así como en otros, se pudo evidenciar la mayor presencia de SGLT-1 a nivel de la parte apical y media de la vellosidad y en muy baja o nula expresión en la cripta (Freeman et al., 1987; Meddings et al., 1990; Delézay et al., 1995). Por estudios de RT-PCR, se pudo observar una mayor expresión del mRNA SGLT-1 en la parte apical del eje cripta vellosidad, seguida por la zona media y finalmente la cripta, pues es en la parte apical donde se produce el mayor contacto de los monosacáridos con la vellosidad intestinal, especialmente en el yeyuno. Además, la expresión del mRNA está directamente relacionada con la traducción de la proteína SGLT-1 (Yang et al., 2011).
La distribución de los transportadores GLUT-2 en los enterocitos y su localización en la zona de la membrana celular apical posterior a la ingesta de dietas con contenido de monosacáridos, así como su papel en la absorción de glucosa, ha sido revisado en detalle en trabajos previos (Grefner et al., 2006; Gromova et al., 2006) y coinciden con los resultados del presente estudio. A nivel intestinal la activación de GLUT-2 en la membrana apical del enterocito es producto de mecanismos de detección de nutrientes a corto y largo plazo (Kellett, 2001; Kellett y Brot- Laroche, 2005).
Asimismo, ya se había indicado que uno de los posibles mecanismos de la aparición de GLUT-2 en la zona del borde en cepillo era el transporte vesicular por endocitosis de las vesículas (Grefner et al., 2006). Esta posibilidad es confirmada indirectamente por los resultados del presente estudio, donde se observó una marcación netamente basolateral al primer día de edad (Cuadro 1). En el modelo clásico de la absorción, GLUT-2 se encuentra únicamente a nivel de la membrana basolateral; sin embargo, mediante un estudio en ratas diabéticas (Corpe et al., 1996), se descubrió que GLUT-2 podía estar transitando desde y hacia la membrana apical en condiciones normales durante la alimentación, por lo que la absorción de fructosa es mediada tanto por GLUT-5 y GLUT-2 (Helliwell et al., 2000a,b).
La presencia de los transportadores de glucosa GLUT-2 se evidenció en la región basolateral de las vellosidades intestinales (Cuadro 2), especialmente al primer día de edad. El modelo propuesto, previo a los trabajos del grupo de Kellet (Kellett y Helliwell, 2000), sobre la ubicación del GLUT-2 era la basolateral; sin embargo, actualmente se reconoce su ubicación apical en el enterocito. La presencia apical del GLUT-2 en los enterocitos se observó marcadamente en el presente estudio después del día 1 de edad (Cuadro 1, Cuadro 2 y Cuadro 3), debido a que los animales ingirieron leche, la cual contiene hidratos de carbono que inducen un aumento de la presencia de GLUT-2 en la zona apical de los enterocitos. En estudios inmunohistoquímicos y de inmunofluorescencia se pudo demostrar que después de una ingesta de nutrientes ricos en carbohidratos, las vesículas citoplasmáticas que contiene a los GLUT-2 se dirigen hacia la superficie apical del enterocito, ocasionado una mayor concentración del transportador (Kipp et al., 2003; Khoursandi et al., 2004).
Los niveles de glucosa en sangre estuvieron entre 150 a 176 mg/dL, valores elevados en relación a otras especies. La diferencia entre animales recién nacidos con animales de 3 a 5 semanas es un reflejo del consumo de alimentos ricos en carbohidratos, lo cual coincide con lo encontrado en la expresión de transportadores de SGLT-1 y GLUT-2. Esto evidencia que el incremento de transportadores de glucosa a nivel de intestino delgado está relacionado al incremento de los niveles de glucemia. Además, trabajos anteriores (Esquerre et al., 1976, 1979) sobre el desarrollo metabólico postnatal en la alpaca determinaron que estos animales mantienen altos niveles de glucosa en sangre sin padecer trastornos metabólicos como la diabetes mellitus.
CONCLUSIONES
-
Las proteínas transportadoras de glucosa SGLT-1 y GLUT-2 están presentes en el intestino delgado de la alpaca desde el nacimiento.
-
Mediante inmunohistoquímica, los niveles de marcación de mayor intensidad se observaron en el yeyuno, especialmente para SGLT-1.
-
La marcación en el eje cripta-vellosidad fue mayor en la zona apical en las tres porciones del intestino delgado, luego en la media y finalmente en la cripta.
-
Los altos valores de glucemia tiene relación directa con la expresión temprana de las proteínas que se encargan de su absorción.
LITERATURA CITADA
1. Barrett M, Walmsley A, Gould G. 1999. Structure and function of facilitative sugar transporters. Curr Opin Cell Biol 11: 496-502.
2. Boshuizen J, Reimerink J, Korteland- Van Male M, Van Ham V, Koopmans M, Bül-ler H, Dekker J, Einerhand A. 2003. Changes in small intestinal homeostasis, morphology, and gene expression during rotavirus infection of infant mice. J Virol 77: 13005-13016.
3. Brot-Laroche E, Serrano MA, Delhomme B, Alvarado F. 1986. Temperature sensitivity and substrate specificity of two distinct Na+-activated d-glucose transport systems in guinea pig jejunal brush border membrane vesicles. J Biol Chem 261: 6168-6176.
4. Buddington R, Elnif J, Puchal- Gardiner A, Sangild P. 2001. Intestinal apical amino acid absorption during development of the pig. Am J Physiol- Reg I 280: 241-247.
5. Caccia S, Casartelli M, Grimaldi A, Losa E, de Eguileor M, Pennacchio F, Giordana B. 2007. The unexpected similarity of intestinal sugar absorption by SGLT1 and apical GLUT2 in an insect (Aphidius ervi, Hymenoptera) and mammals. Am J Physiol-Reg I 292: 2284- 2291.
6. Corpe C, Basaleh M, Affleck J, Gould G, Jess T, Kellett G. 1996. The regulation of GLUT5 and GLUT2 activity in the adaptation of intestinal brushborder fructose transport in diabetes. Pflugers Arch 432: 192-201.
7. Cottrell J, Stoll B, Buddington R, Stephens J, Cui L. 2006. Glucagon-like peptide-2 protects against TPN-induced intestinal hexose malabsorption in enterally refed piglets. Am J Physiol- Gastr L 290: 293-300.
8. DeFronzo R. 1997. Pathogenesis of type 2 diabetes, metabolic and molecular implications for identifying diabetes genes. Diabetes Rev 5: 177-269.
9. Delézay O, Baghdiguian S, Fantini J. 1995. The development of Na+- dependent glucose transport during differentiation of an intestinal epithelial cell clones is regulated by protein kinase C. J Biol Chem 270: 12536-12541.
10. Drozdowski L, Thomson A. 2006. Intestinal sugar transport. World J Gastroentero 12: 1657-1670.
11. Eisenberg ML, Maker AV, Slezak LA, Nathan JD, Sritharan KC, Jena BP, et al. Insulin receptor (IR) and glucose transporter 2 (GLUT2) proteins form a complex on the rat hepatocyte membrane. Cell Physiol Biochem 15: 51-58.
12. Esquerre C, Samaniego L, Navas M, Sánchez D. 1979. Variaciones metabólicas asociadas al crecimiento post natal de la alpaca. En: Resúmenes XII Congreso Peruano de Química. Lima.
13. Esquerre C, Samaniengo L, Román M. 1976. Estadios metabólicos en relación al desarrollo post natal de la alpaca (Lama pacos). En: Resúmenes I Congreso Peruano de Bioquímica. Lima.
14. Freeman HJ, Johnston G, Quamme GA. 1987. Sodium-dependent D-glucose transport in brush-border membrane vesicles from isolated rat small intestinal villus and crypt epithelial cells. Can J Physiol Pharm 65: 1213-1219.
15. Gouyon F, Onesto C, Dalet V, Pages G, Leturque A, Brot-Laroche E. 2003. Fructose modulates GLUT5 mRNA stability in differentiated Caco-2 cells: role of cAMP signaling pathway and PABP-interacting protein (Paip) 2. Biochem J 375: 167-174.
16. Grefner N, Gromova L, Gruzdkov A, Snigirevskaia E, Komissarchik I. 2006. Structural-functional analysis of diffusion in glucose absorption by rat small intestine enterocytes [En ruso]. Tsitologiia 48: 355-363.
17. Gromova L. Grefner N, Gruzdkov A, Snigirevskaia E, Komissarchik I. 2006. Comparative analysis of SGLT1 and GLUT2 transporters distribution in rat small-intestine enterocytes and Caco- 2 cells during hexose absorption. Cell Tissue Biol 4: 354-361.
18. Habold C, Foltzer-Jourdainne C, Le Maho Y, Lignot J, Oudart H. 2005. Intestinal gluconeogenesis and glucose transport according to body fuel availability in rats. J Physiol 566: 575-586.
19. Helliwell P, Richardson M, Affleck J, Kellett G. 2000a. Regulation of GLUT5, GLUT2 and intestinal brush-border fructose absorption by the extracellular signal-regulated kinase, p38 mitogenactivated kinase and phosphatidylinositol 3-kinase intracellular signalling pathways: implications for adaptation to diabetes. Biochem J 350: 163-169.
20. Helliwell P, Richardson M, Affleck J, Kellett G. 2000b. Stimulation of fructose transport across the intestinal brush-border membrane by PMA is mediated by GLUT2 and dynamically regulated by protein kinase C. Biochem J 350: 149-154.
21. Hwang ES, Hirayama BA, Wright EM. 1991. Distribution of the SGLT1 Na+/glucose cotransporter and mRNA along the crypt-villus axis of rabbit small intestine. Biochem Bioph Res Co 181: 1208-1217.
22. Kellett G. 2001. The facilitated component of intestinal glucose absorption. J Physiol 531: 585-595.
23. Kellett G, Brot-Laroche E. 2005. Apical GLUT2: a major pathway of intestinal sugar absorption. Diabetes 54: 3056-3062.
24. Kellett G, Helliwell P. 2000. The diffusive component of intestinal glucose absorption is mediated by the glucoseinduced recruitment of GLUT2 to the brush-border membrane. Biochem J 350: 155-162.
25. Kellett GL, Brot-Laroche E, Mace OJ, Leturque A. 2008. Sugar absorption in the intestine: the role of GLUT2. Annu Rev Nutr 28: 35-54.
26. Khoursandi S, Scharlau D, Herter P, Kuchnen C, Martin D, Kinne R, Kipp H. 2004. Different modes of sodium- D-glucose cotransporter-mediated Dglucose uptake regulation in Caco-2 cells. Am J Physiol-Cell Ph 287: 1041-1047.
27. Kipp H, Khoursandi S, Scharlau D, Kinne R. 2003. More than apical: distribution of SGLT1 in Caco-2 cells. Am J Physiol-Cell Ph 285: 737-749.
28. Martínez de Victoria E, Mañas M, Yago M. 2005. Fisiología de la digestión. En: Tratado de nutrición. Tomo I. Gil A (ed). Acción médica. Madrid. p 249-293.
29. Martoja R, Martoja-Pierson M. 1970. Técnicas de histología animal. Barcelona: Ed Toray-Masson. 350 p.
30. Meddings JB, DeSouza D, Goel M, Thiesen S. 1990. Glucose transport and microvillus membrane physical properties along the crypt-villus axis of the rabbit. J Clin Invest 85: 1099-1107.
31. Ogra P, Welliver R. 2008. Effects of early environment on mucosal immunologic homeostasis, subsequent immune responses and disease outcome. In: Barrer D, Bergmann R, Ogra P (eds). The window of opportunity: pre-pregnancy to 24 months of age. Nestle Nutrition Workshop Series: Pediatric Program 60: 145-182.
32. Sauter S, Roffler B, Philipona C, Morel C, Romé B, Guilloteau P, Blum J, Hammon H. 2004. Intestinal development in neonatal calves: Effects of glucocorticoids and dependence on colostrum feeding. Biol Neonate 85: 94- 104.
33. Scheepers A, Joost HG, Schurmann A. 2004. The glucose transporter families SGLT and GLUT: molecular basis of normal and aberrant function. JPen-Parenter Enter 28: 364-371.
34. Sklan D. 2000. Development of the digestive tract of poultry. In: XXI World Poultry Congress. Montreal, Canada.
35. Taylor C, Shi S, Cote R. 1996. Review: Antigen retrieval for immunohistochemistry. Appl Immunohistochem 4:144-166.
36. Unger R. 1991. Diabetic hyperglycemia: link to impaired glucose transport in pancreatic beta cells. Science 251: 1200- 1205.
37. Yang C, David M, Wang Z, Stoll B, Lackeyram D, Kendall C. 2011. Apical Na+-D-glucose cotransporter 1 (SGLT1) activity and protein abundance are expressed along the jejunal crypt-villus axis in the neonatal pig. Am J Physiol- Gastr L 300: 60-70.
38. Zanuzzi C. 2010. Efectos de la intoxicación con Solanum glaucophyllum (duraznillo blanco) sobre la proliferación, diferenciación y muerte celular en el intestino de conejos. Tesis de Doctorado. Argentina: Univ Nacional de La Plata. 286 p.
39. Ziegenhorn J, Newman U, Hegen A. 1977. Kinetic enzymatic method for automated determination of glucose in blood and serum. J Clin Chem Clin Biochem 15(1): 13-19.
40. Zierler K. 1999. Whole body glucose metabolism. Am J Physiol 276: 409-426.