Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.2 Lima abril./jun 2012
VIABILIDAD ESPERMÁTICA E INTEGRIDAD DEL ACROSOMA EN SEMEN CONGELADO DE TOROS NACIONALES
SPERM VIABILITY AND ACROSOME INTEGRITY IN NATIONAL FROZEN BULL SEMEN
Próspero Cabrera V.1,3, César Pantoja A.2,4
1 Departamento de Producción Animal, 2 Programa Doctoral en Ciencia Animal, Facultad de Zootecnia, Universidad Nacional Agraria La Molina (UNALM), Lima
3 E-mail: procecavi@lamolina.edu.pe
4 E-mail: pantoja4444@hotmail.com
RESUMEN
Se evaluó el deterioro de la membrana espermática e integridad del acrosoma como método para predecir la fertilidad en toros. Se trabajó con cuatro toros (2 Hosltein y 2 Brown Swiss) del Banco Nacional de Semen, Lima-Perú. Se evaluó integridad acrosomal, integridad de membrana espermática, motilidad, espermatozoides vivos, volumen y concentración durante los procesos de refrigeración, congelación y descongelación de 10 eyaculados por animal. En semen fresco sin diluir se encontró un volumen de 4.33 ml, concentración espermática de 922.5 x 106/ml, y 78.5% de espermatozoides vivos. La motilidad individual progresiva en semen diluido fue de 82.7 a 86.0% con diferencia significativa entre toros (p<0.05). La integridad de acrosoma en semen refrigerado varió entre 59.3 a 69.2% con diferencia estadística entre toros. El porcentaje de espermatozoides con acrosoma intacto disminuyó de 65.2% en semen refrigerado a 48.6% en semen congelado/ descongelado, sin diferencias estadísticas entre toros. No se encontró una correlación significativa entre motilidad con integridad de membrana espermática o integridad de acrosoma.
Palabras clave: integridad de acrosoma, semen congelado, HOST, toros
ABSTRACT
The deterioration of the sperm membrane and acrosome integrity as a method for predicting fertility in bulls was evaluated. Four bulls (2 Holstein and 2 Brown Swiss) from the National Bank of Semen, Lima-Peru were used. Acrosome integrity, sperm membrane integrity, motility, live sperm cells, volume, and sperm concentration during cooling, freezing and thawing was evaluated in 10 ejaculates per sire. In fresh semen, volume was 4.33 ml; sperm concentration was 922.5 x 106/ml and 78.5% of live cells. The individual progressive motility in diluted semen was 82.7 to 86.0% with significant difference between bulls (p<0.05). Acrosome integrity in chilled semen varied from 59.3 to 69.2% and without statistical difference between bulls. Percentage of sperm with intact acrosome decreased from 65.2 in chilled semen to 48.6% in frozen/thawed semen, without statistical difference between bulls. None significant correlation was found between motility and sperm membrane integrity or acrosome integrity.
Key words: acrosome integrity, frozen semen, HOST, bulls
INTRODUCCIÓN
En la actualidad se ha masificado la utilización de semen congelado para la inseminación artificial del ganado bovino, dado el incremento de la productividad en esta especie por el uso de machos de alta calidad genética; sin embargo, las tasas de concepción al primer servicio son todavía relativamente bajas. Esta fertilidad está influenciada por la capacidad fecundante de los espermatozoides que se encuentran en la pajilla de semen.
Se requiere un método de valoración de la calidad seminal, que al utilizarlo solo o en combinación con otros, sea capaz de predecir en forma rápida y segura la capacidad fecundante de una muestra de semen (Rodríguez-Martínez, 2003). Las características seminales clásicas (volumen, concentración, vitalidad, morfología, motilidad) están relacionadas con la fertilidad del animal, pero presentan variaciones en la fertilidad individual que, en ocasiones, sobrestiman o subestiman el potencial fecundante del macho.
El acrosoma juega un papel fundamental en la fecundación. En el acrosoma se puede distinguir tres regiones claramente diferenciadas: la zona acrosomal con su borde apical, la zona post acrosomal y el segmento ecuatorial entre ambas, los mismos que tienden a romperse en el proceso de refrigeración, congelación y descongelamiento. Muestras seminales con alta proporción de alteraciones acrosomales suelen tener una fertilidad baja (Peña y Linde-Forsberg, 2000).
La reactividad de la membrana acrosomal representa un requisito absoluto para la fertilización y sólo los espermatozoides que pueden realizar la reacción acrosomal (RA) de manera sincronizada con la fase de penetración del oocito, tienen la habilidad de pasar a través de la zona pelúcida y, como consecuencia, fusionarse con este para formar un embrión (Januskauskas et al., 2000). Asimismo, Fraser (1994) ya había demostrado en espermatozoides de ratón que sólo aquellos con acrosoma intacto pueden unirse a la membrana pelúcida. No obstante, algunas células espermáticas pueden sufrir la RA de manera espontánea, existiendo diversas experiencias que muestran la necesidad de moléculas específicas asociadas con el ovocito en la inducción de la RA (Florman y Storey, 1982).
La integridad de la membrana plasmática y acrosomal reflejan la viabilidad espermática, y el proceso de criopreservación podría afectar estas membranas ocasionando daños como hinchamiento y disrupción de las mismas, cambios en la fluidez, alteración del flujo de calcio y cambios en la actividad enzimática que pueden inducir una capacitación espermática anticipada, viéndose afectada la fertilidad (Tartaglione y Ritta, 2004).
Idealmente, el método para determinar el estado acrosomal debe ser exacto, rápido e inocuo para la función espermática; asimismo, debe poder emplearse en distintos medios y fluidos, y ser capaz de diferenciar reacciones acrosómicas falsas, que están asociadas a la muerte de la célula, con reacciones verdaderas, asociadas a la fecundación (Cross y Meizel, 1989).
La prueba de resistencia osmótica (HOST), que evalúa la integridad de la membrana espermática y la prueba de integridad acrosomal, a través de tinción Azul de Tripán/ Giemsa, permiten predecir con bastante confiabilidad la capacidad fértil de un toro, toda vez que se ha encontrado correlaciones altas y positivas con la tasa de fertilidad in vivo (Aisen et al., 2002).
El objetivo del presente estudio fue evaluar el grado de deterioro de la membrana espermática e integridad del acrosoma en espermatozoides de toros del Banco Nacional de Semen (Lima, Perú), durante los procesos de refrigeración y congelación-descongelación, como características importantes para predecir la fertilidad en toros jóvenes de alto valor genético. Así mismo, se evaluó la relación existente entre la evaluación de motilidad (valoración subjetiva) y las pruebas de integridad de membrana e integridad acrosomal (valoración específica).
MATERIALES Y MÉTODOS
Lugar de Ejecución y Duración
El estudio se realizó en las instalaciones del Banco Nacional de Semen de la Universidad Nacional Agraria (UNA) La Molina, ubicado en la ciudad de Lima, Perú. El promedio de temperatura máxima en la época de calor fue de 28.7 °C y el promedio mínimo en la época de frío fue de 14.6 °C, con humedad relativa promedio de 80% y precipitación anual de 60 mm (Observatorio Meteorológico A. Von Humbolt – UNA La Molina). El desarrollo de la parte experimental tuvo una duración de 6 meses.
Animales
Se utilizaron cuatro toros donadores de semen (2 Holstein y 2 Brown Swiss), de 1.5 a 2 años de edad, del Banco Nacional de Semen.
Los toros estaban alojados en toriles independientes, con parte del piso de concreto y otra de tierra. Los toriles eran de material noble y madera, provisto de sombras, comedero y bebedero, y con adecuada iluminación y ventilación. Todos los animales tuvieron un régimen de paseo, una vez por semana por un tiempo de 60 minutos. La alimentación fue en base de maíz chala (Zea mays) fresco y picado, suplementado con concentrado (14% proteína, 17.5% fibra y 68.5% NDT). El forraje se ofreció dos veces al día y el concentrado por las mañanas.
Colección de Semen
Se utilizó un brete de monta de 3.0 m de largo, 1.50 m de ancho y 1.80 m de alto. El semen fue obtenido mediante vagina artificial. La temperatura interior de la vagina fue estandarizada a 35 °C, y se utilizó una misma funda para cada toro durante el estudio. Los tubos de colección estaban rotulados y protegidos del medio ambiente con papel metálico y funda. La frecuencia de colección de semen fue de dos veces por semana. Para el propósito del estudio, se trabajó con 10 eyaculados por toro.
El eyaculado fue inmediatamente trasladado al laboratorio para la evaluación preliminar, manteniéndose en todo momento a 32.5 ºC por medio de baño maría y platina temperada del microscopio. La temperatura ambiental en el laboratorio fue de 20 °C.
Evaluación Macroscópica
- Volumen (ml). Se determinó mediante observación directa al tubo de ensayo graduado. No se consideró las burbujas de aire sobre la superficie del semen.
- Color y aspecto. El color se determinó por su aspecto, el cual estuvo asociado a su calidad (entre blanco cremoso a blanco lechoso). El aspecto se determinó por el grado de opacidad, variando de denso cremoso a denso acuoso.
- pH. Se utilizó papel indicador de ph (PANPEHA ®, Sigma Aldrich).
Evaluación Microscópica
- Actividad masal. Se colocó una alícuota de semen puro (20 μl) sobre una lámina portaobjetos en el microscopio óptico con objetivo de 10x y con platina temperada a 32.5 °C. Se estimó mediante una valoración subjetiva del movimiento masivo de los espermatozoides, según Evans et al. (1990), con un rango de 0 a 5.
- Motilidad. Se determinó en base a la proporción de espermatozoides progresivamente móviles, expresado en porcentaje. Para ello, se colocó una alícuota de semen sobre una lámina portaobjetos y cubierta con una laminilla. Se observó al microscopio con objetivo de 40x.
- Concentración espermática. El contaje de espermatozoides se hizo en la cámara de Neubauer, la que fue cargada con un hemocitómetro, según la técnica descrita por Evans y Maxwell (1990), con la variante del uso de agua bidestilada para inmovilizar a los espermatozoides.
- Porcentaje de espermatozoides vivos y muertos. Se colocó una gota de semen y dos gotas de eosina y de nigrosina. Se mezcló en una lámina portaobjetos y se hizo un frotis. Se dejó secar por 20 segundos y se observó al microscopio con objetivo de 40x. Se contaron 300 células espermáticas con ayuda de dos contómetros, y la frecuencia de vivos (espermatozoides blancos) y muertos (espermatozoides rojos) se expresó en porcentaje.
- Morfología espermática. Se hicieron frotices de espermatozoides teñidos con eosina-nigrosina y se observó en el microscopio usando un objetivo de 40x. Se observaron 100 células espermáticas en tres campos, considerando anormales todos los espermatozoides que presentaban irregularidad en su forma, según lo descrito por Evans y Maxwell (1990). El resultado es el promedio de los tres campos evaluados.
Dilución y Congelación
Para la dilución se utilizó una parte del dilutor Bioxell Buffer IMV® y cuatro partes de agua bi-destilada. Esta mezcla, debidamente homogenizada se colocó en baño maría a 32.5 °C por 10 a 15 minutos previo a la mezcla con el semen.
Se hizo una pre-dilución, agregando el dilutor al semen en una proporción de 1:1 en baño maría a 32.5 °C. Se determinó el número de pajillas a congelar, considerando una concentración de 20 x 106 espermatozoides por dosis de semen, y se adicionó la cantidad de dilutor correspondiente. Se homogenizó suavemente, se comprobó la motilidad de los espermatozoides en el microscopio y se procedió a envasar el semen en pajillas de 0.5 ml (pajillas Cassou IMV® Technologies, Francia).
Para el proceso de congelación, el descenso de la temperatura se realizó en cubetas con agua a temperatura ambiente (20 °C) y luego en refrigeradora (5 °C) por 18 a 22 horas. Si la temperatura no alcanzó los 5 °C antes de la congelación se agregó cubos de hielo al envase de agua para lograr la temperatura adecuada. La congelación de semen se realizó siguiendo el método que usa el Banco Nacional de Semen (vapores de nitrógeno líquido para descender a razón de 20 ºC por minuto, durante 7 minutos, y luego se sumergieron las pajillas en nitrógeno líquido para llegar a -196 °C). El semen se almacenó en tanques criogénicos. Para la descongelación, las pajillas se sumergieron en agua a 37 °C por espacio de 15 a 20 segundos y fueron secadas con papel toalla.
La motilidad del semen se evaluó antes y después de la congelación. Semen con motilidad inferior a 60% era descartado, según la política de trabajo del Banco Nacional de Semen. Se emplearon 10 pajillas por toro tomadas al azar para las evaluaciones postdescongelación.
Integridad de Membrana Citoplasmática y del Acrosoma
Para determinar la integridad de la membrana citoplasmática en semen descongelado se utilizó la prueba de endósmosis (hipoosmótica – HOST) mediante solución hipoosmótica de citrato de sodio (100 mOsm/ L), siguiendo el protocolo utilizado por Correa y Zavos (1994). La lectura se hizo en un microscopio de contraste de fase con objetivo de 40x. Se observan 300 espermatozoides en un mínimo de 10 campos microscópicos, donde aquellos con membrana citoplasmática intacta muestran una deformación de la cola por efecto de la hinchazón.
Para evaluar la integridad del acrosoma en semen descongelado se utilizó la solución de doble tinción (Giemsa [Merck 1.09203] – Azul Tripán [Sigma T0776]), descrita por Didion et al. (1990). Los espermatozoides considerados como vivos y con el acrosoma intacto presentaban color rosado en la parte de la membrana acrosomal y azul pálido en la base, mientras que los muertos presentaban una coloración azul oscuro. Se contaron 200 espermatozoides por lámina.
Análisis Estadístico
Se aplicó un test de normalidad para los datos numéricos. Los valores porcentuales fueron transformados mediante arco seno: Y = arc sen [(x/100)1/2], donde x representa los valores porcentuales.
Se aplicó un test de normalidad a los valores. En el análisis de las características del semen congelado/descongelado (volumen, motilidad masal, porcentaje de espermatozoides vivos, HOST e integridad de acrosoma) se determinó las medidas de tendencia central como la desviación estándar y coeficiente de variación.
Para la evaluación de la respuesta a la motilidad, integridad de membrana (endósmosis positiva), e integridad de acrosoma espermática se empleó un diseño completamente al azar, cuyo modelo matemático lineal fue Yij = μ + Ti + eij y dónde Y¡j = variable respuesta de espermatozoides vivos y con acrosoma intacto del i-ésimo tratamiento (toro), μ = media general, Ti = efecto del j-ésimo tratamiento (toros), eij = error experimental. Además, se determinó el coeficiente de correlación entre las pruebas realizadas (motilidad, HOST e integridad de acrosoma en semen congelado/descongelado) (Pérez López, 2001).
En todos los análisis estadísticos se utilizó el programa SAS (Statistical Analysis System), v 8.0, para un error de 0.05 (Pérez López, 2001).
RESULTADOS Y DISCUSIÓN
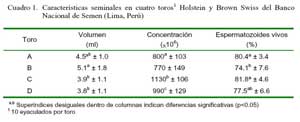
Las colecciones seminales fueron homogéneas, de color blanco cremoso, aspecto denso, con pH promedio de 6.8, 4.33 ml de volumen, 922.5 x 106/ml de concentración espermática y 86.0% de espermatozoides vivos (Cuadro 1). Estas características se encuentran dentro de los parámetros establecidos para toros en actividad reproductiva, aunque en el análisis estadístico se encontró diferencias estadísticas entre toros (p<0.05). Los resultados fueron similares a los reportados por Gastelum et al. (1989) con volúmenes de eyaculado de 4.0 a 8.5 ml en toros de Raza Brown Swiss y Holstein.
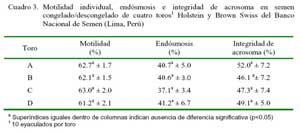
La motilidad individual progresiva en semen refrigerado fue adecuada para el procesamiento de semen congelado, y los valores fueron superiores a los valores de 76.7- 85.5% reportados por Madrid-Bury et al. (2005) en cinco toros de doble propósito en condiciones de trópico. Los valores de integridad de membrana citoplasmática fueron homogéneos (56.7-59.1%), sin diferencia estadística entre toros. Asimismo, la integridad del acrosoma en semen refrigerado fue uniforme (59.3-69.2%) y similar a los valores de 70.2-73.5% de Madrid-Bury et al. (2005). Estos resultados, que se observan en el Cuadro 2, demuestran que el acrosoma se pudo mantener en una gran proporción de espermatozoides durante el proceso de refrigeración del semen.
Se debe indicar que se tuvo que descartar el semen del toro D en dos oportunidades debido a que la motilidad post-descongelación fue menor de 60%, a fin de seguir las normas establecidas por el Banco Nacional de Semen. Esto al parecer ocurrió por un desnivel en la cantidad de nitrógeno que se requería para generar vapores de nitrógeno durante la congelación.
Los valores de la evaluación microscópica en el semen descongelado se muestran en el Cuadro 3. Se observa una ligera pérdida de la calidad espermática debido al proceso de congelación y descongelación. Una particularidad importante de resaltar es que la pérdida en la proporción de espermatozoides viables y capaces de fecundar (con acrosoma intacto) por efecto de la congelación/ descongelación fue similar entre los toros. Esto indica que la calidad seminal de un toro persiste en forma proporcional desde la colección y durante el proceso de congelación y descongelación; es una característica propia del individuo según su genotipo. En base a esto, se puede remarcar la importancia de conocer la proporción de espermatozoides con acrosoma intacto en cada toro, ya que esta medida determina su capacidad fecundante.
Los valores de motilidad espermática post descongelamiento fueron menores a motilidades entre 66 a 75% señaladas en la literatura (Correa et al., 1996; Quispe, 2005), aunque se encuentran dentro de los rangos esperados. Estas diferencias pudieron ser debidas al protocolo de descongelamiento empleado (Nur et al., 2003).
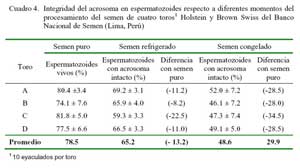
En el Cuadro 4, se presentan los valores comparativos de la proporción de esperma- tozoides viables y capaces de fecundar en los diferentes momentos de procesamiento del semen. Se compara los promedios a la prueba de integridad de acrosoma en semen refrigerado (65.2%) respecto al semen descongelado (48.6%), respectivamente.
El toro C, quien mostró una alta proporción de espermatozoides vivos en el semen puro fue el que presentó la mayor pérdida de espermatozoides con acrosoma intacto (-34.5%), aunque sin diferencias estadísticas entre toros. La capacidad fecundante y la actividad funcional de la membrana plasmática se encuentra afectada por los cambios metabólicos que ocurren a su alrededor, incluyendo los eventos que ocurren durante la capacitación en el tracto femenino (Ducci, 2002). En el presente estudio, la integridad del acrosoma, dentro de cada parte del procesamiento de semen presentó una baja variabilidad entre toros y entre eyaculados.
Por otro lado, el 65.2% de espermatozoides con acrosoma intacto antes de la congelación fue estadísticamente superior (p<0.05) al 48.6% observado después de la congelación/descongelación, mostrando el grado de influencia del efecto de la congelación sobre la calidad espermática. Esta disminución fue, sin embargo, menor a lo reportado por Thomas et al. (1998), quienes afirman que durante el proceso de criopreservación se produce una disminución del 50% de la viabilidad espermática, debido principalmente al efecto de la temperatura y la presión osmótica, que ocasionan cambios en la permeabilidad, composición lipídica de las membranas espermáticas y en el líquido intracelular. Correa et al. (1994) mostraron que a temperaturas menores a 37 °C, el fluido de iones, moléculas y proteínas a través de la membrana espermática disminuye. Los resultados de HOST fueron coincidentes con otros estudios (Correa et al., 1996; Nur et al., 2003), aunque diferentes a los resultados presentados por Quispe (2005), posiblemente debido al tipo de animal y condiciones del procesamiento de semen.
Las correlaciones entre motilidad espermática antes y después de la congelación no fue estadísticamente significativa con los resultados de HOST ni con la integridad del acrosoma, mostrando que son características muy independientes. Es decir, un incremento o disminución en la proporción de espermatozoides sin alteraciones funcionales en sus membranas espermáticas, no estaría asociado a un incremento o disminución en el movimiento espermático. En condiciones fisiológicas normales, la fecundación no ocurre si la membrana plasmática del espermatozoide es bioquímicamente inactiva, aun cuando permanezca estructuralmente intacta, por lo tanto la prueba hipoosmótica es un indicador preciso, ya que permite distinguir el adecuado funcionamiento de la membrana espermática (Tamuli et al., 1992).
Tampoco se encontró una correlación significativa entre integridad del acrosoma y de la membrana plasmática. Sin embargo, la correlación entre motilidad de semen refrigerado y semen descongelado fue altamente significativa (r=0.81948; [p<0.001]).
CONCLUSIONES
-
El proceso de refrigeración y congelación/ descongelación de semen de toros del Banco Nacional de Semen (Lima, Perú) no tuvo un efecto biológico importante sobre la membrana espermática ni sobre la integridad del acrosoma.
-
La calidad espermática de los toros fue adecuada durante el proceso de congelación de semen, sin haber diferencia estadística entre toros.
-
No se observaron correlaciones significativas entre motilidad, integridad de membrana espermática e integridad del acrosoma.
LITERATURA CITADA
1. Aisen E, Medina VH, Ventrino A. 2002. Cryopreservation and postthawed fertility of ram semen frozen in different trehalose concentrations. Theriogenology 57: 1801-1808.
2. Correa JR, Zavos PM. 1994. The hipoosmotic swelling test: Its employment as an assay to evaluate the functional integrity of the frozen-thawed bovine sperm membrane Theriogenology 42: 351-360.
3. Correa JR, Heersche G, Zavos PM. 1996. Sperm membrane functional integrity and response of frozen-thawed bovine spermatozoa during the hypohosmotic swelling test incubation at varying temperatures. Theriogenology 47: 715-721.
4. Cross, NL, Meizel S. 1989. Mini review-methods for evaluating the acrosomal status of mammalian sperm. Biol Reprod 41: 635-641. 5.Didion BA, Dowrinsky JR, Giles JR, Graves CN. 1990. Staining procedure to detect viability and the true acrosome reaction in spermatozoa of various species. Gamete Res 22: 51-57.
5. Ducci M, Gazzano A, Villani C, Cela V, Artini PG, Martelli F, Genazzani AR. 2002. Membrane integrity evaluation in rabbit spermatozoa. Eur J Obstet Gynecol Reprod Biol 102: 53-56.
6. Evans G, Maxwell WMC. 1990. Inseminación artificial de ovejas y cabras. Zaragoza: Ed Acribia. 204 p.
7. Florman HM, Storey BT. 1982. Mouse gamete interactions: the zona pellucida is the site of the acrosome reaction leading to fertilization in vitro. Develop Biol 91: 121-130.
8. Fraser LR 1994. Sperm functional changes from ejaculation to fertilization. Ares-Serono Symposia 8: 46-66.
9. Gastelum E, Zapien A, Briceño J. 1989. Algunas características en la colección y preservación de semen bovino. Patronato del Centro de Investigaciones Pecuarias del Estado de Sonora AC [Internet]. Disponible en http://www.patrocipes.org.mx/publicaciones/reproduccion/R89006.php
10. Januskauskas A, Johannisson L, Soderquist, Rodríguez-Martínez H. 2000. Assessment of sperm characteristics post-thaw and response to calcium ionophore in relation to fertility in Swedish dairy AI bulls. Theriogenology 53: 859-875.
11. Madrid-Bury N. 2005. ¿Es posible predecir la fertilidad en los toros?. En: González-Stagnaro C, Soto-Belloso E (eds). Manual de ganadería doble propósito. Maracaibo, Venezuela: Astro Data. p 631-635.
12. Nur Z, Dogan I, Soylu MK, AK K. 2003. Effect of different thawing procedures on the quality of bull semen. Revue Méd Vét 154: 487-490.
13. Peña A, Linde-Forsberg C. 2000. Effects of spermatozoa concentration and post-thaw dilution rate on survival after thawing of dog spermatozoa. Theriogenology 54: 703-718.
14. Pérez López C. 2001. El sistema estadístico SAS. Madrid: Prentice Hall. 773 p.
15. Quispe G. 2005. Integridad de la membrana plasmática en espermatozoides post -descongelado de toros aplicando la prueban hipoosmótica (test de HOST) y dos medios de incubación. Tesis de Ingeniero Zootecnista. Lima: Univ Nac Agraria La Molina. 98 p.
16. Rodríguez-Martínez H. 2003. Laboratory semen assessment and prediction of fertility: still utopia. Reprod Dom Anim 38: 312-318.
17. Tamuli MK, Watson PF. 1992. Effects of temperature of incubation on the development of resistance to cold stress in boar spermatozoa incubated for up 24 hours. In: Proc XIIh ICAR Congress. The Hague. p 1484-1486.
18. Tartaglione CM, Ritta MN. 2004. Prognostic value of spermatological parameters as predictors of in vitro fertility of frozen-thawed bull semen. Theriogenology 62: 1245-1252.
19. Thomas CA, Garner DL, Dejarnette JM, Marshall CE. 1998. Effect of cryopreservation of bovine sperm organelle function and viability as determined by flow cytometry. Biol Reprod 58: 786-793.