Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.2 Lima abril./jun 2012
RESPUESTA INMUNE EN CONEJOS A DOS TAMAÑOS DE QUISTES DE SARCOCYSTIS AUCHENIAE
IMMUNE RESPONSE IN RABBITS TO TWO SIZES OF CYSTS OF SARCOCYSTIS AUCHENIAE
Jaime Romero J.1, Amanda Chávez V.1,2, Eva Casas A.1, Lenin Maturano H.1, Nidia Puray C.1, María Chileno M.1
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 E-mail: achavezvg@gmail.com
RESUMEN
El objetivo del estudio fue evaluar la respuesta inmune de macroquistes pequeños y grandes de Sarcocystis aucheniae utilizando tres protocolos de inoculación. Para la obtención del antígeno se recolectaron cuellos de alpaca con quistes de S. aucheniae del camal de Huancavelica, Perú. Los quistes colectados fueron clasificados según el tamaño, en macroquistes grandes (>5 mm) y pequeños (1-3 mm), obteniéndose una concentración de proteína antigénica de 3.23 y 2.45 mg/ml, respectivamente. Treinta conejos fueron inmunizados con 0.05 mg/kg de proteína antigénica derivada de cada tamaño de macroquiste. Además, se consideró tres protocolos de inoculación (n = 5 conejos). El protocolo I y II con uno y dos meses de duración, respectivamente, donde las proteínas antigénicas fueron inactivadas con formol, y el protocolo III de 2 meses, con proteína antigénica inactivada con calor. La respuesta inmune específica Ag-Ac fue detectada con la prueba de inmunodifusión doble de agar gel en el 100% con los protocolos I y II, y 60% con el protocolo III en el caso de macroquistes grandes; así como en 100, 60 y 40% de los conejos con los protocolos I, II y III para macroquistes pequeños, respectivamente. En conclusión, respuestas inmunes del 86.6 y 66.6% fueron evidenciadas utilizando proteínas antígénicas provenientes de macroquistes grandes y pequeños, respectivamente, al utilizar los tres protocolos de inmunización, aunque en el análisis de Fisher no se observó asociación entre protocolos y reacción Ag-Ac.
Palabras clave: Sarcocystis aucheniae, macroquistes, proteínas antigénicas, respuesta inmune, protocolos de inoculación
ABSTRACT
The aim of this study was to evaluate the immune response of small and large macrocysts of Sarcocystis auchenie using three protocols of inoculation. Alpaca meat samples with S. aucheniae were obtained from the slaughterhouse of Huancavelica, Peru. Cysts were collected and classified by size in large (>5 mm) and small (1-3 mm), obtaining 3.23 and 2.45 mg/ml respectively of antigenic protein by the Biuret method. Fifteen rabbits were immunized with 0.05 mg/kg of antigenic protein derived from large and small macrocysts. Besides, three protocols of inoculation were considered (n = 5 rabitts). Protocol I and II were of 1 and 3 month length where proteins were inactivated with formalin, and protocol III of 2 months length using heat-inactivated antigen protein. Specific immune response Ag-Ab was detected by double immunodiffusion in agar gel in 100% of rabbits using protocols I and II and 60% with protocol III in large macrocysts while 100, 60 and 40% response in protocols I, II and III in small macrocysts respectively. In conclusion, immune responses of 86.6 and 66.6% were obtained when using antigenic proteins from large and small cysts, respectively; however, no association was observed between protocols and Ag-Ab reaction when using Fishers analysis.
Key words: Sarcocystis aucheniae, macrocystic, antigenic proteins, immune response, inoculation protocols
INTRODUCCIÓN
Sarcocystis spp es un parásito perteneciente al phylum Apicomplexa, conjuntamente con Toxoplasma gondii y Neospora caninum. Tiene un ciclo de vida indirecto, es decir, de tipo predador-presa. Afecta a una amplia gama de mamíferos que actúan como hospederos intermediarios, donde se lleva a cabo la fase asexual y se desarrollan los quistes que se ubican en la musculatura esquelética y cardiaca (Leguía et al., 1989). Los carnívoros (gatos y perros) actúan en su mayoría como hospederos definitivos, desarrollando la fase sexual del parásito, liberando al medio ambiente esporoquistes y ooquistes infectivos.
En el Perú, se ha reportado la presencia de sarcocistiosis en varias especies domésticas. En camélidos sudamericanos (CSA) se han reportado tres especies: Sarcocystis tilopodi (llamado también Sarcocystis guanicoecanis), el cual ocasiona quistes macroscópicos en guanacos; S. lamacanis en alpacas y llamas, que produce quistes de menor tamaño (microquistes) de rápido desarrollo y que tienden a localizarse en la musculatura cardiaca; y S. aucheniae, que produce quistes macroscópicos de 0.1 a 1 cm de largo, de color blanco con apariencia de un grano de arroz compacto, los que tienden a crecer lentamente y se presentan principalmente en el esófago, cuello, costillas, brazuelo, pierna, y en general, en cualquier parte de la musculatura esquelética (Guerrero y Hernández, 1967; Castro, 1974; White, 1998). Estos quistes se observan a simple vista, y por tal motivo, ocasionan grandes pérdidas económicas por el decomiso de la carcasa por parte del inspector veterinario (Vilca, 1991); así como, al rechazo a su consumo debido al mal aspecto de la carne, limitándose la comercialización de la carne a pesar de su alto valor proteico y bajo contenido de colesterol, comparando con otras carnes rojas (Leguía et al., 1989).
Esta parasitosis se diagnostica observando los quistes presentes en la carcasa; sin embargo, una técnica de diagnóstico de S. aucheniae en el animal vivo fue realizada por Sam (1988), quien llegó a caracterizar parcialmente los componentes antigénicos del quiste y a estandarizar la prueba de ELISA, la cual viene siendo utilizada como técnica estándar de diagnóstico. No obstante, esta técnica muestra reacción cruzada entre las especies de S. lamacanis y S. aucheniae (Sam, 1988), a pesar que Medrano et al. (2006) mediante la técnica de PCR, remarca la diferencia antigénica entre ambas especies, y a partir de esa premisa, Hung (2006) ha elaborado una vacuna, la cual se encuentra en fase experimental.
Recientemente se hallaron diferencias biológicas significativas en perros inoculados con Sarcocystis aucheniae de tamaños grandes y pequeños (Cornejo et al., 2007). Es así, que el presente estudio tuvo por objetivo evaluar la respuesta inmune de macroquistes pequeños y grandes de S. aucheniae utilizando tres protocolos de inoculación.
MATERIALES Y MÉTODOS
Material Biológico y Lugar de Estudio
Se trabajó con alpacas infectadas naturalmente con macroquistes de S. aucheniae, que fueron beneficiadas en el camal de Huancavelica entre marzo a mayo de 2008. Se adquirieron cuellos con quistes e inmediatamente fueron transportados al Laboratorio de Parasitología de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), Lima. Allí, se recolectaron los macroquistes de S. aucheniae de la musculatura esquelética y fueron depositados en PBS + antibiótico (solución buffer fosfato + Penicilina-estreptomicina) a una temperatura de 2-3 ºC.
Además, se emplearon 30 conejos Nueva Zelanda de 2.5-3 meses de edad y con 2.2-3.0 kg de peso, procedentes del bioterio de la FMV-UNMSM. Se les practicó un análisis coproparasitológico seriado para descartar la presencia de parásitos gastrointestinales, y se les colocó en jaulas individuales de 0.5 m2, donde recibieron un concentrado comercial y agua ad libitum.
El tamaño de muestra (número de conejos) para evaluar la respuesta inmune entre proteínas antigénicas de dos tamaños de macroquistes se basó en un estudio similar realizado en 30 ratones, donde se trabajó en la identificación de proteínas de la membrana glicosomal de Leishmania mexicana (De Jesús et al., 1999).
Para la respuesta inmune se formó dos grupos de 15 conejos. Los animales de cada grupo fueron inoculados con proteína antigénica de macroquistes pequeños y grandes de S. aucheniae. Asimismo, cada grupo se subdividió en tres subgrupos de cinco animales cada uno para seguir un protocolo de inoculación.
Procedimiento Experimental
Obtención del antígeno proteico crudo a partir de macroquistes y preparación de los inóculos. Los macroquistes fueron lavados con PBS con antibióticos (penicilina 100 UI + estreptomicina 100 mg) y clasificados por tamaño en quistes grandes (>5 mm) y pequeños (1-3 mm), empleando una regla esterilizada. Con ayuda de una canaleta, pinza plana y jeringa de tuberculina se rompieron los macroquistes para obtener los bradizoitos y una pequeña proporción de capas del quiste. Los bradizoitos fueron filtrados utilizando un embudo con gasa estéril. El filtrado fue llevado a un tubo falcón conteniendo PBS y antibiótico (penicilina 100 UI + 100 mg estreptomicina) y centrifugado por tres veces a 500 rpm x 15 min. El sedimento se colocó en un beaker de 10 ml y llevado a sonicación a 60 ciclos por 2 min. Al sonicado resultante se le agregó PBS en caso de obtenerse una solución consistente y nuevamente fue centrifugado a 14 000 rpm x 30 min. El sobrenadante fue pasado por un filtro de 0.22 μm. El filtrado, tanto de macroquistes grandes y pequeños, fue envasado en viales de 1.5 ml y conservado en congelación.
Medición de proteínas. Se determinó la cantidad de proteínas en los macroquistes por el método de Biuret (Bradford, 1976; Arce et al., 2007).
Prueba de esterilidad. Se hicieron cultivos bacteriológicos del filtrado final para descartar contaminación microbiana. Para el cultivo de aerobios se empleó Agar Trypticasa de soya (TSA), caldo Trypticasa de soya, Agar Mac Conkey, Caldo verde brillante, Caldo Tetrationato y para los anaerobios se empleó Caldo Tryoglicolato y Agar Saboraud glucosado.
Inactivación del antígeno de S. aucheniae.
Se basó en la inactivación de la proteína antigénica cruda a través de dos métodos: uso de formol diluido, obtenido a partir de modificaciones de los protocolos de Bonilla y Zavaleta (1997) y de Sam (1988); así como la inactivación por tratamiento térmico (Marín, 1993), la cual es usada en procesos de aislamiento y purificación de componentes celulares termoestables (Labeque et al., 2003). Además, se empleó: a) Adyuvante completo de Freund (ACF), que potencia la producción de anticuerpos al producir la formación de granulomas en el sitio de inyección (Arce et al., 2007), y b) Adyuvante incompleto de Freund (AIF), que también aumenta la producción de anticuerpos pero sin formación de granulomas.
Para la inactivación con formal, se usó inicialmente formol 0.4%, luego al 4% y finalmente al 10%, que fue la dilución que dio mejores resultados. A esta dilución se agregó PBS 2x y adyuvante en la proporción del 50% en base a la emulsión. Toda la dilución se homogenizó con una jeringa de tuberculina y aguja de 21 x 0.5.
Para la inactivación por tratamiento térmico, los antígenos de macroquistes fueron diluidos en tampón de ph 7 y envasados en viales de 200 μl. Se colocaron en agitación constante en baños termoestables de agua o glicerina con temperatura de 70 ºC hasta llegar a 100 ºC durante 15 minutos. Las soluciones se enfriaron rápidamente en un baño de agua de hielo (2-3 ºC), y se homogenizaron a centrifugación (500 rpm por 15 segundos). Seguidamente, se agregó PBS 2x y, en el último paso, se añadió el adyuvante en un 50% de la emulsión para luego ser inoculado al animal, en dosis decrecientes de antígeno.
Protocolos de Inoculación
Se utilizaron tres protocolos de inoculación de proteínas antigénicas crudas para la obtención de anticuerpos. El momento y la vía de inoculación dependieron del protocolo establecido. Los conejos fueron observados desde una hora antes hasta 12 horas postinoculación. Se registró la temperatura rectal una hora antes y una hora post-inoculación.
La dosis de proteína antigénica fue de 0.05 mg/kg. Esta dosis fue empleada en un estudio paralelo donde se inoculó cantidades decrecientes de antígeno que variaron de 25 a 0.025 mg/kg y se observó el tiempo de supervivencia o mortalidad a la dosis administrada (Chileno, 2009).
En el Protocolo I, el periodo de inmunización fue de un mes y la inactivación de la proteína antigénica se realizó con formol 10% (Bonilla y Zavaleta, 1997). El Protocolo II fue similar pero con periodo de inmunización de dos meses (Sam, 1988). En el Protocolo III se empleó un periodo de inmunización de dos meses y la inactivación se hizo mediante un tratamiento térmico (Marín, 1993). El momento de la inoculación y el momento de la sangría están estipulados dentro de los protocolos, y se muestran en el Cuadro 1.
Suero y Anticuerpos
Las muestras de sangre se colectaron de las venas marginal o safena, o por punción cardiaca. El suero se obtuvo por centrifugación de la sangre a 1500 rpm x 5 min. La muestra de sangre al inicio del estudio tuvo por finalidad verificar la ausencia de anticuerpos. Las posteriores extracciones se hicieron para monitorear la presencia de anticuerpos, mediante la técnica de inmunodifusión doble en gel agar (Lange et al. 1980), técnica de fácil manejo, al no requerir un equipo especial y no depender de las condiciones medioambientales (García et al., 2000).
Análisis Estadístico
Se empleó la prueba exacta de Fisher y como variables se utilizaron la respuesta Ag- Ac, tamaño de los macroquistes y los protocolos de inoculación.
RESULTADOS
La cantidad de proteína obtenida por el método de Biuret fue de 3.23 mg/ml para macroquistes grandes y 2.45 mg/ml para macroquistes pequeños.
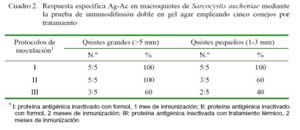
En el Cuadro 2 se muestra los resultados de la reacción Ag-Ac mediante la prueba de inmunodifusión doble en gel agar para los tres protocolos empleados, tanto para macroquistes grandes y pequeños. En el caso de quistes grandes, todos los conejos reaccionaron en los protocolos I y II, en tanto que para los macroquistes pequeños solo ocurrió en el Protocolo I.
Combinando los resultados de los tres protocolos se encontró que 13 de los 15 conejos tuvieron una respuesta específica Ag- Ac en macroquistes grandes (86.6%) y en 10 de 15 conejos en macroquistes pequeños (66.6%), sin encontrar diferencias estadísticas.
DISCUSIÓN
La concentración proteica obtenida en macroquistes grandes (3.23 mg/ ml) y pequeños (2.45 mg/ml) fueron menores a los reportados por Mansilla (1993) y Sam et al. (1999), quienes trabajaron con todo el quiste sin diferenciar tamaños y cubiertas, y llegaron a obtener entre 5.6 a 6.4 mg/ml. La menor concentración proteica obtenida en el estudio se debió a la forma de extracción de los cistozoitos de sus quistes, contando con una escasa cantidad de cubierta.
La dosis de 0.05 mg/kg de proteína antigénica administrada a conejos fue la dosis ideal empleada en un estudio sobre el efecto tóxico de quistes de S. aucheniae de diverso tamaño (Chileno, 2009). Se optó por esta dosis debido a que concentraciones muy pequeñas podrían producir tolerancia (Arce et al., 2007).
En la inactivación del antígeno para la obtención del suero hiperinmune se siguió inicialmente la técnica descrita por Sam et al. (1998) con formol al 0.4%; sin embargo, los conejos presentaron signos clínicos de postración, disnea, pupila contraída, etc, compatibles con intoxicación por sarcocistina (Sam et al., 1998). Esto probablemente fue debido a que el antígeno se extrajo en el estudio original mediante el machacado de los cistozoitos y de sus cubiertas, en tanto que en el presente estudio el contenido de los cistozoitos se obtuvo con ayuda de una jeringa de tuberculina y se tuvo escasa cantidad de cubierta. Debido a esto, se varió la concentración de formol a 4% (Labeque et al., 2003) sin resultados favorables, y finalmente a 10%, donde se logró la supervivencia de los animales inoculados y, consecuentemente, la inactivación de la sarcocistina.
En la inmunización de los conejos, en los protocolos II y III, se utilizó las vías de inoculación subcutánea e intramuscular en forma simultánea a partir del día 16. Este manejo tuvo la ventaja de presentar el antígeno por dos vías, teniéndose mayores probabilidades de obtener una mayor respuesta inmune. Por otro lado, para incrementar la fagocitosis de las proteínas y, consecuentemente, la respuesta inmune, se emplearon adyuvantes cuya función es retardar la liberación del antígeno y favorecer su captación por los macrófagos, ayudando de esta forma a presentar el antígeno a los linfocitos T. Estos actúan inicialmente protegiendo al antígeno de una dispersión rápida atrapándolos en un depósito local y, además, al contener substancias que estimulan la respuesta inmune del huésped, logran reclutar macrófagos al sitio donde se halla depositado el antígeno, incrementando la proporción local de fagocitosis (Arce et al., 2007).
El adyuvante Freund completo, al estar compuesto por una emulsión salina en aceite mineral con micobacterias (Mycobacterium tuberculosis) muertas por calor, induce la producción de granulomas. Debido a esto, y para evitar efectos indeseados en los animales inoculados, solo se aplicó en la primera y última fase de los protocolos, mientras que en los refuerzos se usó generalmente el adyuvante Freund incompleto.
En el Protocolo I, donde se tuvo un mes de inoculación con antígeno inactivado con formol al 10% se produjo una respuesta total, tanto para los antígenos provenientes de macroquistes grandes como de pequeños, garantizando la producción de anticuerpos al comparar con los otros protocolos que no ofrecían igual respuesta; sin embargo, la mortalidad de los conejos fue de cerca de 50%, lo que en la práctica limitaría el número de animales que sobrevivirían para la obtención de suero. Las muertes posiblemente se debieron a la insuficiente producción de anticuerpos que mostraron los animales, sin tener la protección contra las toxinas de Sarcocystis.
El efecto térmico, según algunos autores, es considerado uno de los métodos de elección frente al de formol debido a que contribuye a la eliminación de posibles contaminantes y, además, no se emplean sustancias dañinas para el humano (Marín, 1993; Labeque et al., 2003). Nakamura et al. (1999) pudieron demostrarlo en el caso de Sarcocystis cruzi, donde la fracción proteica termolábil era responsable de la toxicidad observada; sin embargo, esto no pudo ser corroborado en el presente estudio, donde los tres protocolos fueron efectivos para producir anticuerpos.
Por otro lado, Labeque et al. (2003) demostraron que el mejor protocolo para la inactivación de antígeno fue la aplicación del tratamiento térmico (inactivación en baño María a 100 °C), aunque la limitante resultaría ser el tiempo que deberían mantenerse las proteínas en temperaturas altas, debido a que un exceso podría provocar la desnaturalización de los componentes celulares termolábiles como las proteínas y también los LPS termoestables responsables de la respuesta inmunológica. Por lo tanto, el factor de manipulación de la temperatura en este estudio pudo influir en el resultado ya que las muestras procesadas eran dependientes del tiempo utilizado en la inactivación térmica (Marín, 1993).
Se puede concluir que los extractos de proteínas antigénicas provenientes de macroquistes grandes (>5 mm) de S. aucheniae presentaron una mayor respuesta inmune que los provenientes de macroquistes pequeños (1-3 mm) al usar tres protocolos de inmunización; sin embargo, no se observó asociación entre protocolos y reacción Ag-Ac al análisis de Fisher.
LITERATURA CITADA
1. Arce A, Rosas A, Rodríguez L. 2007. Práctica de inmunología general aplicada y veterinaria. México: Manual Moderno. 276 p.
2. Bonilla C, Zavaleta A. 1997. Estudio biquímico del veneno de la serpiente Bothrops hyoprorus. Rev Med Exp 14: 2-3.
3. Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 72: 248-254.
4. Castro J. 1974. Sarcocystis aucheniae en llamas (Lama glama). Rev Inv Pec IVITA 3(1): 91-92.
5. Cornejo R, Chávez A, Leyva V, Falcón N, Panez S, Ticona D. 2007. Viabilidad de los diferentes tamaños de macroquistes de Sarcocystis aucheniae en Canis familiaris. Rev Inv Vet, Perú 18: 78-83.
6. Chileno M. 2009. Evaluación de los efectos tóxicos del contenido de dos tamaños de quistes de Sarcocystis aucheniae en conejos inoculados experimentalmente. Tesis de Médico Veterinario. Lima: Univ Nac Mayor de San Marcos. 91 p.
7. De Jesús R, Quiñónez W, Callaghan J. 1999. Identificación de proteínas de la membrana de Leishmania mexicana con fines de diagnóstico. Rev Ecol Latinoam 6: 9-17.
8. García M, Erosa G, Núñez G. 2000. Identificación del origen de especie animal en carne fresca utilizando inmunodifusión doble. Tec Pec México 38: 231-237.
9. Guerrero D, Hernández J. 1967. Ciclo evolutivo del Sarcocystis. Bol Extraordinario IVITA II: 70-71.
10. Hung A. 2006. Avances de Sarcocystis en camélidos sudamericanos. CONCYTEC Avances de proyectos de investiga- ción. [Internet] [12 enero 2009]. Disponible en: http://tumi.lamolina.edu.pe/estrategia/descarga/archivo2.pdf
11. Labeque Y, Cobas G, Morris H, Verdecía A, Camacho M. 2003. Utilización de formaldehído y tratamiento térmico en la inactivación de cultivos de Pseudomona aeruginosa. Rev Cub Biomed 22: 232-236.
12. Lange S, Elwing H, Larsson P, Nygren H. 1980. Comparison of diffusion-in-gel enzyme-linked immunosorbent assay with conventional serological methods for detection of class-specific antibodies to Salmonella typhi O antigen. J Clin Microbiol 12: 637-640.
13. Leguía G, Guerrero C, Sam R, Chávez A. 1989. Infección experimental de perros y gatos con micro y macroquistes de Sarcocystis de alpacas (Lama pacos). Rev Cienc Vet, Lima 5: 10-13.
14. Mansilla A. 1993. Efecto del lisado de macroquistes de Sarcocystis aucheniae en ratones, cobayos y conejos. Tesis de Médico Veterinario. Lima: Univ Nac Mayor de San Marcos. 50 p.
15. Marín M. 1993. Efecto del tratamiento térmico en la hidrofobicidad, en los grupos- SH, en la antigenicidad y en la capacidad de ligar grasa de las proteínas cárnicas. Tesis Doctoral. Madrid: Facultad de Medicina Veterinaria, Univ Complutense de Madrid. 205 p.
16. Medrano G, Hung A, Rubio N. 2006. Detección molecular temprana de Sarcocystis en el animal vivo y su estudio filogenético basado en el análisis del gen SSU rRNA en alpacas en Perú. Mosaico Cient 3(2): 5-9.
17. Nakamura T, Saito M, Shibata Y, Itagaki H. 1999. Induction of tumor necrosis factor and nitric oxide in rabbits inoculated with a cyst extract of Sarcocystis cruzi. Vet Parasitol 38: 236-243.
18. Sam R. 1988. Sarcocystis aucheniae: caracterización parcial de componentes antigénicos y patología clínica experimental en alpacas. Tesis doctoral. Lima: Univ Nac Mayor de San Marcos. 118 p.
19. Sam R, Mansilla I, Morales C, Ramírez A. 1998. Efecto tóxico de macroquistes de Sarcocystis aucheniae en ratones, cobayos y conejos. Rev Inv Pec, IVITA 9: 11-18.
20. Sam R, Gonzáles A, López T, Verástegui P. 1999. Desarrollo de un método de electroinmunotransferencia para la detección de anticuerpos anti Sarcocystis aucheniae en alpacas. Rev Inv Vet, Perú 10: 82-85.
21. Vilca M. 1991. Producción, tecnología e higiene de la carne. En: Avances y perspectivas del conocimiento de los camélidos sudamericanos. Santiago de Chile: FAO. p 387-471.
22. White S. 1998. Sarcocystis: A parasite endemic to Andean alpacas. Vol III. Nº 1. The Alpaca registry Journal. [Internet] [12 setiembre 2009]. Disponible en: www.alpacaregistry.net/journal/win98j-12.html