Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.2 Lima abril./jun 2012
COMUNICACIÓN
FRECUENCIA DE LEPTOSPIRA SPP EN PORCINOS DE CRIANZA TECNIFICADA Y DE TRASPATIO BENEFICIADOS EN DOS MATADEROS DE LIMA
FREQUENCY OF LEPTOSPIRA SPP IN PIGS FROM COMMERCIAL FARMS AND BACKYARD BREEDING SLAUGHTERED IN TWO ABATTOIRS OF LIMA
Luis Anampa V.1, Hermelinda Rivera G.1,3, Néstor Falcón P.2, Mariluz Arainga R.1, Mercy Ramírez V.1
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia, Lima
3 E-mail: hriverag2005@yahoo.es
RESUMEN
El objetivo del estudio fue determinar la frecuencia de anticuerpos contra Leptospira spp en porcinos provenientes de crianza tecnificada (5 granjas, n=163) y de traspatio (11 criaderos, n=133) del valle de Lima. Se colectaron muestras de sangre de porcinos (n=296) durante el beneficio en dos mataderos de la ciudad de Lima, para la detección de anticuerpos contra ocho serovares de Leptospira mediante la prueba de microaglutinación. El 85.8 ± 3.9% (254/296) de las muestras fue positivo a uno o más serovares de Leptospira. El 89.6 ± 4.7% (146/163) y el 82.1 ± 6.5% (108/133) de las muestras de porcinos de crianza tecnificada y de traspatio, respectivamente, tuvieron anticuerpos contra Leptospira. Los serovares icterohaemorrhagiae, pomona y georgia fueron los más frecuentes en ambos tipos de crianza. No se detectaron anticuerpos contra los serovares bratislava y grippothyphosa. Los títulos de anticuerpos tuvieron un rango entre 100 a 400 en ambos tipos de crianza, pero títulos de anticuerpos de 800 a 1600 fueron detectados con mayor frecuencia en animales de traspatio. La combinación icterohaemorrhagiae y pomona fue la más común en ambos tipos de crianza. No hubo asociación entre la presencia de anticuerpos contra Leptospira y la procedencia de los porcinos evaluados.
Palabras clave: porcinos, crianza de traspatio, microaglutinación, anticuerpos, Leptospira spp
ABSTRACT
The objective of this study was to determine the frequency of antibodies against Leptospira spp in pigs reared in five well-managed farms (n=163) and from 11 backyard breeding (n=133) owners in the Lima valley, Peru. Blood samples (n=296) were collected in two slaughterhouses for antibody detection against eight serovars of Leptospira by microaglutination test. The 85.8 ± 3.9% (254/296) of samples had antibodies against one or more serovars of Leptospira. The 89.6 ± 4.7% (146/163) and 82.1 ± 6.5% (108/133) of samples from well-managed farms and from backyard breeding pigs showed antibodies against Leptospira spp. The serovars icterohaemorrhagiae, pomona, and georgia were the most frequently detected in both groups of pigs. No antibodies were detected against serovars bratislava and grippothyphosa. Antibody titres ranged from 100 to 400, being the highest titles (800 to 1600) detected more frequently in backyard breeding pigs. Serovars icterohaemorrhagiae and pomona were the most common mixed infections found for both type of breeding systems. There were no association between antibodies against Leptospira and type of pig breeding system.
Key words: pigs, backyard breeding, microaglutination, antibodies, Leptospira spp
INTRODUCCIÓN
La población porcina del Perú es de aproximadamente 2 500 000 animales. El 14.6% constituyen porcinos de razas definidas, criados con una adecuada tecnología y las granjas se encuentran ubicadas principalmente en la costa. El resto son porcinos cruzados o de razas mejoradas pero criados sin tecnología moderna en la sierra, selva y parques porcinos (Censo Nacional Agropecuario, 1995).
En las últimas décadas, la porcicultura nacional está presentando un creciente desarrollo como actividad comercial (Kalinowski, 2004); sin embargo, la producción porcina proveniente de crianzas familiares tiene gran importancia socioeconómica, por lo que debe estudiarse los factores que limitan su desarrollo, entre estos, las enfermedades infecciosas.
Diversas enfermedades virales y bacterianas pueden afectar la producción y reproducción porcina. La leptopsirosis causa importantes pérdidas económicas y es de riesgo potencial para la salud humana por ser una zoonosis (Miller et al., 1990; Bharti et al., 2003; Almenteros et al., 2004; Vijayachari et al., 2008). Es causada por la Leptospira, una bacteria que posee más de 200 serovariedades. Este germen posee actualmente una nueva clasificación que incluye los serovares de leptospiras patógenas y saprófitas (Levett, 2001).
En el porcino, la bacteria ocasiona repetición del celo, abortos en el tercio final de la gestación, momificación fetal, mortinatos, nacimiento de lechones débiles, y reducción del tamaño de la camada, entre otros (Delbem et al., 2004; Naito et al., 2007).
A pesar de la reconocida importancia de la leptospirosis, la información sobre su prevalencia en porcinos del país es escasa. Por este motivo, el presente estudio tuvo como objetivo determinar la frecuencia de Leptospira spp en porcinos provenientes de crianza tecnificada y de traspatio beneficiados en dos mataderos de la ciudad de Lima. En uno de los mataderos se benefician cerdos provenientes de granjas tecnificadas y en el otro se benefician principalmente porcinos criados en traspatio.
MATERIALES Y MÉTODOS
El estudio fue realizado en porcinos de granjas tecnificadas del valle de Lima y de porcinos criados en traspatio ubicadas al norte de la ciudad de Lima. Se colectaron 163 muestras de sangre de porcinos de 130 a 150 días de edad, de ambos sexos, de cinco granjas tecnificadas (aproximadamente 30 muestras por granja) y 133 muestras de sangre de porcinos de traspatio de 11 criadores. Los sueros fueron obtenidos por centrifugación a 800 g por 5 min, envasado en viales y conservado a -20 °C.
Se utilizaron ocho serovares de Leptospiras como antígeno vivo (pomona, bratislava, canicola, grippothyphosa, ballum, tarassovi, georgia e icterohaemorrhagie) para la detección de anticuerpos mediante la técnica de microaglutinación (MAT), prueba de referencia para el diag nóstico de leptospirosis, según el protocolo descrito por el Organismo Mundial de Salud Animal (OIE, 2006). La frecuencia de infección fue expresada en porcentaje y con un intervalo de confianza del 95% (Thrusfield, 1990). El efecto de asociación entre las variables sistema de crianza sobre la presencia de anticuerpos contra Leptospira spp se evaluó con la prueba de Chi cuadrado.
RESULTADOS
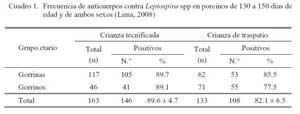
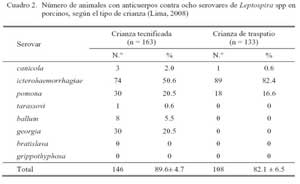
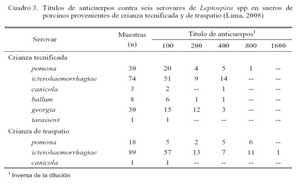
El 85.8 ± 3.9% (254/296) de las muestras resultaron positivas a anticuerpos contra uno o más serovares de Leptospira spp (Cuadro 1). El 89.6 ± 4.7% de sueros provenientes de crianza tecnificada y el 82.1 ± 6.5% provenientes de crianza de traspatio tuvieron anticuerpos contra Leptospira spp, donde los serovares icterohaemorrhagiae, pomona y georgia fueron los más frecuentes en ambos tipos de crianza (Cuadro 2). Los títulos de anticuerpos contra los serovares evaluados se presentan en el Cuadro 3.
DISCUSIÓN
La alta frecuencia de anticuerpos contra Leptospira spp en la población bajo estudio indica que la Leptospira es una bacteria de amplia presencia en las granjas porcinas; asimismo, la similar frecuencia de anticuerpos contra Leptospira en porcinos de granjas tecnificadas y de traspatio indican factores comunes presentes en ambos sistemas de crianza y que pudieron contribuir en el mantenimiento de la infección, como la presencia de roedores o una deficiencia en el manejo sanitario en las granjas tecnificadas de donde procedieron las muestras.
Los serovares detectados con mayor frecuencia en ambos sistemas de crianza fueron icterohaemorrhagiae, pomona y georgia (Cuadro 1). Se conoce que el cerdo es un hospedador natural del serovar pomona (Chappel et al., 1998) y que los roedores son hospedadores naturales del serovar icterohaemorrhagiae, pero ambos serovares pueden infectar a cualquier especie animal, incluyendo al hombre. La alta frecuencia del serovar icterohaemorrhagiae en ambos tipos de crianza indica la existencia de un factor común que sería la presencia de roedores. Otro de los serovares que se asocia al porcino es bratislava, pero este serovar, así como el serovar grippothyphosa no fueron detectados en el presente estudio.
La frecuencia de anticuerpos contra icterohaemorrhagiae, pomona y georgia es superior a las reportadas en otros estudios en porcinos (Chappel et al., 1998; Ochoa et al., 2000; Cisneros et al., 2002). Se menciona que en crianzas porcinas con problemas reproductivos, la prevalencia de leptospirosis tiende a incrementar (Miller et al., 1990), pero este concepto no sería válido para la población de porcinos muestreados, ya que se trabajó con animales destinados al mercado.
Los títulos de anticuerpos contra Leptospira en porcinos de ambos tipos de crianza estuvieron entre 100 y 400, pero se llegó hasta 800 y 1600, sobre todo en animales de traspatio (Cuadro 3). Se dispone de escasa información sobre la cinética de anticuerpos leptospirales, tanto en animales vacunados como no vacunados. En un estudio reciente en marranas, se evaluó dos tipos de bacterinas conteniendo cinco serovares de Leptospira, encontrándose que los títulos de anticuerpos neutralizantes fueron bajos y que la inmunidad pasiva fue de corta duración (Soto et al., 2007). En este sentido, los títulos detectados en el presente estudio sugieren que los animales tuvieron un desafío reciente o una infección activa, ya que los animales recientemente infectados pueden desarrollar títulos de anticuerpos superiores a 800 en 1-2 semanas posteriores a la infección (The Pig Site, 2009).
Los serovares pomona, icterohaemorrhagiae e incluso canicola han sido detectados en porcinos (Ochoa et al., 2000; Cisneros et al., 2002). Las infecciones con pomona son predecibles en porcinos ya que son más frecuentes en esta especie. Además, en todo establecimiento ganadero, los roedores hospederos del serovar icterohaemorrhagiae están presentes. Por otro lado, los canes hospederos del serovar canicola pueden ingresar o estar cerca de los establecimientos cuando las medidas de bioseguridad no existen o no son estrictas. La detección de anticuerpos contra el serovar georgia en porcinos es intrigante pues no es usual su detección en esta especie; siendo mayormente detectado en perros, búfalos de agua, bovinos, caballos y humanos (Céspedes et al., 2004; Adesiyun et al., 2009), de allí que es posible que se trate de una reacción cruzada con otro serovar no incluido en el presente estudio, como el serogrupo sejroe (Clerc et al., 2002).
Muchos de los animales de ambos tipos de crianza tuvieron anticuerpos a más de un serovar, siendo más frecuente la combinación icterohaemorrhagiae y pomona. Los animales pueden infectarse con más de un serovar y estas infecciones pueden detectarse debido a que los anticuerpos son serovar específicos; sin embargo, los títulos bajos de anticuerpos pueden ser respuestas cruzadas con miembros de otro serogrupo (género específicos), pero títulos de anticuerpos de 200 o más indican infecciones por los respectivos serovares-específicos (Sambasiva et al., 2003). Finalmente, no se encontró asociación significativa entre la presencia de anticuerpos contra Leptospira y el tipo de crianza.
LITERATURA CITADA
1. Adesiyun AA, Hull-Jackson C, Clarke N, Whittington C, Seepersadsingh N. 2009. Leptospirosis in water buffalo (Bubalus bubalis) in Trinidad. Vet Arhiv 79(1): 77-86.
2. Almenteros C, Arrieta G, Máttar S, Barguil A, Tamayo L, Padilla T, Bedoya Z, et al. 2004. Seroprevalencia de leptospirosis porcina en el departamento de Córdoba. Rev Col Cienc Pec 17: 141-147.
3. Bharti AR, Nally JE, Ricaldi JN, Matthias MA, Diaz MM, Lovett MA, Levett PN, et al. 2003. Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis 3: 757-771.
4. Censo Nacional Agropecuario. 1995. Instituto Nacional de Estadística e Informática. Lima: INEI. 54 p.
5. Céspedes M, Fernández R, Rimarachín R, Taipe H, Cenepo J, Mori M, Torres I, et al. 2004. Leptospirosis: una enfermedad zoonótica hiperendémica en la provincia de Coronel Portillo. Ucayali, Perú. Rev Peru Med Exp Salud Pública 21(2): 62-70.
6. Chappel RJ, Prime RW, Millar BD, Jones RT, Cutler RS, Adler B. 1998. Prevalence and geographic origin of pigs with serological evidence of infection with Leptospira interrogans serovar pomona slaughtered in abattoirs in Victoria, Australia. Vet Microbiol 62: 235-242.
7. Cisneros MA, Moles LP, Gavaldon D, Rojas N, Torres JI. 2002. Serología diagnóstica de leptospirosis porcina en México 1995-2000. Rev Cubana Med Trop 54: 28-31.
8. Clerc K, Aidorevich L, Tkacheek O, Marquez N. 2002. Aislameinto de Leptospira interrogans en vacas mestizas Holstein en el Municipio Girardot del Estado Aragua Brasil. Rev Fac Cs Vet 43: 95-105.
9. Delbem AC, Freire RL, Da Silva CA, Müller EE, Dias RA, Neto JS, Freitas JC. 2004. Fatores de risco associados à soropositividade para leptospirose em matrizes suínas. Cienc Rural 34: 847-852.
10. Kalinowski J. 2004. Situación de la porcicultura en el Perú. Aves & Cerdos 4: 29-33.
11. Levett PN. 2001. Leptospirosis. Clin Microbiol Rev 14: 296-326.
12. Miller DA, Wilson MA, Owen WJ, Beran GW. 1990. Porcine leptospirosis in Iowa. J Vet Diagn Invest 2: 171-175.
13. Naito M, Sakoda Y, Kamikawa T, Nitta Y, Hirose K, Sakashita M, et al. 2007. Serological evidence of leptospiral infection in pig populations in different districts in Japan. Microbiol Immunol 51: 593-599.
14. Ochoa JE, Sánchez A, Ruiz I. 2000. Epidemiología de la leptospirosis en una zona andina de producción pecuaria. Rev Panam Salud Pública 7: 325-331.
15. [OIE] Organismo Mundial de Salud Animal. 2006. Manual de la OIE sobre animales terrestres: Manual de pruebas de diagnóstico y de las vacunas para los animales terrestres. EEUU: OIE. 1263 p.
16. Sambasiva RR, Naveen G, Bhalla P, Agarwal SK. 2003. Leptospirosis in India and rest of the world. Braz J Infect Dis 7: 178-193.
17. Soto FRM, Vasconcellos SA, Pinheiro SR, Bernasi F, Camargo SR. 2007. Lestospirose suína (Revisión). Arq Inst Biol 74: 379-395.
18. The Pig Site. 2009. Leptospirosis. [Internet], [17 octubre 2009]. Disponible en: http://www.thepigsite.com/pighealth/article(451/leptospirosis
19. Thrusfield M. 1990. Epidemiologia veterinaria. Zaragoza: Acribia. 352 p.
20. Vijayachari P, Sugunan AP, Shriram AN. 2008. Leptospirosis: an emerging global public health problem. J Biosci 33: 557-569.