Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.23 no.3 Lima Aug. 2012
ARTÍCULO DE REVISIÓN
Avances en el estudio de la patogénesis y prevención de la enterotoxemia de las alpacas
Advances on pathogenesis and prevention of enterotoxemia of alpacas
Raúl Rosadio A.1,2,3, Lenin Maturrano H.1,2, David Pérez J.2, Hugo Castillo D.2, Álvaro Véliz A.2, Luis Luna E.2, Katherine Yaya L.2, Pablo Londoñe B.2
1 Unidad de Biología y Genética Molecular, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Av. Circunvalación 2800, San Borja, Lima 41, Perú
2CONOPA – Instituto de Investigación y Desarrollo de Camélidos Sudamericanos, Jr. Centenario 195, Block C-201, Urb. Las Laderas de Melgarejo, La Molina Lima, 12, Peru
3 E-mail: rrosadio@gmail.com
RESUMEN
Se revisan las investigaciones recientes realizadas por nuestro grupo de investigadores sobre enterotoxemia de las alpacas en el Perú. Estudios microbiológicos y moleculares demostraron que la mayoría de las cepas aisladas fueron de Clostridium perfringens y estas contienen únicamente el gen cpa de la toxina α(C. perfringens genotipo A) y solamente el 0.4% tienen genes cpa y cpb de las toxinas α y β (genotipo C). En análisis paralelo, se encontró que el 8.5% de los genotipos A contenían, adicionalmente, el gen cpb2, pero ninguna cepa tenía el gen cpe de la enterotoxina. Estos resultados evidencian que las exotoxinas secretadas, y no las endotoxinas (cpe), serían los probables factores de virulencia clostridiales en la enterotoxemia de la alpaca. Adicionalmente, en el análisis histopatológico de intestinos infectados, el 30.6% de las muestras presentó abundantes estructuras parasitarias inmaduras correspondientes a Eimeria macusaniensis, afectando la mucosa y epitelio de las glándulas crípticas intestinales, sugiriendo a las infecciones coccidiales como uno de los posibles factores desencadenantes o predisponentes de la enterotoxemia. Estos resultados microbiológicos permitieron diseñar, preparar y mejorar una vacuna convencional inactivada que contiene, mayoritariamente, componentes bacterianos y exotoxinas A, Aβ2 y C aislados de casos fatales de la enfermedad. Desde su introducción en una empresa alpaquera del sur peruano en 2001, la vacuna ha logrado reducir progresivamente los índices de mortalidad por enterotoxemia de 19.5% (2000, sin vacuna) hasta alcanzar tasas menores al 5% en 2006.
Palabras clave: C. perfringens, genotipificación, vacuna, enterotoxemia, alpaca
ABSTRACT
The results of our recent research work on enterotoxemia in Peruvian alpacas are presented. Microbiological and molecular analyses found that the majority of the isolates corresponded to Clostridium perfringens and contained the cpa coding gene for α toxin (A genotype) while 0.4% contained both the cpa and cpb genes of the α and β toxins (C genotype). A parallel study revealed that 8.5% of the genotype A isolates also had cpb2, but the cpe (enterotoxin) gene was absent in all cases. These results highly suggest that the exotoxins secreted by C. perfringens are the virulent factors in enterotoxemia, rather than the endogenous enterotoxin. Additionally, an histopathological study of intestinal samples from fatal cases showed that 30.6% had abundant immature structures of Eimeria macusaniensis affecting deep mucosa and cryptic gland epithelia, primarily in the jejune and ileum, suggesting that eimeriosis is likely a triggering or predisposing factor for the development of enterotoxemia. The microbiological studies allowed the design and progressive improvement of an inactivated enterotoxemia vaccine containing primarily the bacterial component plus exotoxins of types A, Aβ2 and C isolated from natural fatal cases of the disease. During six years of field tests in southern Peru, the vaccine has steadily reduced specific neonatal mortality rates due to enterotoxemia from 19.5% (2000, without vaccine) to less than 5% in 2006.
Key words: Clostridium perfringens, genotyping, vaccine, enterotoxemia, alpaca
INTRODUCCIÓN
El Perú tiene más de cuatro millones de alpacas (Vicugna pacos) y es el primer productor de esta especie en el mundo. La alpaca, desde su domesticación en los Andes centrales, hace 7000 años, cumple un rol importante en la economía rural (Wheeler, 1995), pues más de 250 000 comunidades campesinas localizadas por encima de los 3800 msnm dependen de la crianza de la alpaca como su principal o única fuente de ingresos. Estudios arqueológicos han demostrado la ocurrencia de alta mortalidad neonatal durante el proceso de domesticación y, al parecer, este problema sigue vigente, limitando seriamente la adecuada explotación de la alpaca en ambientes climáticos extremos como los Andes peruanos (Wheeler, 1995).
En el Perú, las enfermedades infecciosas inciden negativamente en el desarrollo de la industria alpaquera, y la enterotoxemia es todavía la principal causa de altas mortalidades, particularmente en explotaciones alpaqueras del sur peruano (Ameghino y DeMartini, 1991). A pesar que la enterotoxemia tiene un gran impacto negativo en la explotación alpaquera en el país, se conoce muy poco sobre la patogenicidad de la infección bacterial y sobre los mecanismos, de existir, desencadenantes de la enfermedad.
El Agente Causal
Es ampliamente aceptado que la enterotoxemia, la infección más devastadora en las poblaciones neonatas, es usualmente causada por Clostridium perfringens tipo A y raramente por el tipo C (Moro, 1987). La enfermedad, descrita inicialmente a mediados del siglo pasado, se caracteriza por presentaciones epizoóticas en los Andes peruanos, en forma cíclica cada 4-5 años, con mortalidades de hasta 70%, afectando principalmente crías de 2 a 9 semanas de edad (Ameghino y DeMartini, 1991; Ramírez, 1991). La presentación clínica de la enfermedad corresponde a una toxemia fatal producto de una enteritis hemorrágica o necrótica selectiva del yeyuno e íleon (Ramírez et al., 1985; Moro, 1987; Ameghino y DeMartini, 1991; Palacios et al., 2006).
La bacteria es un bacilo gram positivo, anaerobio facultativo, móvil y formador de esporas. Forma parte de la flora bacteriana del suelo y tracto intestinal de animales y el hombre, y tiene la capacidad de producir varias enfermedades en animales y el hombre (Hatheway, 1990; Songer, 1996). A este agente se le ha dividido tradicionalmente en cinco tipos, basados en la habilidad de producir una o más de las cuatro toxinas mayores (α, β, ε, e y Ǯ). El tipo A produce solamente la toxina α; el B, toxinas α, β y ε; el C, toxinas α y β; el D, toxinas α y ε; y el tipo E, las toxinas α y Ǯ(Hatheway, 1990; Petit et al., 1999). La tipificación convencional de las cepas dependía de la actividad biológica de las toxinas producidas por inoculaciones parenterales en animales de laboratorio; sin embargo, en la actualidad se cuentan con pruebas moleculares más rápidas, dependientes de la detección de los genes productores de las respectivas toxinas.
Los métodos de tipificación genotípica se realizan en una sola prueba (PCR múltiple), capaz de amplificar cualquiera de las toxinas mayores, incluyendo toxinas secundarias, tales como la enterotoxina (cpe) y una nueva variante denominada β2. La detección de los genes codificantes de todas estas toxinas permite tipificar y subtipificar las cepas bacterianas aisladas de casos patológicos.
A pesar de que existe concordancia en aceptar que el tipo A es la principal causa de la enfermedad, todavía persisten discrepancias sobre si la toxina α es la única responsable de las alteraciones patológicas fatales. Por mucho tiempo se especuló que la enterotoxina (cpe), endotoxina producida durante la fase de esporulación, era la responsable de la enfermedad (Ramírez, 1987); pero estudios recientes, tienden a implicar preferentemente a las exotoxinas clásicas (Prehn et al., 1999) y, tal vez, a la toxina variante 2 de la patogenicidad bacterial y patologías intestinales (Bueschel et al., 2003).
Identificación de Genes de Toxinas Clostridiales
Durante las campañas de parición de 2005 a 2007 en ganaderías alpaqueras de los Andes peruanos, se logró aislar 234 cepas de C. perfringens de 132 alpacas neonatas muertas por enterotoxemia (Pérez, 2006; Rosadio et al., 2008). Los animales provinieron de 22 fundos/hatos de los departamentos de Puno (n=60 muestras), Arequipa (n=36), Cusco (n=31) y Huancavelica (n=5). Todos estos aislados correspondieron a Clostridium basados en la morfología de colonia, patrones hemolíticos, coloración Gram y pruebas de catalasa negativa. Estas cepas fueron sometidas a caracterizaciones bioquímicas, demostrando que 219 cepas mostraron actividad enzimática (positivos a la reacción de Nagler) asociada a producción de toxina alfa, y el 87% (190/219) redujo el sulfito en Agar Triptosa Sulfito Cicloserina (TSC) enriquecido con yema de huevo, característica del C. perfringens (Tilball et al., 1999).
Análisis moleculares posteriores (Pérez 2006; Rosadio et al., 2008), realizados en 1-3 colonias de cada aislado positivo, revelaron que 223/224 (99.6%) de las cepas contenían únicamente el gen cpa codificante de la toxina α(C. perfringens genotipo A) y solamente una de estas cepas (0.4%) fue positiva a la presencia de ambos genes (cpa y cpb) codificantes de las toxinas αy β, que corresponden al genotipo C. En un análisis paralelo en todas estas cepas se detectaron genes de toxinas secundarias (subtipificación), indicando que el 91% de los aislados pertenecientes al genotipo A no tenían genes codificantes de la cpe ni el gen variante cpb2. Las 19 restantes (8.5%) mostraron, además, la presencia del gen cpb2 pero negativos al gen cpe. La cepa perteneciente al genotipo C fue la única cepa positiva al gen cpe pero negativo para el cpb2. Estos resultados evidencian que las exotoxinas secretadas, y no las endotoxinas (cpe), serían los probables factores de virulencia clostridiales productores de fatalidades en la enterotoxemia de la alpaca.
La evidencia de que más del 90% de los aislados correspondieron al C. perfringens genotipo A, subtipo cpe-vocpb2-vo (cpe y cpb2 negativos) (Pérez, 2010), indican que la sola expresión del gen cpa (toxina α), sea tal vez suficiente para el establecimiento y desarrollo de la enfermedad. Similares evidencias patológicas se describen en enteritis necrótica en pollos y cerdos (Kanakaraj et al., 1998; Engström et al., 2003; Gholamiandekhordi et al., 2005), enterotoxemia en corderos y terneros (Dennisson et al., 2005; Kalender et al., 2005) y gastroenteritis hemorrágica en perros (Songer, 1996), demostrando la capacidad de la toxina α para producir alteraciones intestinales fatales en animales domésticos y en algunas especies de animales silvestres (R. Rosadio, datos no publicados).
La detección del gen codificante de la toxina secundaria β2 demuestra la gran diversidad genética de la bacteria para producir toxinas potencialmente patogénicas. El gen cpb2 ha sido identificado en animales domésticos, incluyendo la alpaca (Bueschel et al., 2003). En nuestro estudio (Rosadio et al., 2008), 19/204 de las cepas genotipificadas como tipo A contenían, además, el gen cpb2, cepas denominadas como tipo A subtipo β2 toxigénico (cpe-vocpb2+vo). La potencial patogenicidad de la toxina β2 no está bien elucidada, pero ha sido descrita en diversas patologías en varias especies de animales. Este subtipo está presente en el 90% de aislados en lechones padeciendo enteritis necrótica (Garmory et al., 2000; Bueschel et al., 2003); 50-75% en enterocolitis en potrillos (Herholz et al., 1999; Garmory et al., 2000); enterotoxemia en terneros, cabritos y cervatos (Manteca et al., 2002; Dray, 2004; Embury-Hyatt et al., 2005), y en la disentería hemorrágica en corderos (Gkiourtzidis et al., 2001). Asimismo, se encontró en el 41.6% (15/36) de cepas aisladas de crías de un hato del sur del país con historia de brotes de enterotoxemia durante los años previos a la toma de muestras (R. Rosadio, datos no publicados). Esto sugiere que la toxina β2 podría ser uno de los factores que utilizaría la bacteria para producir fatalidades entéricas neonatales.
La escasa detección de cepas conteniendo el gen cpe cuestiona el rol de la enterotoxina en la patogénesis de la enfermedad. Durante décadas se propuso que el C. perfringens tipo A utilizaba la enterotoxina (cpe) como factor patogénico para el desencadenamiento de la enfermedad (Ramírez, 2001). Se especulaba que la bacteria durante la fase de esporulación intraintestinal activaba la producción toxigénica desencadenando la infección fatal en los animales. Sin embargo, las infecciones por C. perfringens productores de enterotoxina en hospederos inmunocompetentes se asocian, generalmente, con diarreas esporádicas, autolimitantes o profusas, productos de alteraciones en la permeabilidad intestinal atribuidas a esta toxina (McClane, 2000; Sparks et al., 2001). Esta sintomatología es distinta a la patología clásica de la enterotoxemia en alpaca, que se caracteriza en la fase terminal, donde se observan constipaciones intestinales y, a veces, diarrea.
La casi nula detección del cpe en cepas aisladas en animales con enterotoxemia durante cuatro años de muestreos, ha permitido sugerir a las exotoxinas como posibles factores de virulencias causantes de los cambios patológicos asociados con la enfermedad. El rol de exotoxinas en la patogenicidad de la enfermedad se sustenta, además, en los ensayos exitosos de campo de una vacuna inactivada convencional. La vacuna diseñada [componentes bacterianos más exotoxinas (anacultivo) sin presencia de la enterotoxina] ha logrado reducir tasas de mortalidad general y específica de la enterotoxemia (Yaya y Rosadio, 2005).
Si bien es cierto que la tecnología molecular ha logrado identificar a genes codificantes de exotoxinas primarias y secundarias (cpa, cpb y cpb2), la caracterización bioquímica y biológica de ambas toxinas todavía se encuentra en estudio, pero una gran mayoría de estas cepas produce, in vitro, hemolisis incompleta y reacción positiva a Nagler, demostrando claramente que la mayoría de estos aislados expresan actividad fosfolipasa, inherente a la expresión de la toxina α.
La caracterización bioquímica de 12 cepas ha demostrado variabilidad en la actividad fosfolipídica, observándose que la mitad de estas cepas son productoras de alta actividad fosfolipasa asociada con una buena actividad de lecitinasas (Pérez, 2010). Algunas de estas cepas son experimentalmente patogénicas a ratones por inoculación oral, y la toxina α, parcialmente purificada e inyectada por vía intraestinal, produce daño intestinal en ratones y conejos, pero fueron incapaces de producir lesiones similares en crías de alpacas (Pérez, 2010). Estos resultados evidencian que la enterotoxemia podría ser un complejo patológico producto de interacciones patológicas de infecciones primarias de patógenos intracelulares (Ejem. Eimeria spp o virus entérico), otras extracelulares y toxinas clostridiales.
Posible Factor Desencadenante de la Enterotoxemia
Desde que el C. perfringens tipo A es parte de flora normal intestinal, se especula la existencia de una variedad de poblaciones bacterianas con diferentes habilidades para expresar toxinas patogénicas. En este contexto, se señala la existencia de cepas avirulentas y otras con diversos matices de patogenicidad. Asimismo, la agresividad patogénica podría depender del rápido crecimiento bacterial y/o expresión del gen cpa, así como al estado de la integridad intestinal. Consecuentemente, es factible la posible existencia de factores biológicos y fisiológicos que pueden alterar la salud intestinal y desencadenar una patología digestiva. En este esquema, la búsqueda de patógenos intestinales en edades tempranas, inicialmente infecciones coccidiales, fue parte de los objetivos de nuestras investigaciones.
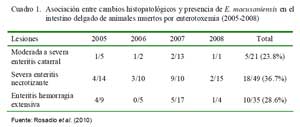
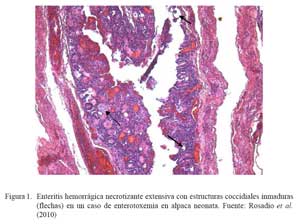
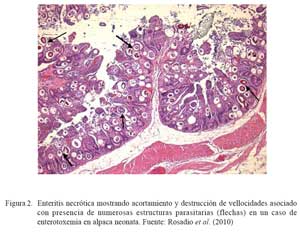
La identificación de posibles agentes biológicos desencadenantes de patología intestinal se realizó en 108 intestinos (103 íleon y 5 yeyunos) de animales muertos por enterotoxemia. Los animales procedían de los tres departamentos del sur peruano (Cusco, Puno y Arequipa) (Rosadio et al., 2010). Los estudios microscópicos revelaron cambios patológicos en la superficie del lumen del yeyuno e íleon. Se observó necrosis severa asociada con acortamiento y fusión de las vellosidades intestinales, así como congestión difusa y hemorragia focalizada de la mucosa (Cuadro 1; Fig. 1 y Fig. 2). En el 31% de las muestras se observó presencia de abundan- tes estructuras parasitarias inmaduras correspondiente a Eimeria macusaniensis, comprometiendo la mucosa y el epitelio de las glándulas crípticas en yeyunos e íleon (Fig. 1 y Fig. 2). En los 108 casos se aisló C. perfringens y la prueba de PCR múltiple amplificó genes de la toxina α(tipo A) y en 19 de estos, adicionalmente, se detectó la presencia del gen cpb2 (Pérez, 2006).
La coexistencia de eimeriosis en casos de enterotoxemia y diarreas fatales ha sido previamente reportada (Rosadio y Ameghino, 1994; Palacios et al., 2006); de allí que la identificación de estructuras parasitarias similares asociadas a cambios patológicos intestinales en el 30% de los casos estudiados, permiten indicar que las infecciones por Eimeria podrían ser uno de los factores desencadenantes o predisponentes para el establecimiento de la enterotoxemia de la alpaca.
El C. perfringens y algunas especies de Eimeria, en forma independiente, pueden establecerse y causar infecciones agudas fatales en animales neonatos; pero la coexistencia de ambos patógenos en el ambiente intestinal puede resultar en un aumento de las capacidades patológicas de cualquiera de estos agentes o uno de ellos predisponer la mayor capacidad infectiva del otro. En esta posible interacción, el Clostridium parecería no ser el agente predisponente a infecciones eimeriales, pues la destrucción de los enterocitos podría reducir la población celular necesaria para mantener una adecuada replicación coccidial. Sin embargo, los efectos citopáticos inherentes a la multiplicación coccidial, podría muy bien facilitar los nutrientes necesarios para iniciar la multiplicación bacterial y subsecuente producción y absorción de toxinas potencialmente patogénicas.
No se ha encontrado información sobre la posible interacción entre Eimeria y Clostridium en desórdenes intestinales en alpacas; sin embargo, infecciones coccidiales permiten el desarrollo clostridial para desencadenar enteritis necrótica en pollos (Hermans y Morgan, 2003). En aves, se conoce que las infecciones coccidiales estimulan la proliferación de C. perfringens en el intestino (Arakawa y Ohe, 1975; Kimura et al., 1976; Dykstra y Reid, 1978), donde el drenaje de proteínas plasmáticas producto de la coccidiosis facilitarían ciertos factores de crecimiento para el desarrollo del C. perfringens (Van Immerseel et al., 2004). Adicionalmente, cambios de pH de contenido intestinal pueden promover el crecimiento del C. perfringens, pues el bajo pH, en condiciones in vitro, inhibe el crecimiento bacterial (Kmet et al., 1993) y en pH alcalino se incrementa la producción de toxinas (Taylor y Stewart, 1941). No se dispone de mucha información al respecto en alpacas, pero el pH en 51 muestras de intestinos afectados fue de 6.8 comparado con pH de 5.8 en tres muestras de intestino de alpacas muertas por otras causas (Rosadio et al., 2010).
La asociación entre E. macusaniensis y Clostridium en procesos enterotoxigénicos han sido descritos en camellos (Kinne y Wernery, 1998); sin embargo, las investigaciones sobre la coexistencia de estos patógenos merece ser ampliada, pues puede ser responsable de una severa enteritis hemorrágica necrotizante propia de la enterotoxemia de la alpaca.
Ensayos Experimentales de Vacuna Multivalente
Los resultados microbiológicos apoyaron el diseño, preparación y ensayo de una vacuna convencional a base de cepas patogénicas asociadas y aisladas de casos de enterotoxemia (Yaya y Rosadio, 2005). La vacuna inactivada tiene mayoritariamente (80%) componentes bacterianos y sus exotoxinas (sin enterotoxina) de cepas múltiples (tipos A, A β2, y C) aislados de alpacas, mientras que el 20% restante son los tipos B y D de origen ovino. La vacuna fue evaluada en un ensayo de campo entre el 2001 al 2006 en una unidad de producción alpaquera del departamento de Puno. La unidad de produc ción presentaba historia de pérdidas elevadas por enterotoxemia, en un rebaño de 2000 crías anuales. El estudio contempló vacunar a todas las hembras preñadas (dos dosis de 2.5 ml/dosis, vía s.c.) previo al parto y a todas las crías (una dosis de 2.0 ml, vía s.c.) a los 10-15 días de edad en el primer año (2001) y solamente a las crías en los años siguientes (en el 2003 se vacunó solamente a las madres gestantes) (Rosadio et al., 2012).
La vacuna puede producir pequeñas reacciones focalizadas en el lugar de inoculación, pero sin inducir alteraciones sistémicas (Yaya y Rosadio, 2005). La unidad de producción reportó 37.4% de mortalidad general y 19.5% de mortalidad específica a enterotoxemia el año previo al inicio del programa de vacunación. La introducción de la vacuna redujo la mortalidad total a 25.2, 23.7, 9.4, 12.1, 15.1 y 14.3% en los años 2001 a 2006, y la mortalidad neonatal debido a enterotoxemia a 7.2, 9.1, 1.0, 0.1, 2.1 y 3.9% para los años 2001 a 2006. Similares reducciones de mortalidad debidas a la enfermedad se han experimentado en fundos comunales y privados con la inclusión de la vacuna dentro de los calendarios sanitarios (D. Castillo, comunicación personal). El éxito de la vacuna convencional (anacultivo) tiende a apoyar, indirectamente, al posible rol de la exotoxinas en la patogénesis de la enfermedad y descartando, a su vez, a la toxina cpe (Yaya y Rosadio, 2005).
LITERATURA CITADA
1. Ameghino E, DeMartini J. 1991. Mortalidad de crías de alpacas. Bol Div IVITA. p 71-80.
2. Arakawa A, Ohe O. 1975. Reduction of Clostridium perfringens by feed additive antibiotics in the ceca of chickens infected with Eimeria tenella. Poultry Sci 54: 1000-1007.
3. Bueschel DM, Jost BH, Billington SJ, Trinh HT, Songer JG. 2003. Prevalence of cpb2, encoding beta 2 toxin, in Clostridium perfringens field isolates: correlation of genotype with phenotype. Vet Microbiol 94: 121-129.
4. Dennison AC, Van Metre DC, Morley P, Callan RJ, Plampin EC, Ellis RP. 2005. Comparison of the odds of isolation, genotypes, and in vivo production of major toxins by Clostridium perfringens obtained from the gastrointestinal tract of dairy cows with hemorrhagic bowel sindrome or left-displaced abomasum. JAVMA 227: 132-138.
5. Dray T. 2004. Clostridium perfringens type A and β2 toxin associated with enterotoxemia in a 5-week-old goat. Can Vet J 45: 251-253.
6. Dykstra DD, Reid WM. 1978. Monensin, Eimeria tenella infection, and effects on the bacterial populations in the ceca of gnotobiotic chickens. Poultry Sci 57: 398-402.
7. Engström BE, Fermér C, Lindberg A, Saarinen E, Båverud V, Gunnarsson A. 2003. Molecular typing of isolates of Clostridium perfringens from healthy and diseased poultry. Vet Microbiol 94: 225-235.
8. Embury-Hyatt CK, Wobeser G, Simko E, Woodbury MR. 2005. Investigation of a syndrome of sudden death, splenomegaly, and small intestinal hemorrhage in farmed deer. Can Vet J 46: 702-708.
9. Garmory HS, Chanter N, French NP, Bueschel D, Songer JG, Titball RW. 2000. Occurrence of Clostridium perfringens β2-toxin amongst animals determined using genotyping and subtyping PCR assays. Epidemiol Infect 124: 61-67.
10. Gholamiandekhordi AR, Ducatelle R, Heydrickx M, Haesebrouck FV. 2005. Molecular and phenotypical characterization of Clostridium perfringens isolates from poultry flocks with different disease status. Vet Microbiol 113: 143-152.
11. Gkiourtzidis K, Frey J, Bourtzi- Hatzopoulou E, Illiadis N, Sarris K. 2001. PCR detection and prevalence of α−β−β2-, ε−,Ǯ- and enterotoxin genes in Clostridium perfringens isolated from lambs with clostridial dysentery. Vet Microbiol 82: 39-43.
12. Hatheway C. 1990. Toxigenic clostridia. Clin Microbiol Rev 3: 66-98.
13. Herholz C, Miserez R, Nicolet J, Frey J, Popoff M, Gubert M, Straub R. 1999. Prevalence of β2-toxigenic Clostridium perfringens in horses with intestinal disorders. J Clin Microbiol 37: 358-361.
14. Hermans PG, Morgan KL. 2003. The epidemiology of necrotic enteritis in broiler chickens. Res Vet Sci 74 (Supplement A): 19.
15. Kalender H, Ertas HB, Ceninkaya B, Muz A, Aíslan N, Kilic A. 2005. Typing of isolates of Clostridium perfringens from healthy and diseased sheep by multiplex PCR. Vet Med-Czech 50: 439- 442.
16. Kanakaraj R, Harris DL, Songer JG, Bosworth B. 1998. Multiplex PCR assay for detection of Clostridium perfringens in feces and intestinal contents of pigs and swine feed. Vet Microbiol 63: 29-38.
17. Kinne J, Wernery U. 1998. Pathological studies on camel coccidiosis in the United Arab Emirates. In: Proc III Meeting Animal Production under Arid Conditions. United Arab Emirates. p 131-142.
18. Kmet V, Stachova M, Nemcova R, Jonecova Z, Laukova A. 1993. The interaction of intestinal microflora with avian enteric pathogens. Acta Vet Brno 62 (Suppl 6): S87-S89.
19. Kimura N, Mimura F, Nishida S, Kobayashi A, Mitsuoka T. 1976. Studies on the relationship between intestinal flora and cecal coccidiosis in the chicken. Poultry Sci 55: 1375-1383.
20. Manteca C, Daube G, Jauniaux T, Linden A, Pirson V, Detilleux J, Ginter A, et al. 2002. A role for the Clostridium perfringens β2 toxin in bovine enterotoxaemia. Vet Microbiol 86: 191-202.
21. Moro M. 1987. Enfermedades infecciosas de las alpacas. Rev Camélidos Sudam 4: 7-13.
22. Palacios C, Perales R, Chavera A, López M, Braga W, Moro M. 2006. Eimeria macusaniensis and Eimeria ivitaensis co-infection in fatal cases of diarrhea in young alpacas (Lama pacos) in Peru. Vet Rec 158: 344-345.
23. Pérez D. 2006. Genotipificación y subtipificación de Clostridium perfringens aislados de crías de alpacas muertas por enterotoxemia. Tesis de Médico Veterinario. Lima: Universidad Nacional Mayor de San Marcos. 91 p.
24. Pérez D. 2010. Caracterización toxigenica de la fosfolipasa C del Clostridium perfringens (Cp-PLC) y su relación con aislados casos de enterotoxemia en alpacas. Tesis de Magíster. Lima: Universidad Nacional Mayor de San Marcos. 151 p.
25. Petit L, Gilbert M, Popoff M. 1999. Clostridium perfringens: toxinotype and genotype. Trends Microbiol 7: 104-110.
26. Prehn N, Saez S, Arraigada M. 1999. Estudios microbiológicos y clínicos de enterotoxemia por Clostridium perfringens en camélidos sudamericanos. En: Resúmenes II Congreso Mundial de Camélidos. Cusco, Perú. p 140.
27. Ramírez A. 1987. Alpaca Clostridium perfringens type A enterotoxemia: Purification and assays of the enterotoxin. PhD Thesis. USA: Colorado State University. 201 p.
28. Ramírez A. 1991. Enfermedades infecciosas. En: Fernández-Baca S (ed). Avances y perspectivas del conocimiento de los camélidos sudamericanos. Santiago de Chile: Oficina Regional de la FAO para América Latina y el Caribe. p 263-324.
29. Ramírez A, Huamán D, Ellis RP. 1985. Enterotoxemia de la alpaca. Programa colaborativo de apoyo a la investigación en rumiantes menores. Serie Reporte Técnico. Lima. 63: 1-17.
30. Rosadio R, Ameghino E. 1994. Coccidial infections in neonatal Peruvian alpacas. Vet Rec 135: 459-460.
31. Rosadio R, Maturrano L, Pérez D, Llanco L, Castillo H, Veliz A, Londoñe P. 2008. New evidence on pathogenesis and prevention of enterotoxemia. In: International Camelid Health Confe-rence. Corvalli: Oregon State University. p 25-32.
32. Rosadio R, Londoñe P, Pérez D, Castillo H, Llanco L, Véliz A, Maturrano L. 2010. Eimeria macusaniensis associated lesions in neonate alpacas dying from enterotoxemia. Vet Parasitol 168: 116-120.
33. Rosadio R, Yaya K, Véliz A, Quispe T. 2012. Efecto protector de una vacuna polivalente anticlostridial sobre la mortalidad neonatal en alpacas. Rev Inv Vet, Perú 23 (Supl 1): 299-306.
34. Songer JG. 1996. Clostridial enteric diseases of domestic animals. Clin Microbiol Rev 9: 216-234.
35. Sparks SG, Carman RJ, Sarker MR, McClane BA. 2001. Genotyping of enterotoxigenic Clostridium perfringens fecal isolates associated with antibiotic- associated diarrhea and food poisoning in North America. J Clin Microbiol 39: 883-888.
36. Taylor AW, Stewart J. 1941. The toxins produced by Clostridium welchii in a simple medium. J Pathol Bacteriol 53: 87-94.
37. Titball RW, Naylor CE, Basak AK. 1999. The Clostridium perfingens α- toxin. Anaerobe 5: 51-64.
38. Van Immerseel F, De Buck J, Pasmans F, Huyghebaert G, Haesebrouk F, Ducatelle R. 2004. Clostridium perfringens in poultry: an emerging threat for animal and public health. Avian Pathol 33: 537-549.
39. Wheeler CJ. 1995. Evolution and present situation of the South American Camelidae. Biol J Linn Soc 54: 271-295.
40. Yaya KM, Rosadio R. 2005. Ensayo de tres programas de vacunación anticlostridial en alpacas. Rev Inv Vet, Perú 16: 49-55.