Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.3 Lima ago. 2012
Coexistencia de virus y bacterias en neumonías agudas en alpacas neonatas
Viral and bacterial coexistence in acute pneumonia in neonatal alpacas
Erick Cirilo C.1, Alberto Manchego S.1, Hermelinda Rivera H.1, Raúl Rosadio A.1,2,3
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos. Av. Circunvalación 2800, San Borja, Lima, Perú
2 CONOPA – Instituto de Investigación y Desarrollo de Camélidos Sudamericanos, Jr. Centenario 195, Block C-201, Urb. Las Laderas de Melgarejo, La Molina Lima, 12, Peru
3 E-mail: rrosadio@gmail.com
RESUMEN
A pesar que las neumonías agudas son una de las principales causas de muerte neonatal en alpacas, poco se conoce sobre agentes etiológicos responsables de estos procesos. Muestras de neumonías fatales de 24 neonatos de 5 a 39 días de edad fueron analizadas mediante estudios patológicos, virológicos (inmunofluorescencia directa) y bacteriológicos para identificar virus [parainfluenza 3 (PI-3), respiratorio sincitial bovino (BRSV)] y bacterias [Pasteurella multocida (PM), Mannheimia haemolytica (MH)], buscando posible asociación virus-bacteria en procesos neumónicos. Histopatológicamente, las lesiones se agruparon en tres tipos: 1) Severa y difusa bronconeumonía fibrino-necrotizante supurativa (n=3); 2) Leve a moderada y difusa bronconeumonía supurativa (n=10); y 3) Moderada a severa y difusa congestión y edema pulmonar (n=11). En 22/24 de los casos se identificaron agentes virales y se aislaron bacterias. En 8/22 casos se identificaron/aislaron agentes únicos (5 virus y 3 bacterias), en 10 de 22 casos fueron positivos para infecciones duales [BRSV y bacteria (n=7), PI3 y bacteria (n=2) y ambas bacterias (n=1)] y en los cuatro restantes se identificaron tres patógenos simultáneamente [BRSV, PI3 y bacteria (n=3); y PI3 más las dos bacterias (n=1)]. La prueba de inmunofluorescencia detectó 19/22 positivos a antígenos virales. En 13/19 de estos casos se identificó al BRSV y en 9/19 al virus PI-3 (ambos virus estuvieron presentes en tres casos). En 16/22 casos se lograron aislar bacterias, 11 de los cuales fueron positivos a P. multocida y 7 positivos a M. haemolytica (en dos casos se aislaron ambas bacterias). La presencia de patógenos múltiples fue observada en 14/22 de los casos con clara predominancia de la asociación virus/bacteria (n=13). La coexistencia de BRSV-PM fue la más frecuente (n=6), seguida de BRVS-MH (n=4) y PI3-PM o MH (n=4). Los resultados sugieren posible interacción patogénica virus bacteria, similares a otros rumiantes, en el desarrollo de neumonías agudas en alpacas.
Palabras clave: alpaca neonata, neumonía aguda, PI-3, BRSV, P. multocida, M. haemolytica
ABSTRACT
The etiopathogenesis of acute pneumonia, the second most important cause of mortality among Peruvian neonatal alpacas, is still poorly understood. The objective of this study was to characterize gross and histopathology lesions, as well as to identify viruses [parainfluenza type 3 (PI-3) and bovine respiratory syncytial (BRS)] by direct immunofluorescence test, and isolate bacteria [Pasteurella multocida (PM) and Mannheimia haemolytica (MH)] from 24 fatal acute pneumonia cases of 7-39 days-old neonates. At necropsy the gross lesions corresponded to moderate purulent focal bronchopneumonia or severe necrotic purulent fibrinous (n=13), and moderate to severe pulmonary congestion and edema (n=11). Histopathological analysis revealed: acute, severe, and diffuse necrotizing, fibrinous, suppurative bronchopneumonia (n=3), acute mild to moderate and focally diffuse suppurative bronchopneumonia (n=10), and acute, moderate to severe diffuse congestion and pulmonary edema (n=11). Among these 24 cases, 22 yielded virus identification and/or bacterial isolation. Eight cases were positive to one pathogen (5 for viruses and 3 for bacteria), 10/22 were positive for two pathogens [BRSV plus bacteria (n=7), PI-3 plus bacteria (n=2), and one for both bacteria)], and 4/22 positive for 3 pathogens [BRSV, PI-3 plus bacteria (n=3), and PI-3 plus both bacteria (n=1)]. Among the affected lung tissue, virus was identified 19 times (13 positive for BRSV, 9 for PI-3, and 3/19 for both viruses) whereas bacteria was isolated 14 times [P. multocida (n=8), M. haemolytica (n=6), and both bacteria (n=2)]. The presence of multiple pathogens was observed in 14/22 positive cases with an observation of virus-bacteria association in 13/14 of the cases. The coexistence of BRSV-PM was the most frequently observed (6/13), followed by the simultaneous presence of BRSV-MH (4/13) and PI-3 PM or MH (4/13). The results appear to indicate that acute pneumonia in alpaca neonates may well result from virus and bacterial interactions in a similar way to pneumonic lesions of other ruminants.
Key words: neonatal alpaca, acute pneumonia, PI-3 virus, BRSV, P. multocida, M. haemolytica
INTRODUCCIÓN
En el Perú, la crianza de camélidos sudamericanos constituye una importante fuente de ingresos económicos para las empresas asociativas, pequeños productores y comunidades campesinas de la región andina (Ameghino y DeMartini, 1991). La productividad de esta ganadería, sin embargo, no es la adecuada pues, endémicamente, se observa una elevada mortalidad de crías y baja natalidad. Las enfermedades infecciosas, principalmente los procesos entéricos y neumónicos, constituyen las dos principales causas de mortalidad neonatal durante las primeras semanas de vida (Ramírez, 1991; Melo, 1997; Victorio et al., 2003).
A pesar que las neumonías agudas son la segunda causa de muerte en animales neonatos, el conocimiento sobre los agentes desencadenantes de estos procesos son muy exiguos. Escasamente, en el Perú, existen descripciones macro y microscópicas de lesiones neumónicas prevalentes y aislamientos frecuentes de Pasteurella spp (Ameghino y Calle, 1989; Arratia, 1991; Mamani, 1992). Posteriores estudios serológicos realizados en animales procedentes de comunidades campesinas evidencian presencia de anticuerpos para agentes virales neumopatógenos bovinos, principalmente el virus de la parainfluenza tipo 3 (PI-3) y virus respiratorio sincitial bovino (BRSV) (Rivera et al., 1987; Manchego et al., 1998; Victorio et al., 2003).
Con el objetivo de elucidar la posible asociación virus bacteria en la presentación de neumonías agudas, se procedió a identificar y aislar agentes patógenos en 24 tejidos neumónicos de animales neonatos procedentes de estaciones experimentales, empresas asociativas y criadores individuales de la sierra del sur del Perú. Las muestras patológicas fueron analizadas macro y microscópicamente y usadas en la identificación de agentes virales mediante la prueba de la inmunofluorescencia (IF) directa para los virus PI3 y BRSV, así como para aislamiento microbiológico en medios de cultivo bajo ambiente aeróbico en busca de bacterias potencialmente patogénicas, como Pasteurella multocida y Mannheimia haemolytica.
MATERIALES Y MÉTODOS
Lugar de Estudio
El estudio de campo se realizó durante las campañas de parición (enero-marzo de 2004 y 2005) en el Centro de Investigación y Producción (CIP) La Raya UNA-Puno y en el Centro Experimental (CE) La Raya UNSAAC-Cusco. Ambos establecimientos se encuentran en el límite vial de los departamentos de Puno y Cusco, dentro de un área geográfica con altitudes desde 4128 hasta 4362 msnm. Además, se tomaron muestras en los sectores Antacalla y Huripiña, de la Empresa de Propiedad Social (EPS) Rural Alianza, distrito de Nuñoa, provincia de Melgar, departamento de Puno.
Animales
Se estudió 24 crías muertas con diagnóstico presuntivo de neumonía o padeciendo de alguna alteración patológica en el sistema respiratorio. De estas muestras, 13 fueron del CIP La Raya UNA-Puno, ocho del CE La Raya UNSAAC-Cuzco y tres de la EPS Rural Alianza-Puno. Estos animales tenían una edad promedio 20 ± 9 días (5-39 días) y un peso promedio al nacimiento de 7 ± 1 kg. La mayoría de estos animales (n=21) fueron hallados muertos después de la inspección diaria en las puntas de parición. Con excepción de dos crías, el resto (n=22) no había recibido antibioterapia alguna. Las carcasas fueron conducidas a las salas de necropsia de los respectivos centros de crianza, aunque a veces, la necropsia se realizó en la misma punta de parición. Generalmente, las necropsias se hicieron de inmediato, pero siempre dentro de las 12 horas de la muerte.
Estudio Patológico Macroscópico
El examen postmorten se concentró principalmente en el sistema pulmonar y ganglios linfáticos regionales utilizando la técnica convencional de necropsia (Zanabria et al., 2000). La extensión y localización de las lesiones fueron plasmadas en un diagrama pulmonar y la ficha de necropsia.
Las alteraciones macroscópicas fueron clasificadas de acuerdo a la severidad de las lesiones observadas a la necropsia. A pesar de que los pulmones de la alpaca carecen de cisuras interlobulares (López, 1993), lo que impide la descripción o división anatómica lobular tradicional de otras especies domesticas, para la descripción de las lesiones se utilizó los términos: lóbulo apical (craneal), lóbulo intermedio (cardiaco), lóbulo caudal (diafragmático) y lóbulo accesorio (en el pulmón derecho). Estas descripciones utilizan conocimientos de la ramificación del árbol bronquial (López, 1995) y ventilación de las principales ramas bronquiales descritas por Viera et al. (1968).
Toma de Muestras
Las muestras de tejidos para el análisis histopatológico, de aproximadamente 1 cm3, fueron obtenidas después de abrir la cavidad torácica y fueron conservadas en frascos con formol amortiguado al 15%. Similarmente, muestras de tejido pulmonar y ganglios regionales, tomados asépticamente, fueron depositadas en crioviales y mantenidos en tan que de nitrógeno líquido para posterior identificación viral.
Se tomaron muestras de secreción bronquial y exudado del parénquima pulmonar afectado mediante el uso de hisopos estériles. Las muestras se depositaron en tubos de ensayo estériles conteniendo medio de transporte Stuart, y se remitieron en refrigeración, dentro de las 48 horas postrecolección, al Laboratorio de Bacteriología de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima.
Estudio Histopatológico
Las muestras de pulmón fueron procesadas mediante la técnica histológica convencional utilizando la inclusión en parafina y coloración con hematoxilina-eosina (HE) para describir las lesiones microscópicas. La duración del proceso inflamatorio fue considerado como hiperaguda, aguda, subaguda y crónica.
En la evaluación del grado de severidad de las lesiones y la duración del proceso inflamatorio se utilizó la clasificación de Slauson y Cooper (2002), considerando grados de severidad leve (muy poca o ninguna destrucción tisular, ligera evidencia de implicancia vascular [hiperemia y edema] y escasa exudación); moderado (daño tisular y reacción a la injuria, expresada por la acumulación de leucocitos y eventos vasculares); y severo (daño tisular considerable con abundante exudación).
Detección de Antígenos Virales
En la detección de antígenos virales (PI3 y RSB) en las muestras se utilizó la prueba de inmunofluorescencia directa con anticuerpos policlonales específicos y conjugados con isotiocianato de fluoresceína (VMRD Inc., EEUU) siguiendo las instrucciones del laboratorio fabricante y metodología del laboratorio utilizada para lesiones similares en muestras bovinas (Zanabria et al., 2000).
Aislamiento e Identificación Bacteriológica
Las muestras biológicas remitidas en medio de transporte Stuart fueron sembradas en Agar Sangre y McConkey e incubadas en aerobiosis por 20 horas a 37 ºC. Para la identificación de Pasteurella multocida y Mannheimia haemolytica se consideraron las características culturales propias a la coloración de Gram, crecimiento en agar McConkey y reacciones bioquímicas (Cowan, 1974).
RESULTADOS
La mayoría de los animales en estudio se encontraron muertos o moribundos en el campo sin poderse obtener antecedentes clínicos por parte de los pastores encargados del cuidado de los rebaños de parición; sin embargo, en una cría, pocas horas antes de morir, se logró observar debilidad, postración, anorexia, disnea y estertores húmedos a la auscultación pero sin secreciones nasales, oculares ni tos. Este animal, a la necropsia, tenía una extensa neumonía fibrinonecrotizante.
Hallazgos Macroscópicos
Las lesiones más severas (n=13) fueron agrupadas como neumonías extensivas fibrinonecrotizantes (n=3) y bronconeumonías bilaterales necróticas purulentas (n=10). En todos estos casos, las lesiones fueron bilaterales afectando principalmente regiones cráneo- ventrales y en tres casos la pleura estaba adherida a las paredes costales. Los 11 casos restantes mostraron cuadros de congestión y edema pulmonar.
Neumonías extensivas fibrinonecrotizantes
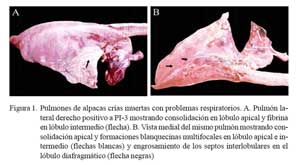
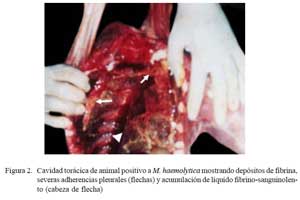
Los tres pulmones afectados estuvieron aumentados de tamaño mostrando consolidaciones rojizas en el parénquima cráneo/ ventral pulmonar, afectando lóbulos apicales, intermedio, accesorio y la región anterior de los lóbulos caudales (Fig. 1a). Las lesiones se extendieron en un caso hasta los lóbulos caudales. Se observó abundante depósito de material filamentoso cremoso sobre la superficie pleural del parénquima consolidado (pleuritis fibrinosa) (Fig. 1a). En 2/3 casos estaba comprometido el pericardio (pericardititis) y hubo adherencias a la pleura que dificultaron la remoción pulmonar, mostrando abundante exudado fibrino-sanguinolento en la cavidad torácica (Fig. 2).
El parénquima consolidado, al corte, mostró firmeza y de color rojizo oscuro, fluyendo abundante líquido sanguinolento y exudado purulento de los conductos respiratorios. Se observó formaciones blanco-grisáceas multifocales levemente elevadas, demarcadas irregularmente, de 0.1-1.0 cm de diámetro, penetrando el tejido consolidado y de consistencia friable (necrosis focales) al corte. El resto del parénquima, no consolidado, se presentó igualmente enrojecido con engrosamiento focalizado de las cisuras interlobulares (Fig. 1b). Los ganglios bronquiales estuvieron fuertemente enrojecidos y aumentados de tamaño, fluyendo al corte un líquido blanquecino (edema).
Neumonías bilaterales purulentas
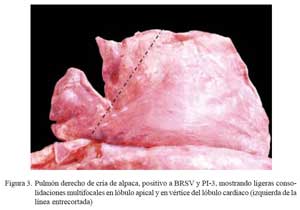
Se encontró hepatizaciones rojizas bilaterales, localizadas principalmente en lóbulos apicales e intermedios, comprometiendo, en algunos casos, los lóbulos caudales (Fig. 3). Al corte, el parénquima afectado mostraba una consistencia firme, aspecto uniforme y de coloración rojiza intensa, emanando moderadas cantidades de exudado muco-purulento que involucraban a los conductos respiratorios. El parénquima adyacente a las zonas consolidadas, en grados variables, estaba enrojecido y lleno de líquido sero-sanguinolento. La mucosa traqueal y bronquial moderadamente enrojecida (congestión). En 2/ 10 casos, los lóbulos caudales presentaron burbujas elevadas sobre la superficie pleural (bulas enfisematosas) matizados con grados de enrojecimiento y mostrando, al corte, emanaciones de líquido sero-sanguinolento. Los ganglios bronquiales estaban moderadamente aumentados de tamaño, enrojecidos y fluía líquido transparente al corte.
Congestión y edema pulmonar
Los 11 casos de este grupo mostraron aumento prominente del tamaño de ambos pulmones, con apariencia muy húmeda, brillante y crepitante al tacto. Al corte, las áreas afectadas presentaron un enrojecimiento difuso y exudaciones de copiosa cantidad de líquido sero-sanguinolento, y abundante líquido espumoso rosado (edema) en los lúmenes traqueales y bronquiales. En un caso, al seccionar el parénquima, se observó pequeños focos rojizos (posibles consolidaciones) localizados en la región cráneo-ventral, mientras que en otros casos se encontró bulas enfisematosas, principalmente en la superficie dorsal de los lóbulos caudales. Los ganglios bronquiales se hallaron levemente aumentados de tamaño y ligeramente enrojecidos.
Hallazgos Microscópicos
Las alteraciones histopatológicas correspondieron a las lesiones macroscópicas y se agruparon en tres tipos: a) severa y difusa bronconeumonía fibrinonecrotizante aguda supurativa (3/24), b) leve a moderada bronconeumonía aguda supurativa (10/24), y c) moderada a severa, difusa congestión y edema pulmonar (11/24).
Severa y difusa bronconeumonía fibrinonecrotizante aguda supurativa
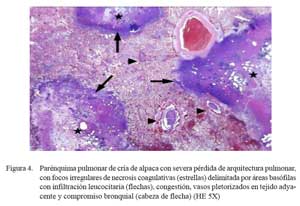
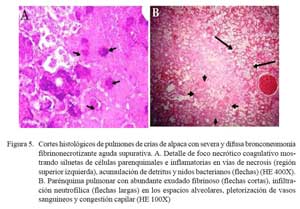
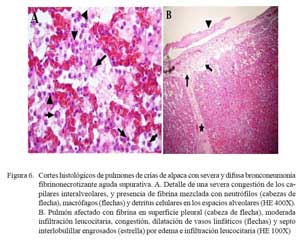
Las lesiones comprometían el parénquima y la pleura. En las zonas más afectadas se observó una severa y extensa pérdida de la arquitectura pulmonar con presencia de numerosas masas irregulares de tejido necrosado con una coloración rosada en la zona central y violácea en la periferia (Fig. 4). En otras áreas, se observó focos de necrosis coagulativa, distorsión tisular y abundante detritus celulares compactados de coloración basófila, así como nidos bacterianos, principalmente cocobacilares, y abundante células inflamatorias polimórficas en procesos de necrosis (Fig. 5a). Los espacios alveolares del parénquima adyacentes a focos necrosados contenían abundante exudado conformado por células neutrofílicas, fibrina y macrófagos (Fig. 5b), mientras que en algunas zonas se visualizó extravasación de glóbulos rojos hacia los espacios alveolares. Los bronquios y bronquiolos en las zonas comprometidas contenían exudado compuesto principalmente por leucocitos polimorfonucleares y detritus celulares, obliterando la luz en algunos casos (Fig. 6a). Las células epiteliales bronquiolares evidenciaban degeneración y aún pérdida ciliar, llegando en algunos casos a desnudamiento y exfoliaciones celulares focalizadas. En otras áreas, la pletorización de vasos sanguíneos mayores era evidente y asociada a una severa congestión capilar en los septos interalveolares (Fig. 6a), que en algunos casos comprometían a arteriolas y vénulas con formación de trombos (Fig. 5b).
La pleura, en todos los casos, superficialmente mostraba abundante depósito de fibrina acompañado de engrosamiento del tejido conectivo subpleural e infiltrados por polimorfonucleares, asociado con pletorización vascular y linfática, así como moderada extravasación de glóbulos rojos (Fig. 6b). Algunas veces, la necrosis comprometía la región subpleural con abundante material fibrinoso y supurativo, acompañado de detritus, necrosis y desprendimiento del mesotelio pleural (Fig. 6b). En estas áreas, los septos interlobulillares estuvieron engrosados por una moderada infiltración neutrofílica, pletorización de vasos linfáticos y abundante fluido proteináceo eosinofílico (edema).
Los ganglios linfáticos bronquiales presentaron una severa y difusa hemorragia cortical y severa depleción linfoide con presencia de edema y necrosis en la zona medular. Uno de estos tres casos fue positivo a M. haemolytica y PI-3, el segundo a M. haemolytica y P. multocida, y el tercero positivo al virus PI-3 sin aislamiento bacterial (Fig. 1). En este último caso, sin embargo, la cría había recibido tratamiento antibiótico y se encontró nidos bacterianos cocobacilares que impiden descartar la participación bacteriana.
Leve a moderada y difusa bronconeumonía aguda supurativa
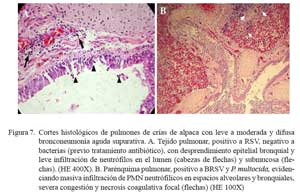
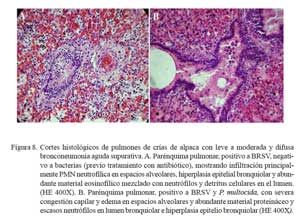
Las lesiones en este segundo grupo variaron, de acuerdo a la implicancia de los eventos vasculares, magnitud del daño tisular y participación inflamatoria, desde leve a moderada. En los casos leves, se visualizó ligera infiltración inflamatoria neutrofílica en espacios alveolares, escasa cantidad de fluido eosinofílico en los alveolos (edema) y moderada pletorización de los capilares alveolares, arteriolas y vénulas (congestión). En algunos casos, se visualizó degeneración del epitelio alveolar y desprendimiento epitelial en bronquiolos y bronquios, con escaso componente inflamatorio neutrofílico en la luz y en la submucosa bronquial (Fig. 7a).
En los casos moderados, la pletorización de los capilares alveolares y la salida de fluido eosinofílico (edema) en los espacios alveolares fueron más evidentes. Todos estos cambios fueron, usualmente, acompañados de moderada infiltración neutrofílica y, en algunos casos, de detritus y células mononucleares (macrófagos y linfocitos) (Fig. 7b). El epitelio alveolar y bronquiolar mostraron necrosis marcada, llegando a exfoliaciones celulares y focalizado desnudamiento epitelial, mientras que en otras, moderada hiperplasia del epitelio bronquiolar (Fig. 8). En los espacios alveolares y bronquiolares se observó moderada infiltración neutrofílica acompañado de exudado fibrinoso, detritus celular y, eventualmente, macrófagos con presencia, a veces, de pigmentos de hemosiderina. La pleura y los septos interlobulillares mostraron, en dos casos, ligero engrosamiento del tejido conjuntivo con presencia de líquido eosinofílico (edema) y leve pletorización de los vasos sanguíneos subpleurales. En la mayoría de los casos, los ganglios linfáticos bronquiales presentaron moderada congestión difusa.
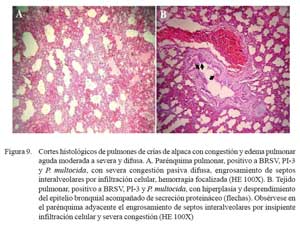
Congestión y edema pulmonar aguda moderada a severa y difusa
En este grupo predominaron los eventos vasculares asociados a moderada a severa pletorización de vénulas, arteriolas y capilares alveolares, mezclados con abundante edema en los espacios alveolares, comprometiendo los espacios bronquiolares y te jido conectivo subpleural. En algunos casos, la extravasación de eritrocitos penetraba la luz y paredes alveolares asociado a una severa congestión capilar, engrosando los septos alveolares (Fig. 9). El componente inflamatorio fue mínimo, con escasas células polimorfonucleares neutrófilicas en el intersticio y alveolos. En los espacios alveolares se observaron abundantes depósitos de hemosiderina y, en algunos casos, ruptura de las paredes alveolares por el excesivo ensanchamiento de alvéolos enfisematosos (Fig. 10). El epitelio bronquiolar y bronquial, mostraba en forma focalizada, hiperplasias y exfoliación con incremento de secreción mucoide en el lúmen bronquiolar.
Antígenos Virales y Aislamiento Bacteriológicos
Detección viral
La mayoría de los casos (22/24) fueron positivos a agentes patógenos. En ocho casos se identificaron patógenos individuales (virus o bacteria), en 14 casos se detectaron infecciones múltiples (duales y triples) con asociación virus y bacteria. Los dos casos negativos, correspondieron a animales con cambios macroscópicos y alteraciones microscópicas de tipos congestivos y edematosos difusos.
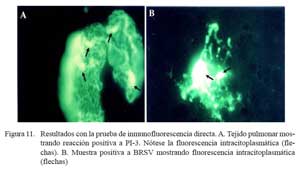
La prueba de inmunofluorescencia directa identificó 19/22 casos positivos a antígenos virales, donde 13 correspondieron al virus BRS y 9 al virus PI-3. En 3/19 casos se observó la presencia de ambos virus. En 8 de los 13 casos positivos a BRSV (Fig. 11a), las lesiones correspondieron a bronconeumonía supurativa difusa aguda, y en los cinco restantes, a congestión y edema pulmonar difusa. Cuatro de los 9 casos positivos a PI-3 (Fig. 11b) tenían cuadros de congestión y edema pulmonar, tres presentaban bronconeumonía supurativa difusa aguda y dos tenían bronconeumonía fibrinonecrotizante supurativa difusa aguda.
Aislamiento bacteriológico
En 16/22 casos se aislaron bacterias. Once fueron positivos a Pasteurella multocida y siete fueron positivos a Mannheimia haemolytica (en 2 casos se aislaron ambas bacterias). Además, en dos casos se aisló Echerichia coli (ambos mostrando lesiones de moderada y difusa bronconeumonía supurativa) y en uno se aisló levaduras. Dos de los cuatro aislamientos negativos fueron de animales que recibieron antibioterapia.
De los 11 casos positivos a aislamiento de P. multocida, seis crías presentaron congestión y edema pulmonar, cuatro presentaron bronconeumonía supurativa difusa aguda y un caso fue de bronconeumonía necrotizante fibrino-supurativa difusa aguda.
De los siete casos positivos a M. haemolytica, tres mostraron bronconeumonía supurativa difusa aguda, dos fueron diagnosticados como bronconeumonía fibrinonectrotizante supurativa difusa aguda y los dos restantes con cuadros de congestión y edema pulmonar.
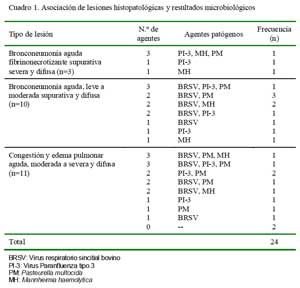
Asociación entre agentes patógenos y cambios histopatológicos
En 14/22 casos se detectaron infecciones múltiples (virus y bacterias) con una mayor proporción (n=10) de infecciones duales y en cuatro casos se tuvo la presencia de tres agentes patógenos. En las infecciones duales, la asociación BRSV-P. multocida fue la más frecuente (n= 4), seguida de BRSVM. haemolytica (n=3), PI-3-P. multocida (n=2), y BRSV-PI-3 (n=1). En los casos de infecciones triples, la asociación entre BRSV / PI-3 y P. multocida fue observada dos veces, mientras que la coexistencia de BRSV / P. multocida / M. haemolytica y PI-3 / P. multocida / M. haemolytica fueron observaciones únicas (Cuadro 1). En los ocho casos positivos restantes se observó la partici pación de un solo agente, con predominancia de PI-3 (n=3), seguido de BRSV (n=2), M. haemolytica (n=2) y P. multocida (n=1).
DISCUSIÓN
Las neumonías agudas, segunda causa de muerte neonatal, ocasionan enormes pérdidas en la producción y productividad de las alpacas en el Perú, y suelen presentarse asociadas con factores estresantes medioambientales y a manejos del rebaño tales como parición, destete, esquila, baños y dosificaciones antiparasitarias (Ameghino y DeMartini, 1991). En este esquema, las crías y los animales jóvenes sufren infecciones fatales por agentes patógenos neumotrópicos (Martín, 1996; Zanabria et al., 2000). Los resultados obtenidos en el presente estudio confirman la posible asociación de agentes virales (Virus respiratorio sincitial y Parainfluenza tipo 3) y agentes bacterianos (P. multocida y M. haemolytica) en la presentación de procesos neumónicos agudos. Estos agentes, al parecer, son capaces de producir lesiones neumónicas en animales neonatos expuestos a factores climáticos estresantes (época lluviosa), que se presentan durante la campaña de parición en el país.
Los resultados del examen macroscópico de los 24 casos estudiados revelan que neonatos afectados por neumonías muestran una serie de alteraciones patológicas, variando desde cambios severos descritos como neumonía extensiva necrótica-purulenta asociada con pleuritis fibrinosa (3/24) y neumonías bilaterales purulentas (10/24), hasta cuadros congestivos y edematosos pulmonares (11/24). Las alteraciones más severas comprometían ambos pulmones, principalmente a niveles cráneo-ventrales (severas hepatizaciones), acompañado de pleuritis fibrino-hemorrágica (Fig. 1). Estos tipos de lesiones han sido descritos como lesiones típicas de neumonías agudas en alpacas (Ameghino y DeMartini, 1991) y, al parecer, son lesiones que deben corresponder a las denominadas neumonías lobares o bronconeumonías fibrinosas descritas en neonatos bovinos y ovinos, causadas por agentes bacterianos altamente patogénicos, o por infecciones de etiología multifactorial (Dungworth, 1993; López, 1995; Piojan et al., 1999).
Los tres casos más severos en el estudio, descritos como neumonías extensivas, son de alguna manera, lesiones similares a las neumonías multilobulares de terneros y corderos (Dungworth, 1993). El término lobar, sin embargo, no es el más adecuado en alpacas, pues esta especie animal carece de cisuras interlobulares, lo que impide dividir los pulmones en lóbulos como ocurre en el bovino y ovino (López, 1993). Esta peculiaridad anatómica, también explicaría la dificultad de observar engrosamiento de los septos interlobulares, como sucede usualmente en el bovino. El abundante depósito de fibrina, sin embargo, fue evidente en los dos animales que presentaron nítidas adherencias pleurales (Fig. 2). La severidad de estas lesiones necesita un mayor tiempo evolutivo, pues fueron observadas en crías con edades mayores (31 días) que los animales con neumonías bilaterales purulentas (18 días) y congestión y edema pulmonar (20 días). Por otro lado, estas lesiones abarcaron ambos pulmones, pero comprometiendo principalmente el lóbulo apical derecho, que podría deberse a que la tráquea de la alpaca, antes de dividirse y formar los dos bronquios principales, da origen a una pequeña rama bronquial que penetra en el lóbulo apical derecho (Viera et al., 1968).
Los cambios macroscópicos descritos como neumonía bilateral purulenta (10/24) difieren del anterior grupo por la escasa presencia de focos necróticos en el parénquima pulmonar y la baja frecuencia de pleuritis fibrinosa (1/10). Las lesiones corresponden a una moderada a intensa consolidación rojiza parenquimal, igualmente a nivel cráneoventral, con tendencia a ser extensiva y con exudado muco-purulento. Las lesiones concuerdan con las neumonías agudas reportadas por Ameghino y DeMartini (1991) y las descritas como neumonías hemorrágicas agudas en crías menores de un mes de alpacas (R. Perales, datos no publicados). Estos tipos de neumonías, desprovistas de lesiones distintivas y circunscritas de tipo parches, corresponderían a las reportadas como bronconeumonías supurativas en especies bovinas (Dungworth, 1993; López, 1995).
La carencia de cisuras interlobulares de estos animales podría explicar la facilidad para alcanzar una distribución difusa y en periodos muy tempranos de la infección pulmonar. La congestión y edema en la mayoría de los 11 casos fue muy marcada, produciendo un intenso enrojecimiento, agrandamiento y brillantez tisular. Indudablemente, estos cambios corresponderían a las primeras alteraciones del daño pulmonar en todo proceso inflamatorio sobreagudo o agudo que se observa en estados iniciales de procesos neumónicos fatales en terneros y corderos (Kimberling et al., 1988; Martin, 1996).
Los cambios histopatológicos observados reflejaron las alteraciones macroscópicas. Los casos diagnosticados como neumonías extensivas (n=3) tuvieron cuadros microscópicos mucho más severos, comprometiendo parénquima pulmonar, pleura adyacente y ganglios linfáticos regionales. Microscópicamente, los cambios correspondieron a una bronconeumonía aguda fibrino-necrotizante supurativa y difusa. Estas lesiones, en términos generales, son muy similares a las descritas como bronconeumonías fibrinosas y pleuroneumonía en animales domésticos donde se observa el compromiso pleural dentro del proceso inflamatorio (Dungworth, 1993; López, 1995). La naturaleza aguda de las lesiones se sustenta en la presencia de una severa congestión capilar y abundante exudado fibrinoso dentro de los espacios alveolares, septos interlobulillares y pleura (Fig. 5b y Fig. 6a), así como la abundante infiltración inflamatoria mixta de macrófagos y neutrófilos (Fig. 6a). Asimismo, la severidad de la lesión se refleja por la extensa y difusa necrosis coagulativa asociada a la consistente presencia de nidos bacterianos (Fig. 4 y Fig. 5a). Cambios, igualmente, muy similares a los correspondientes a neumonías agudas y subagudas en otros tipos de animales (Dungworth, 1993; Ferreira de la Cuesta, 2003).
Las lesiones histopatológicas descritas como bronconeumonía supurativa difusa aguda, encontradas en 10/24 de los casos, son muy similares a las bronconeumonías supurativas descritas en rumiantes (Dungworth, 1993; López, 1995). Estos cambios suelen caracterizarse por tener cierta orientación bronquiolar, y tal vez expliquen el posible inicio infeccioso en la unión bronquiolo/alveolar y extensión bronquial por depósitos de agentes patógenos en estas regiones vulnerables, ocasionando exudado inflamatorio y presencia de detritus celular que oblitera el lumen de bronquios, bronquiolos y espacios alveolares. Estas alteraciones son comúnmente observadas en neumonías aspirativas (aerógenas) usualmente asociadas a agentes bacterianos (Martin, 1996). Las lesiones observadas en este segundo grupo, variaron en intensidad del compromiso vascular, infiltración celular y destrucción epitelial alveolar, bronquial y bronquiolar (Fig. 7a y Fig. 8a). Los casos más dramáticos comprometían destrucción epitelial asociada a extensas zonas necróticas acompañada, algunas veces, con zonas extensivas de desnudamiento celular del epitelio bronquial y bronquiolar, y abundante exudado y detritus celulares intraluminales (Fig. 7b y Fig. 8b). Estas alteraciones han sido atribuidas como consecuencia de replicaciones virales (Davies et al., 1981; Bryson et al., 1983; Domachowske y Rosenberg, 1999).
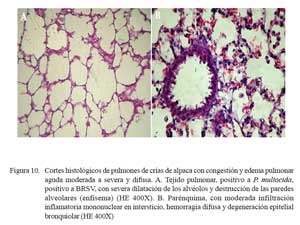
En los 11/24 de los casos con lesiones macroscópicas de congestión y edema pulmonar, la histopatología corroboró los cambios anatómicos. Las alteraciones histopatológicas mostraron una extensiva pletorización de vasos capilares alveolares y engrosamiento de los septos interalveolares por infiltración de escasa reacción inflamatoria y depósitos de abundante material proteináceo eosinofílico (edema) en los espacios alveo lares (Fig. 9a). Las lesiones estuvieron acompañadas de necrosis y degeneración de epitelios bronquiales y bronquiolares, así como diversos grados de hiperplasia celular (Fig. 9b); incluso se pudo identificar una severa extravasación eritrocítica asociada a rupturas de paredes alveolares (enfisema) (Fig. 10a). Los cambios enfisematosos son comúnmente observados en estadios de recumbencia y en estadios finales de infecciones pulmonares ocasionadas por la dificultad respiratoria e inspiraciones forzadas y profundas causales de ruptura de paredes alveolares, con la consecuente formación de enfisema y hemorragia (Fig. 10a).
La identificación y aislamiento simultáneo de agentes neumopatógenos en el 63% de los casos positivos, indican que las lesiones pulmonares agudas en crías de alpaca serían consecuencia de infecciones múltiples, de manera muy similar a los rumiantes (Davies et al., 1981; Kimberling et al., 1988; Martin, 1996). En 22/24 casos estudiados se logró identificar o aislar agentes patógenos y en 14 de estos casos hubo asociación de virus/ bacteria con predominancia de infecciones duales (n=10) seguido de presencia de triples agentes (n=4) (Cuadro 1). Las asociaciones duales y triples del BRSV fueron frecuentemente observadas en animales padeciendo bronconeumonía supurativa difusa aguda y congestión y edema pulmonar agudo, respectivamente. La identificación del virus PI3 fue detectada preferentemente en infecciones únicas. El virus PI3 se presentó mayormente en los casos con lesiones de mayor severidad (bronconeumonía fibrinonecrotizante supurativa difusa).
Las lesiones macro y microscópicas observadas en el presente estudio tienden a reflejar los diferentes estadios patológicos de todo proceso inflamatorio. Las manifestaciones iniciales, al parecer, se concentran en los casos diagnosticados como cuadros de congestión y edema pulmonar. En estos animales, la infección viral es más prevalente sugiriendo al virus como posible factor inicial en los procesos neumónicos. En nueve de las 10 crías, en este grupo, se identificaron agentes virales bajo la forma de infecciones únicas (n=2), infecciones duales (n=4) y triples (n=2) (Cuadro 1). Las infecciones virales en estos casos, podrían ser responsables de las lesiones necróticas observadas a nivel epitelial (bronquial, bronquiolar y/o alveolar) desencadenando, consecuentemente, congestión, extravasación sanguínea, hemorragias y formación de membranas hialinas (Bryson et al., 1979); lesiones consistentemente observadas en la mayoría de los animales afectados en este grupo (Fig. 9A y Fig. 9B).
Las lesiones más complicadas se visualizaron en animales padeciendo de bronconeumonía supurativa. En estas crías, se detectó la presencia mayoritaria del virus BRS (8/10) como infecciones únicas (n=1), duales (n=6) y triples (n=1), sugiriendo a este virus como el principal posible factor patogénico predisponente. El virus BRS tiene capacidad lítica del aparato mucociliar y, consecuentemente, hiperplasia celular en bronquios y bronquiolos, favoreciendo la colonización bacteriana. La elevada presencia del virus BRS en infecciones duales y triples (7/10), principalmente asociada con P. multocida (n=4), M. haemolytica (n=2) o virus PI3 (n=2) (Cuadro 1), refuerza a este virus como uno de los principales agentes productores de neumonías en alpacas, y corrobora la elevada prevalencia de este virus en alpacas de crianza comunitarias del sur del Perú (Manchego et al., 1998; Victorio et al., 2003).
Por otro lado, llama la atención la presencia del virus PI3 en 2/3 casos afectados con bronconeumonía fibrino-necrotizante (Cuadro 1) y en uno de estos casos asociado con M. haemolytica y P. multocida. Este virus, en corderos, es implicado como el principal factor predisponente para la severidad de las bronconeumonías asociadas principalmente a M. haemolytica (Davies et al., 1986; Kimberling et al., 1988). En esta asociación, se conoce que el virus PI-3 produce cambios degenerativos y necrosis de las células epiteliales bronquiolares y alveolares e hiperplasia del epitelio alveolar con formación de sincitios multinucleares y las bacterias responsables de la exudación fibrinosa (Bryson et al., 1979; Davies et al., 1981; Yener et al., 2005). Con excepción de presencia de sincitios, se observaron lesiones degenerativas y necróticas a nivel del epitelio alveolar y bronquiolar (Fig. 4) con severo compromiso pleural.
Es interesante señalar que los depósitos fibrinosos en rumiantes son generalmente a consecuencia de hiperinfecciones de M. haemolytica en animales expuestos a factores estresantes, incluyendo infecciones virales primarias (Davies et al., 1981, 1896; Trigo, 1998; Ferreira de la Cuesta, 2003). La presencia de M. haemolytica en dos de los tres casos más severos tiende a confirmar esta aseveración, sin poder descartar su participación en el tercer caso, ya que había recibido antibioterapia y presentaba nidos bacterianos cocobacilares intralesionales (Fig. 5a). El aislamiento de Pasteurella y Mannheimia en lesiones neumónicas corroboran los reportes iniciales de P. multocida (Ameghino y Calle, 1989), P. multocida y P. haemolytica (Mannheimia) (Arratia 1991) de muestras neumónicas de crías de alpacas en el altiplano peruano.
A pesar de que en el presente estudio no se elucidaron factores ambientales, el impacto ambiental es bastante evidente en la crianza de alpacas andinas pues la crianza es de manera extensiva y las pariciones ocurren en los meses más húmedos del año (Ameghino y DeMartini, 1991). Las muestras del presente estudio fueron colectadas en la época de parición, donde generalmente se observan eventos climáticos extremos con lluvias copiosas, nevadas, y presencia de los denominados veranillos (periodos cortos de ausencia de lluvias y cambios bruscos de temperatura). Estos cambios medioambientales son situaciones estresantes para el recién nacido que deben impactar en el sistema de defensa inmune, sobre todo del tracto respiratorio, predisponiéndolos inicialmente a infecciones virales y posteriormente a bacterias.
En este esquema, las infecciones virales, actuarían como factores primarios dañando o destruyendo el aparato muco-ciliar, favoreciendo la colonización bacteriana para el establecimiento de procesos bronconeumónicos (Cutlip y Lehmmbuhl, 1982; Davis et al, 1986; Donachowske y Rosemberg, 1999). Aquí, los virus PI-3 y BRS son los más prevalentes, y son conocidos agentes patológicos causales de bronconeumonías y neumonías lobares en rumiantes, y productoras de infecciones generalmente fatales cuando se asocian a infecciones por M. haemolytica y P. multocida (Zanabria et al., 2000; Yener et al., 2005).
CONCLUSIONES
-
Los resultados sugieren que las neumonías agudas en alpacas serían consecuencia, de manera similar a lo que ocurre en otros rumiantes, de múltiples agentes y, generalmente, por asociaciones entre virus (RSV, PI3) con Pasteurella multocida y Mannheimia hemolytica.
-
El estudio no descarta, sin embargo, la posible participación de otros posibles agentes neumotrópicos en el establecimiento y desarrollo de procesos similares.
LITERATURA CITADA
1. Ameghino E, Calle S. 1989. Aislamiento de Pasteurella multocida de procesos neumónicos en crías de alpacas. En: Libro de Resúmenes XII Reunión Científica Anual del APPA. Lima, Perú: APPA. p 99.
2. Ameghino E, DeMartini J. 1991. Mortalidad en crías de alpacas. Lima: RERUMEN. 128 p.
3. Arratia V. 1991. Agentes etiológicos de las neumonías en alpacas de la CAT Santa Lucía N.º 179. Tesis de Médico Veterinario y Zootecnista. Puno: Univ Nacional del Altiplano. 55 p.
4. Bryson DG, McFerran JB, Ball HJ, Neill SD. 1979. Observations on outbreaks of respiratory disease in calves associated with Parainfluenza type 3 virus and Respiratory Syncytial virus infection. Vet Rec 104: 45-49.
5. Bryson DG, Mcnulty MS, Logan EF, Cush PF. 1983. Respiratory syncytial virus pneumonia in young calves: clinical and pathologic findings. Am J Vet Res 44: 1648-1655.
6. Cowan ST. 1974. Cowan Steel's manual for the identification of medical bacteria. UK: Cambridge University Press. 238 p.
7. Davies DH, Herceg M, Jones BAH, Thurley DC. 1981. The pathogenesis of sequential infection with Parainfluenza virus type 3 and Pasteurella haemolytica in sheep. Vet Microbiol 6: 173-182.
8. Davies DH, Long DL, McCarthy AR, Herceg M. 1986. The effect of parainfluenza virus type 3 on the phagocytic cell response of the ovine lung to Pasteurella haemolytica. Vet Microbiol 11: 125-144.
9. Domachowske J, Rosenberg H. 1999. Respiratory syncytial virus infection: immune response, immunopathogenesis, and treatment. Clin Microbiol Rev 12: 298-309.
10. Dungworth DL. 1993. The respiratory system. In: Jubb KVF, Kennedy PC, Palmer N (eds). Pathology of domestic animals. USA: Academic Press. p 539-699.
11. Ferreira de la Cuesta G. 2003. Patología veterinaria. Colombia: Ed Universidad de Antioquia. 620 p.
12. Kimberling CV, Jenses R, Swift B. 1988. Diseases in sheep. 3rd ed. Philadelphia, USA: Lea & Febiger. 394 p.
13. López C. 1993. Estudio macro-microscópico del pulmón de la alpaca. Tesis de Médico Veterinario Zootecnista. Puno, Perú: Facultad de Medina Veterinaria y Zootecnia, Univ Nacional del Altiplano.
14. López A. 1995. The respiratory system. In: Carlton W, McGavin M (eds). Thomsons special veterinary pathology. 2nd ed. Philadelphia, USA: Mosby Year Book Inc. p 116-174.
15. Mamani E. 1992. Correlación de las alteraciones histológicas con los agentes etiopatológicos de las neumonías en alpacas (Lama pacos). Tesis de Médico Veterinario y Zootecnista. Puno, Perú: Univ Nacional del Altiplano. 51 p.
16. Manchego A, Rivera H, Rosadio R. 1998. Seroprevalencia de agentes virales en rebaño mixto de una comunidad andina peruana. Rev Inv Pec, IVITA 9(2): 1-10.
17. Martin WB. 1996. Respiratory infections of sheep. Comp Immunol Microb 19: 171-179.
18. Melo M. 1997. Sistemas de control y manejo sanitario de alpacas y llamas en la región del sur peruano. Puno, Perú. Facultad de Medina Veterinaria y Zootecnia, Univ Nacional del Altiplano. 54 p.
19. Piojan P, Aguilar F, Morales F. 1999. Caracterización de los procesos neumónicos en becerros lecheros de la región de Tijuana, Baja California, México. Vet Mex 30: 149-155.
20. Ramírez A. 1991. Enfermedades infecciosas. En: Fernández-Baca S (ed). Avances y perspectivas del conocimiento de los camélidos sudamericanos. Santiago de Chile: FAO. p 263-324.
21. Rivera H, Madewell BR, Ameghino E. 1987. Serologic survey of viral antibodies in the Peruvian alpaca (Lama pacos). Am J Vet Res 48: 189-191.
22. Slauson D, Cooper BJ. 2002. Mechanisms of disease. 3rd ed. St. Louis, Missouri, USA: Mosby Inc. 445 p.
23. Trigo F. 1998. Patogénesis y aspectos inmunológicos. 3° ed. México DF: McGraw-Hill Interamericana. 220 p.
24. Victorio W, Rivera H, Manchego A, Benito A, Quispe, R, Yaya K, Olazábal J, Rosadio R. 2003. Evidencias serológicas de virus neumotrópicos en alpacas de la provincia de Canchis, Cuzco, Perú. En: Memorias III Congreso Mundial sobre Camélidos. Potosí, Bolivia. II: 155-158.
25. Viera F, Sato A, Núñez Q. 1968. Los pulmones y la arborización bronquial de la alpaca. Rev Fac Med Vet, UNMSM 22: 54-60.
26. Yener Z, Saglam YS, Timurkaan N, Ilhan F. 2005. Immunohistochemical detection of parainfluenza type 3 Virus antigens in paraffin sections of pneumonic caprine lungs. J Vet Med A 52: 268-271.
27. Zanabria V, Rivera H, Rosadio R. 2000. Etiología del síndrome neumónico en vacunos de engorde en Lima. Rev Inv Vet, Perú 11(2): 67-85.