Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.4 Lima dic./dic. 2012
Identificación y evaluación de transportadores de glucosa SGLT1 y GLUT2 y la incretina Glp-1 en intestino delgado de cuyes (cavia porcellus)
Identification and assessment of glucose transporters SGLT1 and GLUT2 and incretin GLP-1 in the small intestine of guinea pigs (cavia porcellus)
Juan Anglas P.1, Sergio Cueva M.1, María Vásquez C.1, Boris Lira M.1, Juan Espinoza B.2, Juan Lucas L.3, José Rodríguez G.1,4
1 Laboratorio de Fisiología Animal,
2 Laboratorio de Farmacología y Toxicología Veterinaria,
3 Laboratorio de Salud Pública y Salud Ambiental, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
4 E-mail: joserodriguezmv@gmail.com
RESUMEN
El presente trabajo tuvo por objetivo identificar y evaluar la presencia de los transportadores de glucosa SGLT1 y GLUT2 y la incretina GLP-1 en intestino delgado de cuyes. Se usaron cinco cuyes (Cavia porcellus) reproductores de 90 días de edad. Luego del sacrificio, se tomaron muestras de duodeno, yeyuno e íleon para el procesamiento inmunohistoquímico. Se pudo identificar la presencia de SGLT1, GLUT2 y GLP-1 en las tres porciones intestinales, siendo SGLT1 la proteína de mayor presencia, con un nivel de marcación fuerte en la parte apical y media del eje cripta-vellosidad. El GLUT2 mostró un nivel de marcación fuerte en todo el eje cripta-vellosidad en el yeyuno. Asimismo, la presencia del GLP-1 fue analizada indirectamente por el número de células L/mm2 de mucosa intestinal, encontrándose el mayor número en el yeyuno (8.46 ± 1.16 células L/mm2) (p<0.05). Los resultados indican que SGLT1 sería el transportador de glucosa más importante en el cuy y, que a diferencia de otras especies, la mayor secreción de GLP-1 sería en yeyuno.
Palabras clave: SGLT1, GLUT2, GLP-1, intestino delgado, cuyes
ABSTRACT
The aim of this study was to identify and assess the presence of glucose transporters SGLT1 and GLUT2 and incretin GLP-1 in the small intestine of guinea pig (Cavia porcellus). Five animals of 90 days old were used. Samples from the duodenum, jejunum and ileum were collected after slaughtering to carry out immunohistochemistry assays. Expression of SGLT1, GLUT2 and GLP-1 was observed in all three portions of the small intestine, where SGLT1 showed the highest expression, with a strong staining intensity in the apical and medium section of the crypt-villus axis. GLUT2 showed a strong staining intensity throughout the crypt-villus axis in the jejunum. GLP-1 expression was indirectly analyzed by calculating the number of L cells per mm2 of intestinal mucosa, resulting that the jejunum had the largest number (8.46 ±1.16 cells/mm2) (p<0.05). The results suggest that SGLT1 glucose transporter would be the most important in the guinea pig, and unlike other species, GLP-1 may be mostly secreted by the jejunum.
Key words: SGLT1, GLUT2, GLP-1, small intestine, guinea pigs
INTRODUCCIÓN
La absorción intestinal de glucosa se produce a través de las rutas paracelular y transcelular. La ruta transcelular se considera que es la principal vía en condiciones fisiológicas normales (Cheeseman, 2002; Drozdowski y Thomson, 2006). Entre los transportadores de glucosa encargados de la absorción de glucosa desde la luz intestinal hacia los vasos sanguíneos se tiene al simportador de glucosa-sodio 1 (SGLT1), ubicado en la membrana apical del enterocito como una proteína transmembrana (Wright et al., 1994). Además, la glucosa puede usar otra proteína que pertenece a una familia distinta de transportadores de glucosa, el transportador de glucosa 2 (GLUT2), que fue conocido originalmente por ser un transportador de hexosas, ubicado siempre en la membrana basolateral del enterocito (Cheeseman, 1993).
Se ha demostrado que GLUT2 juega un papel importante en el transporte de hexosas a nivel apical cuando hay altas concentraciones de sustrato en la luz intestinal. GLUT2 se encuentra en vesículas en el citosol de los enterocitos, los cuales se movilizan hacia la membrana apical del enterocito cuando las concentraciones de glucosa luminal superan grandemente los valores de la concentración de la glucosa citoplasmática (Kellett y Helliwell, 2000).
El péptido similar al glucagón-1 (GLP-1) es secretado por las células entero-endocrinas L, que se encuentran principalmente en el íleon distal y colon. En contraste, el péptido inhibidor gástrico (GIP) es liberado por las células entero-endocrinas K que se localizan en las regiones más proximales del intestino delgado (duodeno y yeyuno). Sin embargo, las células endocrinas que producen GLP-1 o GIP, así como las células que producen otros péptidos, se pueden encontrar en todas las regiones intestinales en especies como el cerdo, la rata y el intestino delgado del humano (Mortensen et al., 2003; Theodorakis et al., 2006).
La administración oral, pero no parenteral, de glucosa, estimula la secreción de GLP-1 (Unger et al., 1968; Hermann et al., 1995). Su secreción se produce en roedores y humanos en un patrón bifásico a partir de una fase rápida (dentro de 10-15 minutos), seguido por un fase prolongada (30-60 min) (Hermann et al., 1995). Debido a que la mayoría de células L se encuentran en el intestino delgado distal, es poco probable que estas células participen en la primera fase de la secreción de GLP-1. De hecho, varios estudios han demostrado que el sistema nervioso autónomo, el neurotransmisor acetilcolina y el GIP pueden contribuir a la rápida liberación de GLP-1 después de la ingestión de nutrientes.
Se ha establecido, asimismo, en estudios en ratas que la vagotomía bilateral subdiafragmática bloquea la secreción de GLP-1 inducida por grasa, mientras que la estimulación eléctrica directa de la ramas celíacas del vago (que inervan el yeyuno, íleon y colon) aumenta la secreción de GLP-1 (Rocca y Brubaker, 1999).
La segunda fase o fase tardía de la secreción de GLP-1 es probablemente causada por la estimulación directa de las células intestinales L por los nutrientes digeridos (Roberge y Brubaker, 1991). Por lo tanto, las señales generadas en las células L pueden ser transmitidas indirectamente, a través de mediadores neuronales o endocrinos, o por contacto directo, para producir las fases temprana y tardía de la secreción de GLP-1, respectivamente.
Es posible que la secreción temprana de GLP-1 también pueda ocurrir por la asociación directa de los nutrientes con la células L que se ubican en las regiones más proximales del intestino delgado humano (Mortensen et al., 2003; Theodorakis et al., 2006). El GLP-1, por su función incretina estimula la secreción de insulina al unirse a su receptor (GLP1-R) en la célula β pancreática; además, actúa sinérgicamente con la glucosa para promover la transcripción del gen de insulina y la estabilidad del ARNm, y por lo tanto, tiene el potencial para reponer la insulina en las células β y prevenir el agotamiento de las células β (Drucker et al., 1987; Wang et al., 1997; Li et al., 2005). GLP-1 también inhibe el glucagón y estimula la secreción de la somatostatina, este último probablemente por la interacción directa con su GLP-1R en la célula δpancreática secretora de somatostatina (Fehmann y Habener, 1991). El mecanismo por el cual el GLP-1 inhibe la secreción de glucagón en las células α del páncreas no está claro; sin embargo, se debería a la unión directa al GLP-1R (Heller et al., 1997).
El objetivo del presente estudio fue identificar los transportadores de glucosa SGLT1 y GLUT2 y de las células L a través del péptido similar al glucagón 1 (GLP-1). Además, evaluar el grado de marcación del SGLT1 y GLUT2 en el eje cripta-vellosidad y cuantificar las células L en el eje cripta-vellosidad en el intestino delgado del cuy.
MATERIALES Y MÉTODOS
Animales y Preparación Tisular
Se usaron cinco cuyes reproductores de 90 días de edad de la línea comercial mejorada del Instituto Nacional de Innovación Agraria (INIA), Lima-Perú. Los animales se mantuvieron bajo temperatura controlada (~22 °C) y alimentados tres veces al día con concentrado y forraje verde. Los cuyes fueron sacrificados por sobredosis de pentobarbital sódico al 6.5%, tras un ayuno de 8 horas, y los segmentos del intestino delgado (duodeno, yeyuno e íleon) se colectaron en frascos que contenían formol al 10% para su procesamiento inmunohistoquímico.
El manejo y sacrificio de los animales se realizó siguiendo los Principios Directrices Internacionales para la Investigación Biomédica que implique el Uso de Animales del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS), Ginebra, 1985.
Localización Inmunohistoquímica de los Transportadores
Los segmentos intestinales fueron embebidos en parafina y se hicieron cortes de 4 m, que fueron montados en láminas portaobjetos positivadas con Poly-L-Lysine 0.1% (Sigma-Aldrich, EEUU). Los cortes fueron desparafinados, rehidratados y tratados por 10 min con metanol que contenía peróxido de hidrógeno para bloquear la peroxidasa endógena tisular.
Las láminas fueron sumergidas en buffer citrato en pH 6 para la recuperación antigénica que fue inducida por calor por 10 min, y se les incubó por 30 min en BSA (Bovine serum albumin) al 1% (Santa Cruz Biotechnology, EEUU). Luego se incubaron por 24 horas separadamente con anti-SGLT1 (Millipore, EEUU), anti-GLUT2 (Santa Cruz Biotechnology, EEUU) y anti-GLP-1 (Santa Cruz Biotechnology, EEUU); en los tres casos diluido a una concentración de 1:50.
Como sistema de detección se usó el sistema ABC de conejo (Santa Cruz Biotechnology, EEUU) por 30 min. Las láminas fueron lavadas con PBS y se revelaron al incubarlas con DAB por 1-2 min. La coloración de contraste fue con Hematoxilina de Harris. La reacción positiva del DAB presentaba una coloración marrón oscuro.
Análisis de Imágenes
Diversas secciones de las láminas fueron fotografiadas con una cámara digital (Canon Powershot G9, 12 megapixels, Japón) y objetivo de 40x. La cámara estaba incorporada al microscopio trinocular (Primo Star, Carl Zeiss, Alemania) para exámenes en campo claro en luz transmitida con un ocular WF 10x/20.
Se analizó la marcación específica de SGLT1, GLUT2 e incretina GLP-1 en el eje cripta-vellosidad del intestino delgado. Para esto, se dividió al eje en zona apical, zona media y cripta (Yang et al., 2011).
En el caso de SGLT1 y GLUT2, la intensidad de la marcación fue considerada como: 0) sin marcación; 1) marcación leve; y 2) marcación fuerte (Zanuzzi, 2010). En el caso de GLP-1 se cuantificó el número de células L/mm2 (Cani et al., 2007). Los datos fueron analizados estadísticamente mediante un análisis de varianza.
RESULTADOS Y DISCUSIÓN
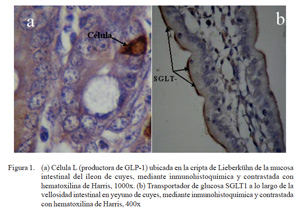
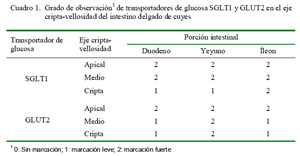
La presencia de las proteínas transportadoras de glucosa SGLT1 (Fig. 1) y GLUT2 se pudo observar en todas las porciones del intestino delgado (Cuadro 1). Se observó una marcación fuerte en la zona apical y media del eje cripta-vellosidad y leve en la zona de la cripta del SGLT1 en las tres porciones intestinales; coincidiendo con otros resultados de inmunohistoquímica, donde se determinó que el SGLT1 se encontraba en el borde en cepillo de los enterocitos (Boshuizen et al., 2003; Khoursandi et al., 2004; Habold et al., 2005). Asimismo, el SGLT1 se encontró principalmente en la zona apical y media del eje cripta vellosidad, tal y como lo señala Yang et al. (2011).

Se encontró una marcación fuerte del GLUT2 en la zona apical de las tres porciones intestinales y en todo el eje cripta vellosidad del yeyuno (Cuadro 1). La distribución de los transportadores GLUT2 y su localización a nivel de la membrana apical de los enterocitos se debe a las concentraciones de glucosa que pueda haber en la luz intestinal (Grefner et al., 2006; Gromova et al., 2006). Antes de los trabajos de Kellet y Helliwell (2000), solo se conocía que el transportador GLUT2 estaba presente en la membrana basolateral; sin embargo, ya se ha podido comprobar su presencia a nivel apical.
Mediante la técnica de inmunohistoquí-mica y usando el anticuerpo anti-GLP-1, se pudo evidenciar indirectamente la presencia de la hormona intestinal GLP-1, producidas por las células enteroendocrinas tipo L (Fig. 1). En el Cuadro 2 se observa que el número de células L es mayor en el yeyuno e íleon (porciones distales del intestino delgado), lo que implica una mayor secreción de GLP-1 en las porciones distales del intestino delgado y el colon, como es el caso de ratas, cerdos y humanos. La célula L es un tipo celular endocrino, cuya superficie apical tiene contacto con los nutrientes a nivel de la luz intestinal y a nivel basolateral con tejido neural y vascular (Holst, 2007). La secreción de GLP-1 por las células L es estimulado por una gran variedad de factores nutricionales, neurales y endocrinos, donde la ingestión de alimentos ricos en carbohidratos y grasas son estímulos fisiológicos (Kieffer y Habener, 1999; Anini y Brubaker, 2003; Mortensen et al., 2003; Brubaker, 2006; Theodorakis et al., 2006).
CONCLUSIONES
-
Los transportadores de glucosa SGLT1 y GLUT2 se encuentran presentes en todas las porciones del intestino delgado. La marcación fuerte del SGLT1en comparación del GLUT2 en la parte apical y media del eje cripta vellosidad, indicaría que el primero sería el de mayor importancia en la absorción de glucosa en el intestino delgado.
-
La mayor absorción de glucosa en el yeyuno por los transportadores de glucosa SGLT1 y GLUT2 estaría directamente relacionado con la mayor presencia de células L productoras de GLP-1.
LITERATURA CITADA
1. Anini Y, Brubaker PL. 2003. Musca-rinic receptors control glucagon-like peptide 1 secretion by human endocrine L cells. Endocrinology 144: 3244-3250.
2. Boshuizen J, Reimerink J, Korteland-Van Male M, Van Ham V, Koopmans M, Bül-ler H, et al. 2003. Changes in small intestinal homeostasis, morphology, and gene expression during rotavirus infection of infant mice. J Virol 77: 13005-13016.
3. Brubaker PL. 2006. The glucagon-like peptides: pleiotropic regulators of nutrient homeostasis. Ann N Y Acad Sci 1070: 10-26.
4. Cani P, Hoste S, Guiot Y, Delzenne N. 2007. Dietary non-digestible carbohy-drates promote L-cell differentiation in the proximal colon of rats. Brit J Nutrit 98: 32-37.
5. Cheeseman CI. 1993. GLUT2 is the transporter for fructose across the rat intestinal basolateral membrane. Gastroenterology 105: 1050-1056.
6. Cheeseman CI. 2002. Intestinal hexose absorption: transcellular or paracellular fluxes. J Physiol 544: 336.
7. Drozdowski L, Thomson A. 2006. Intestinal sugar transport. World J Gastro 12: 1657-1670.
8. Drucker DJ, Philippe J, Mojsov S, Chick WL, Habener JF. 1987. Glucagon-like peptide I stimulates insulin gene expression and increases cyclic AMP levels in a rat islet cell line. Proc Natl Acad Sci 84: 3434-3438.
9. Fehmann HC, Habener JF. 1991. Functional receptors for the insulinotropic hormone glucagon-like peptide-I (7-37) on a somatostatin secreting cell line. FEBS Lett 279: 335-340.
10. Grefner N, Gromova L, Gruzdkov A, Snigirevskaia E, Komissarchik I. 2006. Structural-functional analysis of diffusion in glucose absorption by rat small intestine enterocytes [en ruso]. Tsitologiia 48: 355–363.
11. Gromova L. Grefner N, Gruzdkov A, Snigirevskaia E, Komissarchik I. 2006. Comparative analysis of SGLT1 and GLUT2 transporters distribution in rat small-intestine enterocytes and Caco-2 cells during hexose absorption. Cell Tissue Biol 4: 354-361.
12. Habold C, Foltzer-Jourdainne C, Le Maho Y, Lignot J, Oudart H. 2005. Intestinal gluconeogenesis and glucose transport according to body fuel availa-bility in rats. J Physiol 566: 575-586.
13. Heller RS, Kieffer TJ, Habener JF. 1997. Insulinotropic glucagon-like peptide I receptor expression in glucagon-producing alpha-cells of the rat endocrine pancreas. Diabetes 46: 785-791.
14. Hermann C, Goke R, Richter G, Fehmann HC, Arnold R, Goke B. 1995. Glucagon-like peptide-1 and glucose-dependent insulin-releasing- polypeptide plasma levels in response to nutrients. Digestion 56: 117-126.
15. Holst JJ. 2007. The physiology of glucagon-like peptide 1. Physiol Rev 87: 1409-1439.
16. Kellett GL, Helliwell PA. 2000. The diffusive component of intestinal glucose absorption is mediated by the glucose-induced recruitment of GLUT2 to the brush-border membrane. Biochem J 350: 155-162.
17. Khoursandi S, Scharlau D, Herter P, Kuchnen C, Martin D, Kinne R, Kipp H. 2004. Different modes of sodium-D-glucose cotransporter-mediated D-glucose uptake regulation in Caco-2 cells. Am J Physiol-Cell Ph 287: 1041-1047.
18. Kieffer TJ, Habener JF. 1999. The glucagon-like peptides. Endocr Rev 20: 876-913.
19. Li Y, Cao X, Li LX, Brubaker PL, Edlund H, Drucker DJ. 2005. Beta-cell Pdx1 expression is essential for the glucoregulatory, proliferative, and cytoprotective actions of glucagon-like peptide-1. Diabetes 54: 482-491.
20. Mortensen K, Christensen LL, Holst JJ, Orskov C. 2003. GLP-1 and GIP are colocalized in a subset of endocrine cells in the small intestine. Regul Pept 114: 189-196.
21. Roberge JN, Brubaker PL. 1991. Secretion of proglucagon-derived peptides in response to intestinal luminal nutrients. Endocrinology 128: 3169-3174.
22. Rocca AS, Brubaker PL. 1999. Role of the vagus nerve in mediating proximal nutrient-induced glucagon-like peptide-1 secretion. Endocrinology 140: 1687-1694.
23. Theodorakis MJ, Carlson O, Michopoulos S, Doyle ME, Juhaszova M, Petraki K, Egan JM. 2006. Human duodenal enteroendocrine cells: source of both incretin peptides, GLP-1 and GIP. Am J Physiol 290: E550-E559.
24. Unger RH, Ohneda A, Valverde I, Eisentraut AM, Exton J. 1968. Characterization of the responses of circulating glucagon-like immuno-reactivity to intraduodenal and intravenous administration of glucose. J Clin Invest 47: 48-65.
25. Wang Y, Perfetti R, Greig NH, Holloway HW, DeOre KA, Montrose-Rafizadeh C, et al. 1997. Glucagon-like peptide-1 can reverse the age-related decline in glucose tolerance in rats. J Clin Invest 99: 2883-2889.
26. Wright EM, Hirayama BA, Loo DDF, Turk E, Hager K. 1994. Intestinal sugar transport. In: Physiology of the gastrointestinal tract. 3rd ed. Johnson LR (ed). New York: Raven. p 571-610.
27. Yang C, David M, Wang Z, Stoll B, Lackeyram D, Kendall C. 2011. Apical Na+-D-glucose cotransporter 1 (SGLT1) activity and protein abundance are expressed along the jejunal crypt-villus axis in the neonatal pig. Am J Physiol-Gastr L 300: 60-70.
28. Zanuzzi C. 2010. Efectos de la intoxicación con Solanum glaucophyllum (duraznillo blanco) sobre la proliferación, diferenciación y muerte celular en el intestino de conejos. Tesis Doctoral. Argentina: Univ Nac De La Plata. 286 p.