Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.23 n.4 Lima dic./dic. 2012
Seroprevalencia de anticuerpos contra serovares de leptospira spp en yeguas de un haras de la ciudad de Lima
Seroprevalence of antibodies against leptospira spp in mares from a stud in Lima
Carlos Sotomayor R.1, Alberto Manchego S.1,3, Kim Lam Chiok C.1, Nieves Sandoval C.2, Mercy Ramírez V.1, Miguel Rojas M.1, Hermelinda Rivera G.1.4
1 Laboratorio de Microbiología y Parasitología Veterinaria,
2 Laboratorio de Histología, Embriología y Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
3 E-mail: amanchegos@unmsm.edu.pe
4 E-mail: hriverag2005@yahoo.es
RESUMEN
Se determinó la prevalencia de Leptospira spp en yeguas de un haras de la ciudad de Lima con historial de aborto. Se tomaron 2 muestras de suero de todas las yeguas (n= 48) con un intervalo de 2 meses para la detección de anticuerpos contra 12 serovares de Leptospira mediante la prueba de microaglutinación. Los serovares fueron icterohaemorraghiae, canicola, pomona, bratislava, georgia, tarassovi, autumnalis, pyrogenes, hardjo, ballum, australis y gryppotyphosa. La prevalencia total de Leptospira spp fue de 96 y 100% en el primer y segundo muestreo, respectivamente. Anticuerpos contra los serovares canicola, icterohaemorraghiae, pomona y georgia fueron los más frecuentemente detectados durante los dos periodos de muestreos. No se encontró anticuerpos contra los serovares bratislava, tarassovi, autumnalis, hardjo, australis y gryppotyphosa. El 65% de los equinos fue positivo a anticuerpos contra tres serovares a la vez. El serovar de Leptospira con mayor frecuencia en el estudio fue georgia (100%), el cual no ha sido descrito en la literatura para equinos. El estudio demuestra la presencia ubicua y simultánea de distintos serovares de Leptospira en equinos.
Palabras clave: Leptospira spp, yeguas, prevalencia, prueba de microaglutinación, aborto
ABSTRACT
The seroprevalence of Leptospira spp in mares with abortion problems in a stud in Lima was determined. Two blood samples were collected from each mare within a 2-month period for the detection of antibodies against 12 Leptospira serovars using the microaglutination test. The serovars included in the study were icterohaemorraghiae, canicola, pomona, bratislava, georgia, tarassovi, autumnalis, pyrogenes, hardjo, ballum, australis and gryppotyphosa. Total prevalence of Leptospira spp was 96 and 100% in the first and second sampling respectively. Antibodies against serovars canicola, icterohaemorraghiae, pomona and georgia were more frequently detected during both period of sampling. No antibodies were found against serovars bratislava, tarassovi, autumnalis, hardjo, australis or gryppotyphosa. Sixty five percent of the animals were positive for three serovars simultaneously. The most frequent serovar was georgia (100%), which has not been reported as a pathogen for horses. The study showed the wide distribution of various Leptospira serovars in horses.
Key words: Leptospira spp, mares, prevalence, microaglutination test, abortion
INTRODUCCIÓN
La leptospirosis es una de las enfermedades zoonóticas de mayor distribución a nivel mundial (Szeredi y Haake, 2006). Es causada por la Leptospira spp, una espiroqueta de distribución ubicua que infecta diversas especies animales y cuyo hábitat de carácter tropical hace propicia su aparición en la costa peruana (Levett, 2001). El clima, tipo de manejo, presencia de animales portadores de la enfermedad, y vectores como los roedores, facilitan el mantenimiento de esta bacteria y la aparición de brotes esporádicos en equinos y vacunos; asimismo, este patógeno ocasiona serios problemas sanitarios en animales de compañía y en el humano (Céspedes, 2005).
Diversos estudios en el Perú confirman la presencia y distribución de la Leptospira en varias especies, incluyendo el hombre (Blair et al., 2004), donde ocasiona la Enfermedad de Weil, caracterizada por fiebre, ictericia y desórdenes hematológicos, hepáticos y renales. El contacto directo con animales infectados representa la mayor parte de infecciones en personas de granjas, veterinarios, y en trabajadores que requieren contacto directo o indirecto con animales o secreciones contaminadas por la bacteria (Gómez-Molina, 2005). El fenómeno de globalización, los cambios climáticos y las migraciones de animales y personas hacia nuevas zonas han propiciado que la leptospirosis sea considerada en la actualidad como un problema latente para cualquier población animal y humana (Guerreiro et al., 2001).
Los equinos representan un grupo de riesgo para contraer la enfermedad. La presentación de la enfermedad es primordialmente subclínica, y los signos clínicos incluyen abortos y uveítis recurrente (Quinn et al., 2005). Brotes de abortos han sido reportados en equinos de carrera en las zonas ecuestres de Estados Unidos, causando serios perjuicios económicos a los propietarios, y donde se pudo llevar a cabo estudios sobre la epidemiología, diagnóstico y aspecto clínico de la enfermedad (Donahue et al., 1992). En el Perú, la población equina se encuentra distribuida en el medio rural y en la costa. El Caballo Peruano de Paso y los Pura Sangre de Carrera son las razas de mayor presencia en la Costa, y son animales de un alto valor económico, por lo que se requiere prevenir y controlar esta enfermedad. El propósito del presente estudio fue detectar la prevalencia de anticuerpos contra Leptospira spp en caballos de un haras de la zona de Lima.
MATERIALES Y MÉTODOS
Animales y Muestras
El estudio incluyó a toda la población de yeguas (n=48) presentes en un haras del distrito de Chorrillos, provincia de Lima. Se identificaron 2 yeguas con historial de aborto y positivas al serovar georgia, dos semanas antes del muestreo, con títulos de 1/800. Todas las yeguas compartían los mismos corrales y su crianza era de tipo extensiva con alimentación a base de granos y alfalfa. En las instalaciones se encontró la presencia de roedores y canes que no contaban con ningún tipo de supervisión.
El primer muestreo se realizó en noviembre de 2007 y el segundo en enero de 2008. Se tomaron muestras de sangre de la vena yugular con agujas y tubos al vacío de 5 ml sin anticoagulante. Las muestras se trasladaron al Laboratorio de Microbiología de la Facultad de Medicina Veterinaria (FMV), Universidad Nacional Mayor de San Marcos (UNMSM), Lima, para la obtención del suero mediante centrifugación a 800 g (2500 rpm) por 5 min a temperatura ambiente. Los sueros fueron congelados a -20 °C hasta su utilización.
Serovares de Leptospira spp
Se tomaron como referencia serovares empleados en diversos trabajos en equinos: canicola (Donahue et al., 1991), icterohaemorrhagie (Castillo et al., 2007), pomona (Donahue et al., 1992), gryppotyphosa (Faber et al., 2000), bratislava (Donahue et al., 1992), tarassovi (Hodgin et al., 1989), ballum (Hodgin et al., 1989), pyrogenes (Gómez-Molina, 2005), australis (Castillo et al., 2007), hardjo (Donahue et al., 1991), autumnalis (Gómez-Molina, 2005) y georgia. Todos los serovares, a excepción de georgia, han sido descritos en la literatura revisada como patógenos que afectan equinos, roedores, caninos y humanos; sin embargo, el serovar georgia fue empleado debido a los resultados obtenidos en las dos yeguas con historial de aborto.
Detección de Anticuerpos Leptospirales
Se empleó la prueba de microaglutina-ción (MAT) para la detección de anticuerpos según el protocolo descrito por la OIE (2004). Primero se realizó una prueba tamiz de todas las muestras diluyéndolas en 1/100 frente a todos los serovares y luego se hizo la titulación de las muestras que resultaron positivas a los serovares. Las muestras positivas en 1/100 de cada serovar se diluyeron hasta 1/1600 a fin de determinar el título de anticuerpos según la prueba MAT. El título de anticuerpos se consideró como la máxima dilución de suero que causó aglutinación del 50% o más de antígeno vivo de Leptospira spp de acuerdo a las especificaciones del Manual de Pruebas Diagnósticas para Animales Terrestres de la OIE (OIE, 2004).
El cálculo de la prevalencia se hizo en base al número de reactores positivos para determinado serovar, dividido por el número de muestras, según la fórmula de prevalencia real para poblaciones finitas (Pita et al., 2004).
RESULTADOS
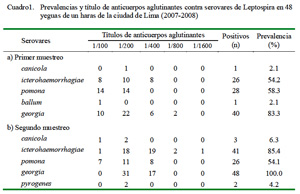
La prevalencia total de animales reactores positivos contra Leptospira spp fue de 96% (46/48) y de 100% (48/48) en el primer y segundo muestreo, respectivamente.
En el primer muestreo se determinó yeguas serorreactoras a 5 de los 12 serovares analizados, con títulos que variaron entre 1/100 a 1/800. El serovar georgia fue el de mayor seroprevalencia en el haras (83.3%). En el segundo muestreo se determinó yeguas serorreactoras a 6 serovares con títulos entre 1/100 a 1/1600 (Cuadro 2), donde el serovar georgia fue el de mayor seroprevalencia (100%).
Los serovares que mostraron un aumento de seroprevalencia entre el primer y segundo muestreo fueron canicola, icterohaemorrhagiae, georgia y pyro-genes, en tanto que pomona disminuyó ligeramente. En total, 2 animales fueron positivos a un solo serovar (4.2%), 10 a 2 serovares (20.8%), 31 a 3 serovares (64.6%), 3 a 4 serovares (6.3%) y 2 a 5 serovares (4.2%).
DISCUSIÓN
La presencia de anticuerpos en equinos contra distintos serovares de manera simultánea es un hallazgo común, en parte debido al carácter generalmente subclínico de la enfermedad (Donahue et al., 1992).
Los estudios serológicos de leptospira en equinos muestran una diversidad de serovares con variadas prevalencias, como el determinado en Kentucky, EEUU, donde se llegó a detectar al serovar pomona con 85% de prevalencia en una epizootia en 1990 (Donahue et al., 1992). Este serovar tuvo una seroprevalencia de 54 a 58% en el presente estudio, y es uno de los principales serovares involucrados en abortos de vacas en los establos lecheros de la zona.
El serovar canicola (6%) tiene una prevalencia muy variada en el continente. Se le encontró en el 4% en equinos en Cuba el 2007 (Castillo et al., 2007) y hasta 96% en caballos en México (Gómez-Molina, 2005). Asimismo, se encontró una gran diferencia en la seroprevalencia del serovar icterohae-morrhagiae (85%) con los hallazgos en Cuba donde se encontró una seroprevalencia de 5%, posiblemente debido al manejo de los equinos en el país que permiten la presencia de reservorios como roedores y caninos (Castillo et al., 2007).
Anticuerpos contra el serovar georgia estuvieron presentes en todas las yeguas durante el segundo muestreo; sin embargo, no se obtuvo información en la literatura científica sobre la presencia o prevalencia de este serovar en equinos de países vecinos. Por otro lado, su prevalencia en el total de animales implicaría su rol como hospederos de mantenimiento y, tal vez, un rol en la presencia de abortos, ya que se hallaron en yeguas que habían abortado previamente.
La cinética de anticuerpos contra cada uno de los serovares demuestra una dinámica activa en esta población. La fuente de infección está en los mismos animales cuyas secreciones son infecciosas para los demás animales y otras fuentes de infección no supervisadas como roedores y cánidos. Interesantemente, se observaron pocas seroconversiones verdaderas que indiquen enfermedad activa. Esto ocurrió en el serovar icterohaemorraghiae, donde el título inicial de 1:200 en el primer muestreo subió en el mismo animal, dos meses después, hasta 1:1600. Este tipo de seroconversión implica una infección activa y recuperación con generación simultánea de anticuerpos específicos contra el serovar involucrado.
LITERATURA CITADA
1. Blair PJ, Schoeler GB, Moron C, Anaya E, Caceda R, Cespedes M, Cruz C, et al. 2004. Evidence of rickettsial and leptospira infections in andean northern Peru. Am J Trop Med Hyg 70: 357-363.
2. Castillo JC, Rodríguez OC, Silveira EA, Casanova R, González Y. 2007. Prevalencia de leptospirosis en equinos de tracción en la ciudad de Santa Clara, Cuba. Revista Electrónica Veterinaria 8 (7) [Internet], [20 febrero 2008] Disponible en: http://www.veterinaria.org/revistas/redvet/n070707.html
3. Céspedes M. 2005. Leptospirosis: enfermedad zoonótica reemergente. Rev Perú Med Exp Salud Pública 22: 290-301.
4. Donahue JM, Smith BJ, Redmon KJ, Donahue JK. 1991. Diagnosis and prevalence of leptospira infection in aborted and stillborn horses. J Vet Diagn Invest 3: 148-151.
5. Donahue JM, Smith BJ, Donahoe JK, Rigsby CL, Tramontin RR, Poonacha KB, Wilson MA. 1992. Prevalence and serovars of leptospira involved in equine abortions in central Kentucky during the 1990 season. J Vet Diagn Invest 4: 279-284.
6. Faber NA, Crawford M, Lefebvre RB, Buyukmihcl NC, Madigan JE, Willits NH. 2000. Detection of Leptospira spp in the aqueous humor of horses with naturally acquired recurrent uveitis. J Clin Microbiol 38: 2731-2733.
7. Gómez-Molina TG. 2005. Serovarie-dades de Leptospira presentes en ganado de tres centros ecuestres pertenecientes al Ejército Mexicano. Rev Sanid Milit Mex 59: 260-264.
8. Guerreiro H, Croda J, Flannery B, Mazel M, Matzunaga J, Reis MG, Levett PN, et al. 2001. Leptospiral proteins recognized during the humoral immune response to leptospirosis in humans. Infect Immun 69: 4958-4968.
9. Hodgin EC, Miller DA, Lozano F. 1989. Leptospira abortion in horses. J Vet Diagn Invest 1: 283-287.
10. Levett PN. 2001. Leptospirosis. Clin Microbiol Rev 14: 296-326.
11. [OIE] Oficina Internacional de Epizootias. 2004. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. OIE [Internet], [09 marzo 2008]. Disponible en: http://www.oie.int/eng/normes/mmanual/A_00043.htm
12. Pita S, Pértegas S, Valdés F. 2004. Medidas de frecuencia de enfermedad. Metodología de la investigación. Fisterra. Metodología de la investigación. [Internet], [10 marzo 2008]. Disponible en: http://www.fisterra.com/mbe/investiga/medidas_frecuencia/med_frec.asp
13. Quinn PJ, Markey BK, Carter ME, Donnelly WJC, Leonard FC. 2005. Microbiología y enfermedades infecciosas veterinarias. Zaragoza: Acribia. 678 p.
14. Szeredi L, Haake DA, 2006. Immuno-histochemical identification and patholo-gic findings in natural cases of equine abortion caused by leptospiral infection. Vet Pathol 43: 755-761.