Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú v.24 n.1 Lima 2013
Prevalencia de anticuerpos contra Paramyxovirus aviar tipo 1 en pavos de crianza familiar en cuatro provincias de Lima, Perú
Prevalence of antibodies against avian Paramyxovirus type 1 in backyard turkeys in four provinces of Lima, Peru
Franklin Santa Cruz J.1, Eliana Icochea D.1,3, John Guzmán G.1, Alberto Manchego S.2
1 Laboratorio de Patología Aviar,
2 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
3 E-mail: eliana.icochea@gmail.com
RESUMEN
El objetivo del presente estudio fue determinar la prevalencia de anticuerpos contra Paramixovirus Aviar Tipo 1 (APMV-1) en pavos de crianza familiar (n=388) en cuatro provincias del departamento de Lima (Lima, Huaral, Huaura y Barranca), Perú. Las muestras fueron colectadas durante los meses de agosto a diciembre de 2008, y fueron analizadas mediante la prueba serológica de Inhibición de la Hemoaglutinación. Se encontró una prevalencia de 3.9%, observándose que 15/388 pavos presentaron títulos de anticuerpos compatibles a un desafío viral con cepas de campo del PMVA-1. La mayor frecuencia de muestras positivas (10/15) se observó en la provincia de Lima, mientras que no se tuvo muestras positivas en la provincia de Barranca. Se concluye que los pavos de crianza familiar de tres provincias de Lima estuvieron expuestos a alguna cepa de PMVA-l, constituyendo un reservorio del virus.
Palabras clave: prevalencia, anticuerpos, paramyxovirus aviar tipo I, prueba de inhibición de la hemoaglutinación, pavos de traspatio
ABSTRACT
The objective of the study was to determine the prevalence of antibodies against avian Paramyxovirus type 1 (APMV-1) in backyard turkeys (n=388) in four provinces of Lima, Peru (Lima, Huaral, Huaura, and Barranca). Blood samples were collected from August to December 2008 and analyzed by hemagglutination inhibition test. The resulting seroprevalence was 3.9% as 15/388 turkeys showed antibody titers consistent with a viral challenge of APMV-1. The highest frequency of positive samples (10/15) was observed in the province of Lima, whereas none sample was positive in the Barranca province. It is concluded that backyard turkeys in three provinces of Lima were exposed to some strains of PMVA-l, constituting a reservoir of virus.
Key words: prevalence, antibodies, avian paramyxovirus type I, hemagglutination inhibition, backyard turkeys
INTRODUCCIÓN
Se denomina Enfermedad de Newcastle (ENC) a todos los brotes ocasionados por cepas virulentas del Paramixovirus Aviar Tipo-1 (APMV-1), siendo también llamada Virus de la Enfermedad de Newcastle (VENC). Es una de las enfermedades endémicas de mayor importancia económica en la avicultura comercial (Alexander y Senne, 2008). Es altamente contagiosa y ocasiona un deterioro del comportamiento productivo del ave (disminución del crecimiento, secuelas respiratorias y nerviosas irreversibles, disminución en la producción de huevos y alta mortalidad); además de afectar el mercado externo por la prohibición de exportar productos de aves de zonas infectadas (Piacenti et al., 2006).
Desde que se reconoció esta enfermedad en 1926 en Java, Indonesia, han ocurrido cuatro grandes panzootias (Yu et al., 2001; Liu y Cao, 2005), afectando a un amplio rango de hospederos, y reportándose en al menos 250 especies susceptibles pertenecientes a 27 de las 50 órdenes de aves (Carter et al., 2005; Camacho-Escobar et al., 2009); sin embargo, la virulencia varía considerablemente según el huésped, y es dependiente de los epítopes del virus y el estado inmunológico del ave.
En el Perú, la enfermedad de Newcastle se encuentra presente desde la década del 50. En los últimos años, el Servicio Nacional de Sanidad Agraria (SENASA) ha reportado a la Organización Mundial de Sanidad Animal (OIE, 2008) diversos brotes de la enfermedad en aves comerciales en Moquegua (setiembre de 2002) y Lima (febrero de 2003), y en aves de traspatio en Tacna (marzo de 2008). Actualmente, la enfermedad parece estar controlada.
Aun cuando el control de la enfermedad está basado en estrictas medidas de bioseguridad y vacunación, en muchos países en vías de desarrollo se presentan brotes diseminados, que continúan devastando las poblaciones de traspatio (Villegas y Avellaneda, 2005). La OIE, antes Oficina Internacional de Epizootias, presenta dentro de la Lista de Enfermedades Notificables a la ENC como una de las enfermedades más importantes que afectan a las aves, definiéndola como una enfermedad de notificación obligatoria si el virus tiene un Índice de Patogenicidad Intracraneal (IPIC) en pollos (Gallus gallus) mayor a 0.7 o cuando con pruebas moleculares se determina que el virus posee múltiples aminoácidos básicos en el extremo C – terminal de la proteína F2 y fenilalanina residuo 117 que es el extremo N – terminal de la proteína F1 (OIE, 2008).
La ENC ha sido ampliamente estudiada en pollos, gallinas y aves silvestres; sin embargo, en pavos no se dispone de mucha información, por lo que se hace difícil entender la epidemiología del virus de la enfermedad de Newcastle en esta especie. El objetivo del presente estudio fue determinar la prevalencia de anticuerpos contra el Paramixovirus Aviar Tipo 1 en pavos de crianza familiar en la zona de Lima, mediante la prueba serológica de Inhibición de la Hemoaglutinación.
MATERIALES Y MÉTODOS
El estudio se realizó durante los meses de agosto a diciembre de 2008 en poblaciones de pavos de crianza familiar ubicadas en cuatro provincias del departamento de Lima (Lima, Huaral, Huaura y Barranca). Las muestras fueron procesadas en el Laboratorio de Patología Aviar de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), Lima.
Al no contar con estudios previos sobre la prevalencia del Paramyxovirus Aviar Tipo 1 (PMVA-1 ) en pavos de crianza familiar en el país, el tamaño muestral de 385 fue calculado mediante la fórmula de proporciones para poblaciones infinitas, considerando la proporción de 0.5 (Daniel, 1996).
En el estudio se tomaron 388 muestras de sangre de pavos de crianza familiar desde 3 meses hasta 2 años de edad. Se colectó entre 1 a 2 ml de sangre mediante punción de la vena alar. El suero fue decantado y conservado en congelación a -20 ºC. Las muestras fueron analizadas mediante la prueba de Inhibición de la Hemoaglutinación (HI) usando cuatro unidades hemaglutinantes de antígeno, según el procedimiento descrito en el Manual de la OIE (OIE, 2008).
La interpretación de los resultados se realizó de acuerdo a los criterios seguidos en un estudio previo (Ferrer et al., 2008), donde se tiene en cuenta los niveles de anticuerpos dependiendo del número de vacunaciones aplicadas a las aves. La prevalencia de PMVA-1 se determinó mediante la fórmula de prevalencia descrita por Ahlbom y Norel (1990), con su respectivo intervalo de confianza al 95%.
RESULTADOS
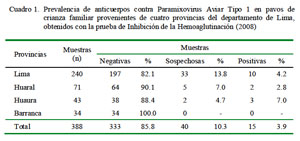
Quince (15/388) muestras de pavos de traspatio presentaron títulos de anticuerpos compatibles con desafío de campo al PMVA- 1, obteniéndose una prevalencia de 3.9% (Cuadro 1).
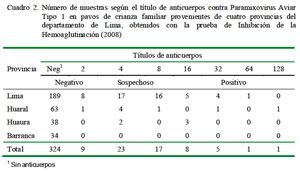
La mayor proporción de muestras positivas (10/ 240) con títulos de anticuerpos contra el PMVA-1 similares o superiores a 1:16 se observó en la provincia de Lima, mientras que en la provincia de Barranca no se observó seropositividad en ninguna de las muestras analizadas (Cuadro 2).
DISCUSIÓN
El 3.9% de prevalencia encontrada en pavos de crianza familiar en cuatro provincias del departamento de Lima, Perú, fue menor a la prevalencia de 9.9 ± 3.2% en aves de crianza no tecnificada y de 1.8 ± 1.3% en aves de crianza tecnificada en un estudio realizado en 2011 en Lima con la prueba de HI (Ferrer et al., 2008).
Los resultados indican una prevalencia baja de anticuerpos contra PMVA-1 en pavos de crianza no tecnificada, coincidiendo con evaluaciones realizadas a nivel nacional por la entidad competente (SENASA), que considera que el virus de la ENC se encuentra endémico en el departamento de Lima. Icochea (2007) menciona que los brotes de la ENC en el país, ocurren principalmente a nivel de aves de riña y pequeños criadores. Las aves de crianza no tecnificada presentan mayor riesgo de infectarse con el virus del PMVA-1 por carecer de vacunaciones, por falta de bioseguridad y por la crianza conjunta de aves de varias especies y de diferentes edades, lo que eleva la probabilidad de la presencia de aves portadoras.
La mayor prevalencia en la provincia de Lima puede ser debida a la concentración de la población avícola que ocurre como consecuencia del transporte a los mataderos de aves vivas procedentes de diferentes partes del país, a lo cual se añade las aves criadas dentro del área limeña. A esto se suma la falta de medidas de bioseguridad agravada por la cercanía entre los diferentes tipos de explotación: tecnificada, a pequeña escala y de traspatio.
Las zonas ubicadas al norte de la provincia de Lima, como Huaral, Huaura y Barranca, que se caracterizan por criar diferentes especies y edades de aves en pequeñas poblaciones y a campo abierto, constituyen mayor riesgo en la transmisión de ENC, por que su índice de prevalencia es solamente 0.78% menor que el índice encontrado en Lima, a pesar de la menor concentración de aves.
La ocurrencia de la enfermedad de Newcastle ha sido reportada de manera constante en el Perú. Cortez (1970) e Inga (1991) la describieron como una de las principales enfermedades de diagnóstico en el Laboratorio de Patología Aviar de la FMVUNMSM. Por otro lado, Icochea (2007) determinó que el virus debe contar con la presencia de aves susceptibles para que se pueda mantener como endémico.
La prueba HI mide esencialmente el estado de infección latente y no la manifestación clínica de la ENC; existiendo factores epidemiológicos que afectan de manera distinta a cada especie (Nishizawa et al., 2007; Alexander y Senne, 2008). Hernandez-Divers et al. (2006) mencionan que la tasa máxima de anticuerpos es detectada después de 3 a 3.5 semanas post-infección, de modo que si el suero es examinado antes de este tiempo, es probable que los anticuerpos no puedan ser detectados.
CONCLUSIONES
-
Se detectaron anticuerpos contra Paramixovirus Aviar Tipo 1 (APMV-1) en 15/388 muestras de pavos de crianza familiar en las provincias de Lima, Huaral, Huaura y Barranca, del departamento de Lima, Perú, determinando una prevalencia de 3.9%.
-
Los resultados sugieren que hay mayor proporción de aves portadoras dentro de la crianza de traspatio, y por lo tanto tienen un rol mayor en la epidemiología de la enfermedad de Newcastle que las aves de crianza tecnificada en el departamento de Lima, Perú.
LITERATURA CITADA
1. Ahlbom A, Norel S. 1990. Introduction to modern epidemiology. 2nd ed. UK: Blackwell Scientific. 268 p.
2. Camacho-Escobar MA, Pérez-Lara E, Arroyo-Ledezma J, Sánchez-Bernal E, Jiménez-Galicia M. 2009. Backyard turkeys as diseases reservory for wild birds and poultry in three ecosystems of the Mexican coast. Trop Subtrop Agroecosys 10: 109-115.
3. Alexander J, Senne DA. 2008. Newcastle disease, other avian Paramixoviridae and avian Pneumovirus infecctions. In: Saif YM, Fadly AM, Glison JR, McDougald LR (eds). Diseases of poultry. 12° ed. USA: Blackwell Publishing. p 75-100.
4. Carter GR, Wise DJ, Flores EF. 2005. Paramyxoviridae. In: A concise review of veterinary virology. New York: Internacional Veterinary Information Services. p 125-131.
5. Cortez S. 1970. Estudios retrospectivos de las principales enfermedades diagnosticadas en el Laboratorio de Patología Aviar durante 1956-1969. Tesis de Médico Veterinario. Lima: Univ Nacional Mayor de San Marcos. 22 p.
6. Daniel D. 1996. Bioestadística base para el análisis de las ciencias de la salud. 5° ed. México DF: Trillas. 78 p.
7. Ferrer R, Icochea, E, Salas A, Alba M. 2008. Prevalencia de anticuerpos contra el virus de la enfermedad de Newcastle en Gallus gallus de Lima: Estudio de caso control. Rev Inv Vet, Perú 19: 67-74.
8. Icochea M. 2007. Interrelación entre aves silvestres y enfermedad de Newcastle. Tesis de Magíster. Lima: Univ Nacional Mayor de San Marcos. 78 p.
9. Inga E. 1991. Análisis estadístico retrospectivo de las principales enfermedades diagnosticadas en el Laboratorio de Patología Aviar en los últimos diez años. Tesis de Médico Veterinario. Lima: Univ Nacional Mayor de San Marcos. 23 p.
10. Liu X, Cao Y. 2005. Newcastle disease virus evolution: multiple genetic lineages and virulence variation with adaptation in different host species. In: 14th World Veterinary Poultry Congress. Istambul, Turkey. p 150-151.
11. Hernandez-Divers SM, Villegas P, Prieto F, Unda JC, Stedman N, Ritchie B, Carroll R, Hernandez-Divers SJ. 2006. A survey of selected avian pathogens of backyard poultry in Northwestern Ecuador. J Avian Med Surg 20: 147-158.
12. Nishizawa M, Paulillo AC, Nakaghi LS, Nunes AD, Campioni JM, Doreto JL. 2007. Newcastle disease in white Pekin ducks: response to experimental vaccination and challenge. Rev Bras Cienc Avic 9(2): 85 -91.
13. [OIE] Organización Mundial de Sanidad Animal. 2008. Código sanitario para los animales terrestres. Enfermedad de Newcastle. Cap 2.3.14: p 576-589.
14. Piacenti AM, King DJ, Seal BS, Brown CC. 2006. Pathogenesis of Newcastle disease in commercial and specific pathogen-free turkeys experimentally infected with isolates of different virulence. Vet Pathol 43: 168-178.
15. Villegas P, Avellaneda G. 2005. Enfermedad de Newcastle. En: XVI Congreso Asociación Peruana de Avicultura. Lima.
16. Yu L, Wang Z, Jiang Y, Chang L, Kwang J. 2001. Characterization of newly emerging Newcastle disease virus isolates from Peopless Republic of China and Taiwan. J Clin Microbiol 39: 3512-3519.