Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.24 n.2 Lima abr./jun. 2013
ARTÍCULOS PRIMARIOS
Evaluación de una técnica inmunohistoquímica para el diagnóstico de neoplasias mamarias mixtas en caninos
Evaluation of an immunohistochemical technique for the diagnosis of mixed mammary tumors in bitches
Cyntia Rodríguez C.1, Gilberto Santillán A.1,2, Rosa Perales C.1, Alfonso Chavera C.1
1 Laboratorio de Histología, Embriología y Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 E-mail: betvet_1@hotmail.com
RESUMEN
El objetivo del presente estudio fue evaluar una técnica inmunohistoquímica (IHQ) para el diagnóstico de neoplasias mamarias mixtas (NMM) en caninos, usando anticuerpos monoclonales anti-citoqueratina AE1/AE3 y anti-vimentina, que son empleados en el diagnóstico de neoplasias mamarias en humanos. Se tomaron 20 muestras de tejidos parafinados de neoplasias caninas diagnosticadas histológicamente por hematoxilina y eosina (HE) como NMM. Cada muestra fue cortada a 4 µm de espesor, obteniéndose tres láminas por muestra. Una fue coloreada con HE para confirmar la viabilidad del tejido y en las otras dos láminas se realizó la IHQ mediante el método de Streptavidina-Biotina. Las células epiteliales reaccionaron de manera positiva con el anticuerpo anti-citoqueratina AE1/AE3 dando una coloración marrón a nivel citoplasmático. El anticuerpo anti-vimentina reaccionó de manera positiva con los fibroblastos, el tejido conectivo, las células mioepiteliales y las células cartilaginosas, dando una coloración semejante al anterior. Todas las neoplasias benignas reaccionaron contra ambos anticuerpos, mientras que el 73% de las neoplasias malignas reaccionaron de manera positiva contra el anticuerpo anti-citoqueratina. Se concluye que las NMM en caninos pueden ser diagnosticadas mediante la técnica de IHQ usando los anticuerpos monoclonales empleados en humanos.
Palabras clave: neoplasias mamarias, inmunohistoquímica, citoqueratina, vimentina
ABSTRACT
The aim of the study was to evaluate an immunohistochemical technique for the diagnosis of canine mixed mammary tumors (CMMT) using anti-cytokeratin AE1/AE3 and anti-vimentin monoclonal antibodies that are routinely used in the diagnosis of human mammary tumors. Twenty paraffin tissue blocks of canine mixed mammary tumors, previously diagnosed by hematoxilin-eosin (HE) histopathology were used. Three slides sets, 4 µm thick, were obtained per tissue block. One was stained with HE to confirm the viability of the tissue, and the other two were used for the immunohistochemistry through the Streptavidin-Biotin-labeled method. Epithelial cells positively reacted against the anti-cytokeratin AE1/AE3 showing a brown colour at the cytoplasma level. Fibroblasts, connective tissue, myoepithelial cells, cartilage cells and bone areas showed a brown colour against the anti-vimentin antibody. All benign tumors reacted positively to both antibodies, whereas 73% malign tumors were positive with the anti-cytokeratin antibody. It is concluded that mixed mammary neoplasm in dogs may be diagnosed by the technique of immunohistochemistry using monoclonal antibodies used in the detection of human mammary tumors.
Key words: mammary neoplasms, immunohistochemistry, cytokeratin, vimentin
INTRODUCCIÓN
El estudio de las neoplasias mamarias en caninos reviste importancia por su alta frecuencia de presentación. Constituyen la segunda forma más común de neoplasia en caninos después de las neoplasias epiteliales. El adenocarcinoma mamario fue la neoplasia más frecuente encontrada, seguida de la neoplasia mamaria mixta en un estudio en Lima, Perú (Tabacchi et al., 2000). Las neoplasias mamarias pueden originarse de las células que revisten los conductos y alvéolos, de las células mioepiteliales o de células del tejido conectivo adyacente (Aburto y Chávez, 1997).
Los componentes histológicos en las neoplasias mamarias mixtas se caracterizan por la presencia de células fusiformes y mioepiteliales, acompañadas de tejido conectivo, adiposo, óseo o cartilaginoso; los cuales son factores determinantes en el diagnóstico de este tipo de neoplasias. La complejidad de las neoplasias mamarias mixtas contribuye a que el diagnóstico de las células que lo originan resulte dudoso; de allí la necesidad de determinar con mayor precisión el origen de las células en estas neoplasias a fin de ofrecer un pronóstico y tratamiento más adecuado (Vos et al., 1993).
La técnica de inmunohistoquímica resulta ser una herramienta muy útil en la caracterización del componente celular neoplásico y del tipo celular que lo origina, en especial en aquellos casos donde la histoquímica no puede detectar el estirpe celular de la neoplasia. Esta técnica se basa en la reacción antígeno-anticuerpo en búsqueda del comportamiento celular, además de corroborar el diagnóstico histológico de las neoplasias, definiendo principalmente el origen celular de dicha patología (Vos et al., 1993). La base de la técnica es la búsqueda de los filamentos intermedios, que vienen a ser los antígenos que se desean ubicar en la célula. Los anticuerpos, monoclonales o policlonales comerciales, son los anti-filamentos intermedios (Elías, 1990).
Los filamentos intermedios son proteínas que forman parte del citoesqueleto de las células. Existen seis grupos de proteínas y cada grupo es específico para cada estirpe celular (con algunas excepciones), y son las citoqueratinas tipo I, citoqueratinas tipo II, vimentina, desmina y proteína glial fibrilar ácida (tipo III), neurofilamentos (tipo IV), lámina nuclear (tipo V) y nestina (tipo VI) (Lodish et al., 2002). El grupo de las citoqueratinas varía según su peso molecular y punto isoeléctrico, y se encuentran en el citoplasma de todas las células epiteliales (Elías, 1990). La vimentina es una sola pro- teína, que se encuentra en las células mesenquimales como, por ejemplo, en células endoteliales, fibroblastos, células mioepiteliales de glándula mamaria, condrocitos y adipocitos (Lodish et al., 2002).
El objetivo del presente estudio fue evaluar una técnica inmunohistoquímica utilizando los anticuerpos monoclonales anticitoqueratina AE1/AE3 y anti-vimentina empleados en el diagnóstico de neoplasias mamarias en humanos, para su empleo en el diagnóstico de neoplasias mamarias mixtas en caninos.
MATERIALES Y MÉTODOS
La selección, procesamiento, lectura y diagnóstico inmunohistoquímico (IHQ) de los casos diagnosticados histopatológicamente como neoplasias de glándula mamaria canina, se llevó a cabo en el Laboratorio de Histología, Embriología y Patología Veterinaria de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima.
Se trabajó con 20 muestras de tejidos parafinados de neoplasias previamente diagnosticadas por histopatología con H-E como neoplasias mamarias mixtas benignas o malignas. Las muestras fueron tomadas a caninos hembras de varias edades y razas, y analizadas en el laboratorio en el 2008.
Los tejidos parafinados fueron cortados a 4 µm de espesor, obteniéndose tres láminas por muestras. Una fue coloreada con HE para confirmar la viabilidad del tejido y en las otras dos láminas se realizó la IHQ mediante el método de Streptavidina-Biotina, siguiendo el protocolo propuesto por Sedano et al. (1997). Para esto, se emplearon los anticuerpos monoclonales citoqueratin AE1/ AE3 (Keratin, Pan Ab1) y Vimentin (Ab-2), así como el Kit Universal de Inmunohistoquímica anti-polivalente HRP/DAB (Lab Vision Corp).
RESULTADOS
El rango de edades de los animales que presentaron las neoplasias mamarias mixtas fue entre 4 y 17 años, con una mayor frecuencia entre 8 y 11 años de edad (12/20). Los canes de raza presentaron mayor incidencia de neoplasias mamarias mixtas (13/ 20) que los mestizos, en el que destaca la raza Cocker (6/20). En los protocolos de recepción no constaba si la neoplasia fue inicial o recidivante, y tampoco se mencionaba su ubicación en la cadena mamaria.
Quince casos estaban clasificados como tumores mamarios mixtos malignos y cinco como tumores mamarios mixtos benignos. En las neoplasias malignas, se observó a nivel histopatológico pérdida de la organización tubular, con proliferación de células epiteliales atípicas a nivel de los conductos y alvéolos (15/20), observándose anisocitosis y anisocariosis (15/20). Los 20 tumores presentaron metaplasia de células mioepiteliales en las que se observó un aumento de tejido conectivo, con áreas de tejido mixoide, áreas de cartílago y tejido óseo.
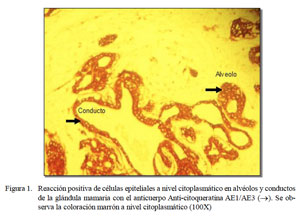
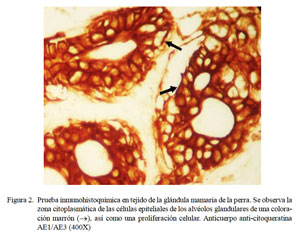
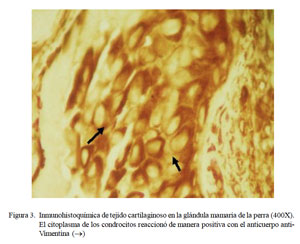
En el procedimiento inmuno-histoquímico, el anticuerpo anti-citoqueratina AE1/ AE3 reaccionó con las células epiteliales que revisten los conductos y los alvéolos glandulares de forma positiva adquiriendo una coloración marrón a nivel citoplasmático (Fig. 1 y Fig. 2). El anticuerpo anti-vimentina resaltó la coloración marrón a nivel citoplasmático de las células mioepiteliales, de los fibroblastos del tejido conectivo, así como de las células que ocupaban el área mixoide. Asimismo, se observó tinción positiva donde hubo presencia de células cartilaginosas (Fig. 3).
Todas las neoplasias mamarias mixtas benignas reaccionaron de manera positiva a los dos anticuerpos; mientras que el 73% de las neoplasias malignas dieron positivo al anticuerpo anti-citoqueratina.
DISCUSIÓN
En el presente estudio se utilizaron anticuerpos contra citoqueratinas de alto y bajo peso molecular, los cuales reaccionaron de manera positiva con las células de tipo epitelial, tanto en los tumores mixtos benignos como en los malignos, tal y como lo reportan Aburto y Chávez (1997) y Zuccari et al. (2001). El anticuerpo anti-citoqueratina AE1/AE3 es un marcador del componente epitelial, tanto de tejidos normales como de neoplasias mamarias, independientemente del grado de malignidad.
A pesar de ser un método relativamente simple, la técnica de inmunohistoquímica tiene puntos críticos como son el tipo de fijador usado y la recuperación antigénica. Ferreira et al. (2004) señala que el formol bufferado disminuye la pérdida de inmunoreactividad del tejido; sin embargo, en el presente estudio, las muestras se fijaron en formol al 10% por 24 horas, encontrándose un desenmascaramiento antigénico en el total de las muestras. Asimismo, Elías (1990) y Boenisch (2001) no reportaron inconvenientes en la inmunoreactividad de los antígenos tisulares el emplear un tiempo de fijación de 12 a 24 horas utilizando formol al 10%.
En el presente estudio, las células mioepiteliales, el área mixoide y las células condroides demostraron positividad contra el anticuerpo anti-vimentina (Aburto y Chávez, 1997), debido a que la expresión de vimentina aumenta a medida que las células pierden cohesión, contrario a lo observado con las citoqueratinas cuya intensidad está influenciada por el grado de contacto entre célula y célula.
Las edades de los caninos con neoplasias mamarias coinciden con otros reportes (Moulton, 1990). En forma similar, la literatura describe una mayor proporción de casos de neoplasia en canes de razas puras en relación a mestizos (Jubb et al., 1991), especialmente en las razas Cocker Spaniel y Dachshund (Owen, 1991).
CONCLUSIONES
Se comprobó el origen blastodérmico epidermal y mesenquimal de las neoplasias mamarias mixtas en caninos mediante la técnica de IHQ con los anticuerpos monoclonales anti-citoqueratina AE1/AE3 y anti-vimentina, de uso en el diagnóstico de neoplasias mamarias en humanos.
LITERATURA CITADA
1. Aburto E, Chávez L. 1997. Histogénesis de los tumores mixtos de glándula mamaria canina. Vet Méx 28: 317-324.
2. Boenisch T. 2001. Anticuerpos, inmunohistoquímica básica, enzimología básica, métodos de coloración, controles, fondo. En: Métodos inmunohistoquímicos de coloración. 7ª ed. USA: DAKO Corp. p 5-15, 26-36.
3. Elias J. 1990. Immunohistopathology: A practical approach to diagnosis. USA: American Society of Clinical Pathologists. 526 p.
4. Ferreira V, Oliveira L, Vassallo J, Marcelo E, Takami C. 2004. Control de qualidade interlaboratorial em imunohistoquímica: citoceratinas e receptor de estrógeno como modelos. J Bras Patol Med Lab 40: 175-183.
5. Jubb K, Kennedy P, Palmer N. 1991. Patología de los animales domésticos. 3a ed. México: Hemisferio Sur. 509 p.
6. Lodish H, Berck A, Zipursky S, Matsudaira P, Baltimore D, Darnell J. 2002. Biología celular y molecular. Argentina: Ed. Panamericano. 1080 p.
7. Moulton J. 1990. Tumors in domestic animals. 3rd ed. USA: University of California Press. 788 p.
8. Owen L. 1991. Identifying and treating cancer in geriatric dogs. Vet Med 86: 55-66.
9. Sedano E, Victorio J, Neira C, Rojas C. 1997. Demostración inmunohistoquímica de células de Langerhans en córnea humana. Anales Fac Medicina, UNMSM 58(3): 1-12.
10. Tabacchi L, Sandoval N, Perales R, Santillán G, Orbegozo G. 2000. Neoplasias de glándula mamaria en caninos. Rev Inv Vet, Perú 11(2): 140-143.
11. Vos J, Misdorp W, Menbeek R, Van Mil F, Rutteman G. 1993. Immunohistochemistry with keratin, vimentin, desmin, smooth muscle actin, monoclonal antibodies in canine mammary gland: Malignant mammary tumours. Vet Q 15: 96-102.
12. Zuccari D, Santana A, Rocha N. 2001. Expresão dos filamentos intermediarios no diagnóstico dos tumores mamários de Cadelas. Arq Bras Med Vet Zootec 54(6): 1-11.