Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.3 Lima Aug. 2013
Frecuencia de enterobacterias en verduras frescas de consumo crudo expendidas en cuatro mercados de Lima, Perú
Frequency of enterobacteria in fresh vegetables of raw consumption sold in four markets in Lima, Peru
Silvia Muñoz J.1, Miguel Vilca L.1,2, Daphne Ramos D.1, Juan Lucas L.1
1 Laboratorio de Salud Pública y Salud Ambiental, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 E-mail: mavilcal@unmsm.edu.pe; mavl06@hotmail.com
RESUMEN
El presente estudio tuvo como objetivo evaluar el grado de contaminación fecal en tres verduras de mayor consumo crudo que se expenden en cuatro mercados mayoristas de Lima, Perú: La Parada, Ramón Castilla, Ceres y Caquetá. Se recolectaron 15 muestras de lechuga (Lactuca sativa), 15 de col (Brassica oleracea) y 15 de espinaca (Spinacea oleracea) por mercado en un año (n=180). Las muestras fueron procesadas por el método del Número más Probable para la detección y recuento de coliformes fecales y E. coli Tipo I (Típico), así como por la prueba de Ausencia/Presencia para Salmonella. El estudio demostró que el 18.9% del total de verduras y el 22.2% de verduras provenientes del mercado de La Parada presentaron niveles de coli fecales superiores a lo establecido por la International Commission on Microbiological Specifications for Foods (ICMSF), siendo la espinaca la más contaminada. Además, el 2.2% de verduras del mercado Caquetá presentó niveles elevados de E. coli Tipo I (Típico) y el 10% de las verduras presentó contaminación por Salmonella spp, especialmente la col.
Palabras clave: Escherichia coli, Salmonella, lechuga, col, espinaca, mercado
ABSTRACT
The purpose of this study was to evaluate the degree of faecal contamination in three vegetables of major raw consumption that are sold in four large wholesale markets in Lima, Peru. A total of 180 samples, 15 lettuce (Lactuca sativa), 15 cabbage (Brassica oleracea) and 15 spinach (Spinacea oleracea) from La Parada, Ramón Castilla, Ceres and Caquetá markets were collected within a year. Samples were processed using the Most Probable Number method for faecal coliform and E. coli Type I (Typical) detection and count, plus the Absence/Presence test for Salmonella. In the study, 18.9% of all vegetables and 22.2% of vegetables from La Parada market had faecal coliform levels higher than those established by the International Commission on Microbiological Specifications for Foods (ICMSF). In addition, 2.2% vegetables from Caquetá market had high levels of E. coli Type I (Typical), where spinach showed the highest contamination. Ten percent of vegetables had Salmonella spp, where cabbage had the highest levels.
Key words: Escherichia coli, Salmonella, lettuce, cabbage, spinach, market
INTRODUCCIÓN
Los agentes patógenos, que incluyen bacterias, toxinas de hongos, protozoos, virus y helmintos, presentes en las verduras frescas o mínimamente procesadas, representan una fuente importante de enfermedades para el ser humano (Steele y Odumeru, 2004; Tananta et al., 2004; Aruscavage et al., 2006). En la década pasada, el incremento del consumo per cápita de vegetales crudos a escala mundial estuvo asociado con el incremento de la frecuencia de infecciones entéricas (Beuchat, 2002; Sivapalasingam et al., 2004; Pivarnik et al., 2005; Castro-Rosas et al., 2012). Otros factores a considerar son el incremento de consumidores inmunosuprimidos, así como los cambios en las prácticas agrícolas y de procesamiento de las verduras (Castro, 1990; Beuchat, 2002).
La literatura señala como principal fuente de contaminación de las verduras al estiércol utilizado como fertilizante y el agua de riego sin tratamiento o contaminado (Islam et al., 2004; Steele y Odumeru, 2004; Steele et al., 2005; Aruscavage et al., 2006; Oliveira et al., 2012). Se ha demostrado la transmisión a través del agua y abono y la persistencia en los productos agrícolas, principalmente en la lechuga, de patógenos como Bacillus cereus, Clostridium perfringens, Listeria monocytogenes (Bardet, 2007), E. coli O157: H7 (Solomon et al., 2003; Oliveira et al., 2012), Salmonella enterica serovar typhimurium (Islam et al., 2004), patotipos de E. coli diarreogénicas (Castro-Rosas et al., 2012), Giardia spp, Isospora spp, Cryptosporidium parvum (Tananta et al., 2004), Aeromonas spp (Ginestrea et al., 2005), Acinetobacter (Houang et al., 2001), Hepatitis A (Rosenblum et al., 1990), entre otros. También se ha señalado como posible fuente de contaminación el uso de pesticidas reconstituidos con agua contaminada durante el cultivo (Guan et al., 2001, 2005). Además, la contaminación por deficiencias sanitarias en el manejo puede ocurrir durante la cosecha y el transporte hasta los puntos de venta, o durante el procesamiento y preparado del producto (Franz et al., 2010).
Los factores intrínsecos y extrínsecos que determinan la capacidad de los patógenos entéricos para unirse y proliferar en la filósfera de las plantas incluyen la motilidad del patógeno, la lixiviación de nutrientes por la planta y la interacción con los organismos epífitos (Aruscavage et al., 2006). Los factores ambientales también influyen en la supervivencia de estos patógenos (Oliveira et al., 2012). Los patógenos sobrevivientes podrían internalizarse en el tejido o incorporarse en biopelículas (Aruscavage et al., 2006). Algunos patógenos se eliminan con los procedimientos habituales de lavado, pero una porción significativa de estos persisten y proliferan (Ginestrea et al., 2005; Aruscavage et al., 2006). Además, los desinfectantes muestran deficiencias para eliminar microorganismos, especialmente por su falta de acceso a ciertas partes de las estructuras vegetales (Beuchat, 2002; López et al., 2003).
En este contexto, el monitoreo periódico se hace indispensable, por lo que el presente trabajo tuvo como objetivo la determinación de coliformes fecales, E. coli Tipo I y Salmonella spp en la superficie de tres verduras de consumo crudo y de mayor demanda en Lima Metropolitana.
MATERIALES Y MÉTODOS
Diseño Experimental y Tamaño de Muestra
El muestreo se realizó entre octubre de 2003 a diciembre de 2004 en cuatro mercados de carácter mayorista de Lima Metropolitana: La Parada, Ramón Castilla, Ceres y Caquetá. Se muestrearon tres tipos de verduras de consumo crudo de alta demanda en el medio: col (Brassica oleracea), lechuga (Lactuca sativa) y espinaca (Spinacea oleracea); estas dos últimas comúnmente implicadas en brotes de E. coli y Salmonella spp (Sivapalasingam et al., 2004).
El tamaño de muestra (n) se determinó utilizando la fórmula para poblaciones infinitas (Daniel, 1996), con un nivel de confianza del 95% (Z=1.96) y un error máximo permisible (E) de 0.13. Las proporciones usadas como referencia (p) fueron las señaladas por Castro (1990), que indica las siguientes frecuencias en verduras frescas en expendio en Lima: 13.8% para Salmonella spp, 58% de coliformes fecales (>100/g de producto agrícola) y 54% de E. coli Tipo I (>10/g de verdura). El tamaño de muestra mínimo resultó de 27 para la identificación de Salmonella spp, 56 para cuantificación de coliformes fecales y 57 para E. coli.
La unidad de muestra fue una verdura representativa de un puesto de venta en el mercado, tomándose tres muestras en cada puesto (una de cada verdura) y 45 verduras por mercado. Las muestras se colocaron por separado en bolsas plásticas y fueron llevadas, en condiciones de refrigeración, al laboratorio de Salud Pública y Salud Ambiental de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima.
Análisis Microbiológico y Estadístico
Los protocolos de preparación y dilución de las muestras, los materiales utilizados, los protocolos de los procedimientos seguidos en el análisis bacteriológico, así como los criterios en la determinación de negativos, sospechosos o positivos al cultivo microbiológico y pruebas bioquímicas y serológicas fueron los descritos por la International Commission on Microbiological Specifications for Foods (ICMSF, 1999).
Se realizó la cuantificación de coliformes fecales mediante la técnica del Número más Probable (NMP), utilizando el caldo lactosa bilis verde brillante 2%. En este ensayo, los tubos gas positivos, que además producen indol en agua de peptona, son positivos a coliformes fecales. En la diferenciación del grupo coliforme se emplearon las pruebas de indol, rojo de metilo, Voges-Proskauer y citrato sódico, a fin de identificar Escherichia coli Tipo I (Típico).
En el aislamiento e identificación de Salmonella spp se realizó la prueba de Ausencia/ Presencia para Salmonella, donde la muestra fue sometida a preenriquecimiento en agua peptonada 0.1%, seguido de un enriquecimiento en caldo tetrationato y caldo selenito cistina. Luego se sembraron en agar verde brillante, agar Salmonella-Shigella y agar sulfito de bismuto. Las colonias positivas típicas que crecieron en por lo menos uno de los medios de agar señalados, se consideraron como sospechosas y fueron sembradas en tubos de agar triple azúcar hierro y lisina hierro para su identificación bioquímica. Aquellas cepas que presentaron un perfil bioquímico compatible con Salmonella spp fueron confirmadas mediante la prueba de aglutinación en placa con Antisuero Polivalente Somático O (DifcoTM).
Los resultados se presentan como frecuencias, donde la prevalencia es igual al número de muestras positivas entre el total de muestras analizadas multiplicado por cien (Thursfield, 1990). Asimismo, se estableció si lo hallado es apto para consumo humano, tiene aceptabilidad provisional o no es apto. Para ello se utilizaron los estándares de la norma sanitaria vigente del Ministerio de Salud del Perú (MINSA, 2007) y las recomendaciones de la International Commission on Microbiological Specifications for Foods (ICMSF). El límite de aceptabilidad provisional se utiliza para declarar apto un lote cuando en un muestreo de cinco productos no existen más de dos que superen este límite.
El MINSA establece los parámetros para E. coli de aceptabilidad de hasta 100 NMP, mientras que ICSMF recomienda 10 NMP. Ambos establecen una aceptabilidad provisional de hasta 1000 NMP, rechazando el lote de existir una muestra que sobrepase este límite o de verificar la presencia de Salmonella spp. También se comparó los hallazgos con lo recomendado por el ICSMF para colifecales, donde se indica como apto aquel lote que presente hasta 100 NMP de colifecales, con un límite de aptitud provisional de hasta 10000 NMP, rechazando todo el lote de existir una muestra que supere este límite.
RESULTADOS
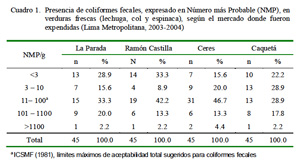
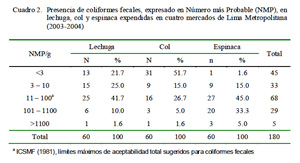
El estudio demostró que el 18.9% del total de verduras presentaron niveles de coli fecales superiores a lo establecido como apto por la International Commission on Microbiological Specifications for Foods (ICMSF, 1981). Además, el mercado de La Parada (Cuadro 1) y la espinaca (Cuadro 2) presentaron los mayores porcentajes de contaminación bajo este mismo criterio.
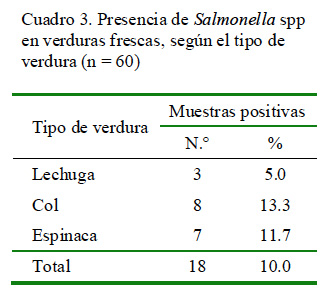
Salmonella spp se detectó en el 10% de las verduras muestreadas, especialmente en col y espinacas (Cuadro 3). Además, en el mercado de Caquetá se encontró una muestra de espinaca con alto contenido de E. coli.
DISCUSIÓN
El mercado de La Parada presentó el mayor porcentaje de verduras contaminadas con coliformes fecales (Cuadro 1). Por lo observado durante el muestreo, la falta de higiene en los lugares de expendio, las deficientes condiciones de exhibición de los productos agrícolas, el piso de tierra en los mercados, y la inadecuada distribución de los puestos de venta (cercanía a lugares de expendio de aves y carnes), propiciarían la mayor contaminación. Por otro lado, el uso de agua de riego sin tratamiento, considerado como la principal fuente de contaminación para las verduras de consumo crudo por diversos investigadores, no fue tema del presente estudio ni pudo ser comprobado con la metodología de trabajo empleada; sin embargo, estudios previos en Lima correlacionan la presencia de patógenos tanto en agua de riego como en las verduras (Castro, 1990).
La espinaca contaminada con E. coli en el mercado de Caquetá es digna de mención. Entre los factores que favorecen la contaminación de esta verdura se puede mencionar su alto porcentaje de humedad, su agrupamiento en manojos y la superficie lisa de sus hojas entre otros. Sánchez (1988) reportó niveles de contaminación ≤1000 con E. coli en el 55% de verduras que crecen a flor de tierra, y Castro (1990) encontró niveles mayores a 10 NMP/g en el 27.3% de estos vegetales.
El 10% de verduras con Salmonella spp (Cuadro 3) está relacionado con los hallazgos de Castro (1990), lo cual es un indicio de que las prácticas agrícolas continúan siendo deficientes. En ese estudio se encontraron recuentos de Salmonella spp de 20/100 ml en el agua residual utilizada para irrigación.
La col ofrece condiciones necesarias (áreas húmedas y protegidas de la desecación y de los rayos directos del sol), que permitirían a las salmonellas sobrevivir por más tiempo. Esto explicaría la mayor frecuencia de Salmonella en esta verdura en el presente estudio; sin embargo, la col presentó la menor contaminación con coliformes fecales, hallazgo que fue similar al trabajo de Monge et al. (1996).
CONCLUSIONES
-
El mercado de La Parada presentó la mayor frecuencia de verduras contaminadas con coliformes fecales.
-
El mercado de Caquetá presentó el 2.2% de verduras contaminadas con E. coli Tipo I (Típico) en niveles que excedieron el límite recomendado.
-
La col y la espinaca fueron las verduras que más excedieron los límites máximos recomendados para coliformes fecales y E. coli, y para Salmonella spp, respectivamente.
-
Se detectó presencia de Salmonella spp en el 10% de las verduras.
LITERATURA CITADA
1. Aruscavage D, Lee K, Miller S, LeJeune JT. 2006. Interactions affecting the proliferation and control of human pathogens on edible plants. J Food Sci 71: R89-R99.
2. Bardet A. 2007. Organic products and irrigation water. Transfer of human pathogens to vegetables. InfosCtifl 233: 49-52.
3. Beuchat LR. 2002. Ecological factors influencing survival and growth of human pathogens on raw fruits and vegetables. Microbes Infect 4: 413-423.
4. Castro ML. 1990. Evaluación de riesgos para la salud por el uso de aguas residuales en agricultura: Aspectos microbiológicos. Vol I. Centro Panamericano de Ingeniería Sanitaria y Ciencias del Ambiente (CEPIS). Lima. [Internet], [10 junio 2011]. Disponible en: http://www.bvsde.paho.org/eswww/fulltext/repind53/rem/rem.html
5. Castro-Rosas J, Cerna-Cortés J, Méndez-Reyes E, Lopez-Hernandez D, Gómez-Aldapa C, Estrada-Garcia T. 2012. Presence of faecal coliforms, Escherichia coli and diarrheagenic E. coli pathotypes in ready-to-eat salads, from an area where crops are irrigated with untreated sewage water. Int J Food Microbiol 156: 176-180.
6. Daniel W. 1996. Bioestadística: Base para el análisis de las ciencias de la salud. 3ª ed. México: Limusa. 878 p.
7. Franz E, Tromp SO, Rijgersberg, Van Der Fels-Klerx HJ. 2010. Quantitative microbial risk assessment for Escherichia coli O157:H7, Salmonella, and Listeria monocytogenes in leafy green vegetables consumed at salad bars. J Food Protec 73: 274-285.
8. Ginestrea M, Rincón G, Romero S, Harris B, Castellano M, Colina G. 2005. Especies de Aeromonas en vegetales frescos que se expenden en un mercado popular de Maracaibo. Rev Soc Ven Microbiol 25: 229-235.
9. Guan TY, Blank G, Holley RA. 2005. Survival of pathogenic bacteria in pesticide solutions and on treated tomato plants. J Food Protect 68: 292-304.
10. Guan TY, Blank G, Ismond A, Van Acker R. 2001. Fate of foodborne bacterial pathogens in pesticide products. J Sci Food Agric 81: 503-512.
11. Houang ETS, Chu YW, Leung CM, Chu KY, Berlau J, Ng K, Cheng AFB. 2001. Epidemiology and infection control implications of Acinetobacter spp in Hong Kong. J Clin Microbiol 39: 228- 234.
12. [ICMSF] International Commission on Microbiological Specifications for Foods. 1999. Microorganismos de los alimentos I: Su significado y métodos de enumeración. 2a ed. Zaragoza: Acribia. 439 p.
13. [ICMSF] International Commission on Microbiological Specifications for Foods. 1981. Microorganismos de los alimentos II: Métodos de muestreo para análisis microbiológicos. Zaragoza: Acribia. 215 p.
14. Islam M, Morgan J, Doyle MP, Phatak SC, Millner P, Jiang X. 2004. Persistence of Salmonella enterica serovar typhimurium on lettuce and parsley and in soils on which they were grown in fields treated with contaminated manure composts or irrigation water. Foodborne Pathog Dis 1: 27-35.
15. López LV, Romero J, Duarte F. 2003. Calidad microbiológica y efecto del lavado y desinfección en vegetales pretrozados expendidos en Chile. Arch Latinoam Nutr 53: 383-388.
16. [MINSA] Ministerio de Salud. 2007. Norma sanitaria que establece los criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano. [Internet], [10 junio 2011]. Disponible en: ftp://ftp2.minsa.gob.pe/normaslegales/2007/RM709-2007.pdf
17. Monge R, Chinchilla M, Reyes I. 1996. Presencia de parásitos y bacterias intestinales en hortalizas que se consumen crudas en Costa Rica. Rev Biol Trop 44: 369-375.
18. Oliveira M, Viñas I, Usall J, Anguera M, Abadias M. 2012. Presence and survival of Escherichia coli O157:H7 on lettuce leaves and in soil treated with contaminated compost and irrigation water. Int J Food Microbiol 156: 133-140.
19. Pivarnik LF, Donath H, Patnoad MS, Roheim C. 2005. New England consumers willingness to pay for fresh fruits and vegetables grown on CAPcertified farms. Food Protect Trends 25: 256-266.
20. Rosemblum LS, Mirkin IR, Allen DT, Safford S, Hadler SC. 1990. A multifocal outbreak of hepatitis A traced to commercially distributed lettuce. Am J Public Health 80:1075-1079.
21. Sánchez M. 1988. Numeración de coliformes fecales, E. coli y clostridium sulfito reductores en verduras irrigadas con aguas residuales. Tesis de Químico Farmacéutico. Lima: Facultad de Farmacia y Bioquímica, Univ. Nacional Mayor de San Marcos. 77 p.
22. Sivapalasingam S, Friedman CR, Cohen L, Tauxe RV. 2004. Fresh produce: a growing cause of outbreaks of foodborne illness in the United States, 1973 through 1997. J Food Protect 67: 2342-2353.
23. Solomon EB, Pang H-J, Matthews KR. 2003. Persistence of Escherichia coli O157:H7 on lettuce plants following spray irrigation with contaminated water: J Food Protect 66: 2198-2202.
24. Steele M, Mahdi A, Odumeru J. 2005. Microbial assessment of irrigation water used for production of fruit and vegetables in Ontario, Canada. J Food Protect 68: 1388-1392.
25. Steele M, Odumeru J. 2004. Irrigation water as source of foodborne pathogens on fruit and vegetables. J Food Prot 67: 2839-2849.
26. Tananta I, Chávez A, Casas E. 2004. Presencia de enteroparásitos en lechuga (Lactuca sativa) en establecimientos de consumo público de alimentos en el cercado de Lima. Rev Inv Vet Perú 15: 157-162.
27. Thrusfield M. 1990. Epidemiología veterinaria. Zaragoza: Acribia. 339 p.
Recibido: 21 de mayo de 2012
Aceptado para publicación: 17 de febrero de 2013