Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.3 Lima Aug. 2013
Identificación y frecuencia de parásitos gastrointestinales en félidos silvestres en cautiverio en el Perú
Identification and frequency of gastrointestinal parasites in captive wild cats in Peru
Carmen Aranda R.1, Enrique Serrano-Martínez1,2, Manuel Tantaleán V.1, Marco Quispe H.1, Gina Casas V.1
1 Grupo SALUVET-UPCH, Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia, Lima
2 E-mail: enrique.serrano@upch.pe
RESUMEN
El objetivo del presente trabajo fue identificar los parásitos gastrointestinales de felinos silvestres criados en cuatro parques zoológicos en el Perú, mediante la aplicación de cuatro técnicas parasitológicas convencionales (método directo, test de sedimentación en tubo, método de Sheather y tinción Ziehl-Nielsen). Se trabajó con 10 ejemplares de Panthera onca (4 machos y 6 hembras), 8 de Puma concolor (4 machos y 4 hembras), 6 de Leopardus pardalis (machos), 3 de Leopardus wiedii (1 macho y 2 hembras) y 2 de Leopardus tigrinus (machos). El 62.1% (18/29) de las muestras fueron positivas a alguna forma de parásito gastrointestinal. Panthera onca y Puma concolor fueron las especies con mayor frecuencia de parásitos (9/10 y 5/5, respectivamente). Los parásitos más frecuentes fueron el céstodo Spirometra mansonoides (38.9%), Toxocara cati (33.3%) y Strongyloides spp (33.3%). No se encontró asociación estadística entre las variables de edad y sexo.
Palabras clave: felinos silvestres, parásitos gastrointestinales, zoológico, sanidad animal
ABSTRACT
The aim of this study was to identify gastrointestinal parasites affecting wild cats reared in captivity in four Peruvian zoos through the application of four conventional parasitological techniques (direct method, sedimentation test tube, Sheather method, Ziehl-Nielsen stain). Ten Panthera onca (4 males and 6 females), 8 Puma concolor (4 males and 4 females), 6 Leopardus pardalis (males), 3 Leopardus wiedii (1 male and 2 female) and 2 Leopardus tigrinus (males) were used. In total, 62.1% (18/29) of the individuals were positive to at least one parasite species. Panthera onca and Puma concolor were the most affected cat species (9/10 and 5/5 respectively). Among parasites, the most frequent were the cestode Spirometra mansonoides (38.9%), Toxocara cati (33.3%) and Strongyloides spp (33.3%). No significant association was found between age and sex.
Key words: wild cats, gastrointestinal parasites, zoo, animal health
INTRODUCCIÓN
Entre los félidos silvestres criados en cautiverio en el Perú se encuentran el jaguar u otorongo (Panthera onca), puma (Puma concolor), margay (Leopardus wiedii), tigrillo u ocelote (Leopardus pardalis), yaguarundi (Puma yagouaroundi) y oncilla (Leopardus tigrinus) (Pacheco et al., 2009). Estos animales pertenecen al Orden Carnivora, familia Felidae (Oliveira et al., 2001).
La distribución geográfica de los félidos silvestres varía según la especie (Oliveria et al., 2001). El margay, yaguarundi, otorongo, tigrillo y la oncilla presentan una distribución tropical, encontrando a los tres primeros desde el sur de México hasta el norte de Argentina, al tigrillo desde Arizona hasta el norte de Argentina, y la oncilla desde Costa Rica hasta el norte de Argentina (Murray y Gardner, 1997; Oliveira, 1998a,b; González-Maya y Schipper, 2008). El puma presenta una distribución más generalista, encontrándosele desde el oriente de Canadá hasta el estrecho de Magallanes (Oliveira et al., 2001; Benítez, 2005).
La situación de estas especies en vida libre se ve afectada por la disminución del hábitat por causas antrópicas, falta de presas, tráfico de pieles y caza furtiva (Weber y Rabinowitz, 1996; Benitez, 2005); y es por ello que toda la Familia Felidae se encuentra recogida en la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES), estando los géneros Panthera, Leopardus y Puma en el Apéndice I y Puma yagouaroundi en el Apéndice II (CITES, 2009). Del mismo modo, en el Decreto Supremo N° 34-2004- AG, el jaguar y el puma se encuentran catalogados como especies «casi amenazadas», lo que faculta a tener a estos animales en cautiverio para promover su conservación a nivel nacional.
El cautiverio presenta, no obstante, problemas para las especies silvestres, especialmente debido al tipo de manejo y cuidados que reciben (Oliveira et al., 2001). Entre ellos se encuentran problemas dentales y de piel, así como enfermedades nutricionales, virales y parasitarias (Oliveira et al., 2001; Junior et al., 2007). Los parásitos internos pueden llevar a causar severos daños en el huésped, dependiendo de la especie, localización y condiciones de vida del animal (Arrojo, 2002).
Se reporta la presencia en félidos silvestres de especies de los géneros Spirometra, Strongyloides, Ancylostoma, Toxocara, Toxascaris y Giardia entre otros (Patton et al., 1986; Xavier et al., 2000; Figueiroa et al., 2001; Tantaleán y Michaud, 2005; Belmonte et al., 2008; Vieira et al., 2008).
El diagnóstico coprológico de las infecciones parasitarias intestinales se basa en el análisis de muestras fecales (Foreyt, 2001). El montaje húmedo directo es una técnica convencional rápida de realizar, pero a menudo la cantidad de formas parasitarias en la muestra es muy escasa, por lo que se requiere realizar técnicas de concentración como el test de sedimentación espontánea en tubo (TSET), la técnica de Ritchie, el método de flotación con sulfato de zinc o el de Sheather, las cuales son más específicas para detectar protozoos así como huevos y larvas de helmintos (Pajuelo-Camacho et al., 2006).
El objetivo del presente estudio fue ampliar el conocimiento sobre los géneros y especies de parásitos presentes en félidos silvestres criados en cautiverio en el Perú.
MATERIALES Y MÉTODOS
Durante el mes de mayo de 2009 se recolectaron muestras de heces de 29 félidos silvestres criados en cuatro zoológicos: Zoológico Parque Natural de Pucallpa en la región Ucayali (n=19), Parque Zonal Huáscar en el distrito de Villa El Salvador, Lima (n=2), Parque Zonal Sinchi Roca (n=4) y Zoológico del Buen Pastor (n=4), estos dos últimos en el distrito de Comas, Lima. Las muestras de heces fueron procesadas en el Laboratorio de Parasitología de la Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia (UPCH), Lima, Perú.
Se trabajó con cinco especies de félidos silvestres: 10 ejemplares Panthera onca (4 machos y 6 hembras), 8 Puma concolor (4 machos y 4 hembras), 6 Leopardus pardalis (machos), 3 Leopardus wiedii (1 macho y 2 hembras) y 2 Leopardus tigrinus (machos). Los animales se agruparon para el análisis de acuerdo a la edad (menores de 5 años [n=16], entre 5 y 10 años [n=6], mayores de 10 años [n=7]) y sexo (machos [n=17], hembras [n=12]).
Como criterio de inclusión se consideró que los félidos no debían haber sido tratados con antiparasitarios un año antes del estudio y las muestras de heces debían ser frescas y bien preservadas. Por este motivo se descartó del estudio a una oncilla y a un yaguarundi.
Se realizó una inspección general a los animales para observar su estado de salud, condición corporal y consumo de alimento; asimismo, se revisaron las historias clínicas en busca de antecedentes de parasitosis u otro evento notable. De los 29 animales, cuatro nacieron en cautiverio, mientras que los restantes procedían del medio natural.
Las muestras de heces (2-3 muestras por animal en un solo día) se recolectaron en las primeras horas de la mañana de sus jaulas o recintos. En el caso de ejemplares que se encontraban en grupo, las muestras se colectaron al momento de defecar. Las muestras de Pucallpa se dividieron en dos grupos, siendo un grupo mantenido en refrigeración (2-5 °C) y el otro preservado en formol al 10%, en tanto que las muestras de Lima se trabajaron en estado fresco.
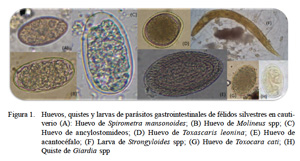
Con la finalidad de aumentar la probabilidad de detección de parásitos, las muestras fueron procesadas mediante cuatro técnicas coproparasitológicas para la búsqueda de huevos de helmintos, coccidias y otros protozoos: método directo, método de Sheather (Flotación), método de sedimentación en tubo y tinción Ziehl-Neelsen. La identificación de los géneros y especies de parásitos se realizó por la morfología (forma, cubierta, color y contenido) de los huevos y de las larvas, según los estudios realizados por Arrojo (2002), Tantaleán y Michaud (2005), Tantaleán et al. (2005), Belmonte et al. (2008) y Vieira et al. (2008). En el análisis coproparasitológico, las muestras procedentes de un mismo animal fueron procesadas individualmente, siendo considerado como positivo si alguna de las muestras resultaba positiva. Del mismo modo se consideró como positivo si alguna de las muestras resultaba positiva a una de las cuatro técnicas empleadas. Los resultados de frecuencia fueron expresados en forma porcentual (Thrusfield, 1990); asimismo, la asociación entre variables fue analizada mediante la prueba de Fisher exacto.
RESULTADOS Y DISCUSIÓN
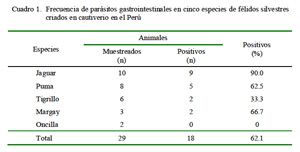
La frecuencia de parasitosis gastrointestinal fue de 62.1% (18/29, Cuadro 1). Estudios sobre niveles de estas parasitosis en animales en vida libre revelan frecuencias que van desde 86.7% (Patton et al., 1986) hasta 100% (Rickard y Foreyt, 1992; Patton y Rabinowitz, 1994; Pence et al., 2003). Asimismo, estudios en félidos silvestres en cautiverio en zoológicos de Brasil reportan frecuencias de 61% (Müller et al., 2005) y de 67% en félidos de un centro de rescate en Bolivia (Beltrán et al., 2009).
Los parásitos, en general, pueden llegar a causar severos daños en el huésped dependiendo de la especie, de la localización y de las condiciones de vida del hospedero. Todos los animales albergan parásitos correspondientes a diversos taxones con los cuales mantienen un cierto equilibrio, pero cuando se altera esta armonía se producen enfermedades que incluso pueden llevar a la muerte del hospedero (Arrojo, 2002).
El nivel de parasitosis encontrado en el presente estudio es similar a otros trabajos con animales en cautiverio (Müller et al., 2005; Beltrán et al., 2009). Los niveles de parasitismo gastrointestinal en animales en vida libre tienden a ser mayores (Patton y Rabinowitz, 1994; Benítez, 2005; Fiorello et al., 2006) toda vez que las posibilidades de infección en cautiverio se ven limitadas por el sistema de crianza y alimentación (Figueiroa et al., 2001; Tantaléan y Michaud, 2005).
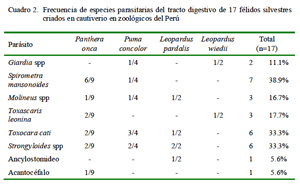
En el presente estudio se han identificado ocho especies parásitas (Cuadro 2, Fig. 1). Alguna de ellas, como Spirometra mansonoides, con ciclo vital indirecto, deben haber ingresado al organismo del animal antes de su etapa de cautiverio; asimismo, especies como Toxocara cati y Giardia spp podrían haberse adquirido en cautiverio por tener ciclo de vida directo. Martínez et al. (2005) señalan que el cautiverio favorece la presencia de algunas especies de parásitos debido a ambientes permanentemente contaminados; asimismo, el estrés del cautiverio puede disminuir la capacidad inmunológica y propiciar el surgimiento de la parasitosis.
Las especies de parásitos identificadas en el presente estudio coinciden con especies identificadas en otros estudios, tanto a nivel de cautiverio como en vida libre (Patton et al., 1986; Xavier et al., 2000; Pence et al., 2003; Tantaléan y Michaud, 2005; Belmonte et al., 2008); sin embargo, el número de especies parásitas fue menor, posiblemente debido a las características propias de cada estudio, incluyendo la ubicación geográfica, ausencia de hospederos intermediarios y la exposición previa de los animales. Suzán et al. (2000) mencionan que el avance del urbanismo, con reducción del hábitat y una mayor interacción entre especies silvestres y domésticas, puede favorecer un mayor parasitismo y diversidad de los mismos en animales en estado silvestre.
Spirometra mansonoides fue el parásito que se presentó con mayor frecuencia, siendo esta especie conocida por la elevada producción de huevos (Müller-Graf et al., 1999), lo que facilita el hallazgo de los huevos. Por otro lado, Tantaleán y Michaud (2005) señalan que el tipo de ciclo biológico de este parásito es un factor importante para su presencia, dado que es necesario la ingestión de un anfibio o reptil infectado con el plerocercoide; por tanto, la presencia de este parásito en félidos en cautiverio demuestra más una infección previa que una adquirida en cautiverio.
La frecuencia de Giardia spp fue relativamente baja, pues solo se encontró en un ejemplar de Leopardus wiedii y en un Puma concolor. Se conoce la presencia de este parásito en un margay de vida libre (Belmonte et al., 2008) y en margay, oncilla, puma y jaguar en dos zoológicos (Müller et al., 2005) de Brasil en ambos casos. Por otro lado, Patton y Rabinowitz (1994) encuentran un solo ejemplar positivo entre 92 muestras fecales analizadas, en tanto que Martínez et al. (2002) reportó el 3.3% de ejemplares positivos. El bajo número de animales infectados se debería al tipo de alojamiento, con piso de cemento, aseo frecuente e ingesta de agua potable. Asimismo, este manejo podría haber evitado la presencia de otros protozoos reportados en estos animales como Isospora spp, Sarcocystis spp. Hammondia spp, Toxoplasma gondii y Cytoisospora spp (Patton et al., 1986; Benítez, 2005; Fiorello et al., 2006).
Toxocara cati ha sido reportada en félidos silvestres (Patton et al., 1986). El hallazgo en el presente estudio no difiere de otros autores (Rickard y Foreyt, 1992; Benitez, 2005; Müller et al., 2005). El parásito se adquiere, probablemente, por la ingestión de hospederos paraténicos como roedores, los cuales forman parte de la dieta de estos animales (Murray y Gadner, 1997; Oliveira 1998a,b; Oliveira et al., 2001).
Toxascaris leonina se ha registrado en Leopardus pardalis en el sureste de Texas (Pence et al., 2003) y en jaguares (Patton et al., 1986); asimismo, se le reporta en carnívoros silvestres de Brasil (Vieira et al., 2008) y en pumas de Florida (Dunbar, 1994). La presencia de este parásito en animales en cautiverio se debe posiblemente a la ingestión de algún hospedero paraténico con la larva infectiva enquistada en los tejidos o la ingestión del huevo infectante en el medio ambiente.
La presencia de Strongyloides fue mayor que en otros estudios (Figueiroa et al., 2001; Benítez, 2005; Beltrán et al., 2009), sobre todo en animales de Pucallpa, probablemente por el ambiente húmedo tropical y tierra fangosa, que son condiciones propias de la zona, que favorecería el desarrollo de la larva filariforme infectante (Bowman et al., 2003).
La presencia de Molineus spp en félidos silvestres ha sido descrita en leopardos y tigres de Tailandia (Patton y Rabinowitz, 1994), pumas (Dunbar, 1994; Foster et al., 2006) y en jaguarundi (Oliveira, 1998a). En el Perú ha sido reportada por Arrojo (2002) en mamíferos en cautiverio. Su presencia puede deberse a la ingestión de larvas infectantes presentes en el medio ambiente (Bowman et al., 2003).
La presencia de huevos de Ancilostómidos fue baja en relación a otros estudios (Patton et al., 1986; Dunbar, 1994; Pence et al., 2003). Esto puede explicarse por la ausencia de los mecanismos de transmisión por contaminación oral o por penetración activa de la piel por larvas infectantes (Payne y Carter, 2005).
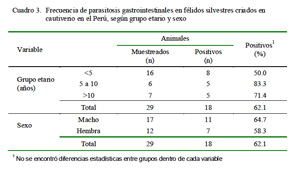
El grupo etario de 5-10 años (83.3%) fue ligeramente más afectado, en tanto que no hubo diferencias entres sexos (Cuadro 3).
Dentro de los parásitos identificados en el presente estudio, se encontraron tres especies de importancia en salud pública: Spirometra mansonoides, cuya larva (plerocerocide) es el agente causal de la esparganosis humana, adquirida por la ingestión tanto del procercoide o plerocercoide en el primer o segundo hospedero intermediario, respectivamente o por el uso de emplastos o cataplasmas de carne cruda infectada en heridas o en los ojos (Tantelán y Michaud, 2005), común en ciertas regiones del país; Toxocara spp por provocar el síndrome de «Larva Migrante Visceral» y «Ocular» por ingestión de huevos infectivos, produciendo lesiones granulomatosas en diversos órganos como hígado pulmones cerebro y el ojo; y larvas de algunas especies de Strongyloides spp, parásito que puede penetrar la piel y generar autoinfección interna (Egido et al., 2001).
CONCLUSIONES
-
El 62.1% de félidos silvestres criados en cautiverio en el Perú fueron positivos a parasitismo gastrointestinal.
-
Se reporta la presencia de ocho especies de parásitos pertenecientes a los Phyllum Protozoa (Giardia spp), Platyhelmintes (Spirometra mansonoides), Nematoda (Ancilostomideo, Molineus spp, Strongyloides spp, Toxascaris leonina y Toxocara cati) y Acanthocephala.
-
La edad y el sexo no tuvieron influencia sobre la frecuencia de la parasitosis.
Agradecimientos
Los autores agradecen al personal profesional y técnico del Zoológico Parque Natural de Pucallpa, Parque Zonal Huáscar, Parque Zonal Sinchi Roca y Zoológico del Buen Pastor por su apoyo durante el desarrollo del presente estudio. Asimismo, al MVZ Sergio Salgado Nuñez del Prado por el apoyo técnico en el procesamiento de las muestras.
LITERATURA CITADA
1. Arrojo L. 2002. Parásitos de animales silvestres en cautiverio en Lima, Perú. Rev Peru Biol 9: 118-120.
2. Belmonte C, Soares JF, Schafer da Silva A, Kipper da Silva M, Salomao EL, Gonzales S. 2008. Ocorrência de Giardia sp. e Cryptosporidium sp. em Leopardus weidii de vida libre. Cienc Rural 38: 546-547.
3. Beltrán LF, Beldoménico BF, Gonzáles JL. 2009. Estudio coproparasitológico de mamíferos silvestres en cautiverio con destino a relocación en Santa Cruz, Bolivia. Vet Zootec 3: 51-60.
4. Benítez E. 2005. Presencia de parásitos intestinales en excrementos de Puma concolor en la sierra Nanchititla. Tesis de Biólogo. Toluca: Universidad Autónoma del Estado de México. 39 p.
5. Bowman DD, Barr SC, Hendrix CM, Lindsay DS. 2003. Gastro-intestinal parasites of cats. In: Bowman DD (eds). Companion and exotical animal parasitology. Ithaca, NY: International Veterinary Information Service. [Internet]. Disponible en: www.ivis.org
6. [CITES] Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre. 2009. Apéndices I, II y III. Ginebra: CITES. 41 p.
7. Dunbar MR. 1994. Florida panther biomedical investigations. In: Florida Panther Conference. EEUU. p 343-394.
8. Figueiroa M, Bianque J, Dowell M, Alves R, Evencio A. 2001. Perfil coproparasitológico de mamíferos silvestres en cautiverio en el estado de Pernambuco, Brasil. Parasitol Dia 25: 3-4.
9. Fiorello CV, Robbins RG, Maffei L, Wade SE. 2006. Parasites of freeranging small canids and felids in the Bolivian chaco. J Zoo Wildlife Med 37: 130-134.
10. Foreyt WJ. 2001. Veterinary parasitology reference manual. 5ª ed. Iowa, USA: Iowa State University Press. 236 p.
11. Foster GW, Cunningham MW, Kinsella JM, McLaughlin G, Forrester DJ. 2006. Gastrointestinal helminthes in free-ranging Florida panthers (Puma concolor coryi) and the efficacy of the current anthelmintic treatment protocol. J Wildlife Dis 42: 402-406.
12. González-Maya JF, Schipper J. 2008. A high-elevation report of Oncilla in Mesoamerica. Cat News 49: 33.
13. Junior JLR, Gioso MA, Domingues- Falqueiro LA. 2007. Estudo comparativo sobre prevalência de doença periodontal em Panthera onca mantida em cativeiro e em indivíduos de natureza. Pesq Vet Bras 27: 209-214.
14. Martínez FA, Gauna Añasco L, Rearte R. 2002. Infección por coccidios en carnívoros silvestres de cautiverio de Argentina. Parasitol Latinoam 57: 146-148.
15. Martínez FA, Binda JL, Maza Y. 2005. Determinación de platelmintos por coprología en carnívoros silvestres. En: Comunicaciones científicas y tecnológicas. Argentina: Universidad Nacional del Nordeste. V-033.
16. Müller CGK, Greinert JA, Silva Filho HH. 2005. Freqüência de parasitas intestinais em felinos mantidos em zoológicos. Arq Bras Med Vet Zootec 57: 559-561.
17. Müller-Graf CDM, Woolhouse MEJ, Packer C. 1999. Epidemiology of a intestinal parasite (Spirometra spp) in two populations of African lions (Panthera leo). Parasitol 118: 407-415.
18. Murray JL, Gardner GL. 1997. Leopardus pardalis. Mammalian Species 548: 1-10.
19. Oliveira T. 1998a. Herpailurus yagouaroundi. Mammalian Species 578: 1- 6.
20. Oliveira T. 1998b. Leopardus wiedii. Mammalian Species 579: 1- 6.
21. Oliveira T, Moreira N, Eizirik E, Gonçalves R, Crawshaw P, Morato RG. 2001. Order Carnivora, Family Felidae (cats). In: Fowler ME, Cubas Z (eds). Biology, medicine, and surgery of South American wild animals. EEUU: Wiley-Blackwell. p 291-300.
22. Pacheco V, Cadenillas R, Salas E, Tello C, Zeballos H. 2009. Diversidad y endemismo de los mamíferos en el Perú. Rev Peru Biol 16: 5-32.
23. Pajuelo-Camacho G, Luján-Roca D, Paredes-Pérez B, Tello-Casanova R. 2006. Aplicación de la técnica de sedimentación espontánea en tubo en el diagnóstico de parásitos intestinales. Rev Biomed 17: 96-101.
24. Patton S, Rabinowitz A, Randolph S, Strawbridge S. 1986. A coprological survey of parasites of wild neotropical felidae. J Parasit 72: 517-520.
25. Patton S, Rabinowitz A. 1994. Parasites of wild felidae in Thailand: a coprological survey. J Wildlife Dis 30: 472-475.
26. Payne PA, Carter GR. 2005. Internal parasitic diseases of dogs and cats. In: Carter GR, Payne PA (eds). A concise guide of to infectious and parasitic diseases of dogs and cats. Ithaca NY: International Veterinary Information Service. [Internet]. Disponible en: www.ivis.org
27. Pence DB, Tewes ME, Laack LL. 2003. Helminths of the ocelots of southern Texas. J Wildlife Dis 39: 683- 689.
28. Rickard LG, Foreyt WJ. 1992. Gastrointestinal parasites of cougars (Felis concolor) in Washington and the first report of Ollulanus tricuspis in a sylvatic felid from North America. J Wildlife Dis 28: 130-133.
29. Suzán G, Galindo F, Ceballos C. 2000. La importancia de estudio de enfermedades en fauna silvestre. Vet Méx 31: 223-228.
30. Tantaleán M, Michaud C. 2005. Huéspedes definitivos de Spirometra mansonoides (Cestoda, Diphyllobothriidae) en Perú. Rev Peru Biol 12: 153-157.
31. Tantaleán M, Sánchez L, Gómez L, Huiza, A. 2005. Acantocéfalos del Perú. Rev Peru Biol 12: 83-92.
32. Thrusfield M. 1990. Epidemiología veterinaria. España: Ed. Acribia. p 228-230.
33. Vieira FM, Luque J, Muniz-Pereira L. 2008. Checklist of helminths parasites in wild carnivore mammals from Brazil. Zootaxa 1721: 1-23.
34. Watson TG, Nettles VF, Davidson WR. 1981. Endoparasites and selected infectious agents in bobcats (Felis rufus) from West Virgina and Georgia. J Wildlife Dis 17: 547-554.
35. Weber W, Rabinowitz A. 1996. A global perspective in large carnivore conservation. Conserv Biol 10: 1046-1054.
36. Xavier F, Joseph GK, Michael B, Bijula K. 2000. A coprological survey of parasites of seven mammal groups at Silent Valley National Park, Kerala. Zoos Print 15: 279-280.
Recibido: 30 de marzo de 2012
Aceptado para publicación: 25 de febrero de 2013