Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.3 Lima ago. 2013
Seroprevalencia de toxoplasma gondii en felis catus en la Habana
Seroprevalence of toxoplasma gondii in felis catus in Havana
Raiden Grandía G.1,7, Ángel Entrena G.1, Jeddú Cruz H.2, Dora Ginorio G.3, Ingrid Domenech C.3, Abdulahi Alfonso M.4, Loreley Perdomo R.5, Lourdes Chi R.6, Miriam Burón R.1
1 Centro Nacional para la Producción de Animales de Laboratorio, CENPALAB, Cuba
2 Instituto Nacional de Endocrinología, INEN, Cuba
3 Instituto de Medicina Tropical «Pedro Kourí», IPK, Cuba
4 Centro Nacional de Sanidad Agropecuaria, CENSA, Cuba
5 Dirección Provincial del Instituto de Medicina Veterinaria, IMV, Cuba
6 Centro Nacional de Biopreparados, BioCen, Cuba
7 E-mail: raiden@cenpalab.inf.cu
RESUMEN
Toxoplasma gondii es un protozoo con amplio rango de hospederos intermediarios y definitivos (felinos) y agente causal de la toxoplasmosis, zoonosis reemergente con alta distribución mundial. La seroprevalencia en humanos en Cuba es alta sin que se haya evaluado la seroprevalencia en el gato doméstico en La Habana. El presente estudio pretendió determinar la seroprevalencia de T. gondii en Felis catus en La Habana, Cuba. Se colectaron 300 muestras de sueros de gatos domésticos, recopiladas de los 15 municipios desde octubre de 2010 hasta abril de 2011. Las muestras fueron analizadas mediante ELISA de Inhibición. Los municipios fueron agrupados en una zona Central y una zona Periférica. Se encontró una seroprevalencia de 70%, sin diferencias significativas entre zonas y municipios. Los resultados obtenidos permitieron concluir que la seroprevalencia de T. gondii en gatos domésticos en La Habana fue elevada, la cual constituye un riesgo potencial de infección para todos sus hospederos, incluyendo al ser humano.
Palabras clave: seroprevalencia, Toxoplasma gondii, Felis catus, Habana
ABSTRACT
Toxoplasma gondii is a protozoan with a wide range of intermediate and definitive (felines) hosts and causal agent of toxoplasmosis, re-emergent zoonosis of worldwide distribution. The seroprevalence in humans in Cuba is high but the prevalence in the domestic cat in the capital city is unknown. The present study aimed to determine the seroprevalence of T. gondii in Felis catus in Havana, Cuba. A total of 300 serum samples from domestic cats were collected from 15 municipalities from October 2010 until April 2011. Samples were analysed by an ELISA Inhibition assay. Municipalities were grouped in a Central and in a Peripheral zone. The seroprevalence was 70%, without significant differences between zones and municipalities. The results allowed concluding that the seroprevalence of T. gondii in domestic cats in Havana was high, which constitutes a potential risk of infection for all hosts, including humans.
Key words: seroprevalence, Toxoplasma gondii, Felis catus, Havana
INTRODUCIÓN
Se estima que el 60% de la población humana mundial presenta títulos de anticuerpos contra T. gondii (Pappas et al., 2009), siendo en Europa y Latinoamérica entre 50 a 80% (Barriga, 1997). Estudios realizados en Cuba en los años 70 encontraron una prevalencia de T. gondii en humanos entre 25 y 30% (Entrena, 2011), habiéndose presentado un notorio aumento desde esa época. En el banco de sangre del municipio capitalino Marianao se encontró una prevalencia de 73.4% en el periodo de 2000 a 2003 (Martín- Hernández y García-Izquierdo, 2003), considerándose que en la actualidad, la prevalencia en Cuba fluctúa alrededor del 75% (Entrena, 2011).
Los felinos son los únicos hospederos de la forma sexuada del parásito y donde se producen los ooquistes, por lo que su presencia es esencial en el ciclo biológico de este protozoo (Jones y Dubey, 2010). La infección no puede ser mantenida en ausencia de los felinos, de allí que debe existir una alta correlación entre la adquisición de la infección y la presencia de felinos en el medio (Montoya y Remington, 2004).
En Cuba, las investigaciones sobre toxoplasmosis en gatos son escasas, principalmente por la carencia de medios diagnósticos y por la complejidad de los muestreos. Asimismo, no se dispone de estudios que hayan determinado la seroprevalencia de esta enfermedad en el gato doméstico (Felis catus) en el país.
El primer Taller Nacional de Toxoplasmosis celebrado en La Habana en 2000 en el Instituto de Medicina Tropical «Pedro Kourí» (IPK), reafirmó la necesidad del aseguramiento del programa nacional de vigilancia en embarazadas y personal de riesgo, así como la implementación del diagnóstico en la red de laboratorios de Medicina Veterinaria (Entrena, 2011). Dada la importancia que tienen los gatos como hospederos definitivos más cercanos al humano, ya sea como animal de laboratorio o mascota, en la transmisión de la toxoplasmosis (Jones y Dubey, 2010) y la elevada frecuencia de su presentación en la población humana en la capital cubana, se realizó la presente investigación con el objetivo de determinar la seroprevalencia de T. gondii en Felis catus en La Habana.
MATERIALES Y MÉTODOS
Estudio Epidemiológico
Se realizó un estudio transversal de T. gondii en la población felina doméstica de La Habana. Estos tipos de estudios se desarrollan en un momento concreto del tiempo, donde se estudia la existencia o no de la enfermedad, o la presencia o no de una infección de forma puntual (Pfeiffer, 2002); lo que en esta investigación equivaldría a la presencia o no de anticuerpos anti-T. gondii en el gato doméstico.
Tamaño y Selección de la Muestra
Para la selección del tamaño de la muestra, se consideró como referencia los valores de seroprevalencia de 70.3% (Dubey et al., 2007) y 84.9% (Moura et al., 2007) reportados en la región del Caribe. Se tomó en cuenta, además, lo planteado por Pfeiffer (2002) quien recomienda seleccionar 246 animales al azar cuando la prevalencia esperada de la enfermedad es aproximadamente del 80% y se trabaje con un 95% de confianza y un error de ± 5%.
Se trabajó con un tamaño de muestra de 300 gatos. Para ello, se muestreó un mínimo de 15 animales al azar de cada municipio de La Habana, desde octubre de 2010 hasta abril de 2011. Los felinos, tanto machos como hembras, tenían dos o más meses de edad, y fueron de las razas Pelocorto Cubano, Semilargo Cubano, Azul Cubano, Siamés Thai, Bengalí, Oriental o Balinés.
Toma de Muestra
Los gatos fueron inmovilizados mediante el método manual de sujeción del felino por el pliegue de la nuca con una mano, mientras que con la otra se sujetan las extremidades posteriores juntas. En otros casos, se envolvió al animal con un paño, excepto la cabeza y una de las extremidades anteriores, para la extracción de sangre (Dhein, 2009).
Se tomó 0.5 mL de sangre con jeringuilla de 5 mL y aguja 21 G, por punción de la vena radial y con previa antisepsia de la zona de extracción con alcohol al 70%. Para facilitar la canalización del vaso, se realizó la ligadura detrás de la articulación del codo. La sangre fue colectada en viales eppendorf de 1.5 mL y centrifugada a 1800 g por 5 minutos. El suero resultante se colectó en viales de 0.5 mL. Las muestras fueron conservadas a -20 °C hasta su análisis (Sharif et al., 2009).
Cálculo de la Prevalencia
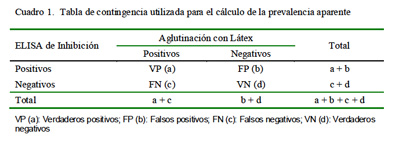
Se utilizó una tabla de contingencia de 2×2 (Cuadro 1) y la fórmula Pa (%) = (a+b)/ (a+b+c+d) × 100 (Pfeiffer, 2002), donde a = Total de sueros positivos al ELISA de Inhibición (ELISA/i) y a la Aglutinación con Látex, y b = Total de sueros positivos al ELISA/ i y negativos a la Aglutinación con Látex.
Serología
Las muestras fueron procesadas en el Laboratorio Nacional de Referencia de Toxoplasmosis del IPK, con la utilización de un ELISA/i, el cual fue diseñado para deter- minar anticuerpos anti-T. gondii en varias especies (Entrena, 2011). El conjugado se obtuvo de conejos inmunizados en el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), compuesto por una IgG policlonal anti-T. gondii conjugada con peroxidasa. Además, se utilizó un antígeno soluble proveniente de la cepa RH de T. gondii, donada por el IPK en 1988, la cual tiene su origen en el Instituto Pitik-Salpetriera de Francia, y que fue criopreservada en 5% de glicerol en nitrógeno líquido hasta ser utilizada.
La densidad óptica (DO) de las muestras se determinó en un lector de ELISA (VersaMaxPLUS ROM v. 1.21) a una longitud de onda de 492 nm. Se consideró como positivas aquellas muestras cuyo factor de inhibición fuera igual o mayor del 20%, negativas con un valor igual o menor al 15% y sospechosas con un valor mayor de 15% y menor de 20%.
Análisis Estadístico
Se realizaron distribuciones de frecuencias relativas para evidenciar la cantidad de gatos positivos y el porcentaje que representaban en la muestra seleccionada.
Para identificar las zonas de riesgo, la capital fue dividida en dos zonas compuestas aproximadamente por el 50% de sus municipios. Así, se consideró la zona Central (Plaza de la Revolución, Centro Habana, Marianao, Cerro, 10 de Octubre, Habana Vieja, San Miguel del Padrón y Regla) compuesta por 159 gatos, y la zona Periférica (Guanabacoa, Playa, La Lisa, Boyeros, Arroyo Naranjo, Cotorro y Habana del Este) compuesta por 141 gatos.
Se utilizó la prueba de comparación de proporciones para determinar la existencia de diferencias significativas entre resultados serológicos y entre zonas geográficas. Se consideró como asociación significativa el nivel de p<0.05. El programa estadístico empleado fue InfoStat v. 2.0.
RESULTADOS Y DISCUSIÓN
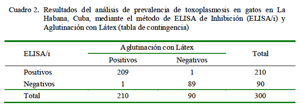
El procesamiento de las 300 muestras evidenció una positividad de 70% (Cuadro 2), resultado que denota una elevada seroprevalencia de T. gondii en los gatos de La Habana. Este valor fue similar al 70.3% en Isla Mona, Puerto Rico (Dubey et al., 2007) y al 84.9% en Saint Kitts (Moura et al., 2007), que evidencian una alta prevalencia de anticuerpos contra este protozoo en el Caribe. Por otro lado, Dorny et al. (2002) reportaron 70.2% de gatos positivos en Ghent, Bélgica, a pesar que las condiciones climáticas en Europa son diferentes a las de Cuba.
No obstante lo anterior, menores tasas de prevalencia, utilizando ELISA como método de diagnóstico, han sido reportadas en otros países. Así, 42% en Suiza (Jones y Dubey, 2010), 22% en Saitama, Japón (Huang et al., 2002), 17% en Jerusalén, Israel (Salant y Spira, 2004), 39% en Melbourne, Australia (Jones y Dubey, 2010) y 22% en Ciudad de México (Besné-Mérida et al., 2008).
El tipo de alimentación es un factor epidemiológico de importancia en la diseminación de la toxoplasmosis entre los gatos. En una población silvestre de gatos (Felis silvestris catus) en España se encontró 84.7% de prevalencia (Millán et al., 2009). En ese estudio, los gatos silvestres se alimentaban fundamentalmente de presas vivas (hospederos intermediarios); sin embargo, en el caso del presente estudio, los propietarios de los gatos mantuvieron un mayor control de la alimentación, de allí que debieron haber otros factores de importancia que favorecieron el alto nivel de este patógeno en la población local.
Los resultados del presente estudio coinciden con el planteamiento de Dubey (2010), quien indica que la seroprevalencia de T. gondii en cualquier especie varía según el área geográfica analizada, siendo mayor en climas cálidos y zonas bajas y húmedas, en comparación con climas fríos y zonas montañosas y secas; lo cual tiene relación con las condiciones ambientales que favorecen la esporulación y la supervivencia de los ooquistes. Asimismo, la prevalencia encontrada en estos gatos coincide con el 73.4% de seroprevalencia determinada en un estudio en humanos en La Habana (Martín- Hernández y García-Izquierdo, 2003), lo cual respalda la alta correlación existente entre la adquisición de la infección y la presencia de felinos en el medio (Montoya y Remington, 2004; Mollinedo, 2005).
La seroprevalencia calculada en esta investigación difiere en gran medida del 4% encontrado por Suárez et al. (2005) en 49 gatos en la provincia de Ciego de Ávila, Cuba. Sin embargo, el relativo bajo número de muestras para un agente biológico con elevada prevalencia (Pfeiffer, 2002), así como el uso de pruebas diagnósticas de menor sensibilidad como la prueba de Toxoplasmina (Acha y Szyfres, 2003), en comparación con la técnica empleada en el presente estudio, pudieron afectar los resultados obtenidos por estos autores.
La seroprevalencia de T. gondii fue estadísticamente similar entre las dos zonas geográficas definidas para La Habana, ya que se encontró el 74% de gatos positivos en la zona Central y 66% en la zona Periférica. Las estadísticas del Ministerio de Salud Pública presentan una población de 1 074 772 personas en la zona Central, lo cual representa el 45.5% de la población total de la capital. Estos valores llaman la atención dado que la zona Periférica casi triplica en extensión a la Central, contando con grandes extensiones de áreas verdes sin población humana. La mayor concentración de población humana en la zona Central posibilita la existencia de una mayor concentración de residuos en los microvertederos, lo cual trae consigo la presencia de aves silvestres, insectos (moscas y cucarachas) y roedores (ratas y ratones), que son atraídos por la disponibilidad de alimento. No obstante, este factor no contribuyó en forma significativa a la mayor frecuencia de gatos positivos a T. gondii en la zona Central.
Es importante destacar que los insectos mencionados están definidos como hospederos de transporte de T. gondii, dado que son capaces de difundir los ooquistes presentes en la materia fecal contaminada (Afonso et al., 2008). Asimismo, las aves y roedores están descritos como hospederos intermediarios de gran importancia, los cuales constituyen las presas vivas favoritas de los gatos (Baker et al., 2005). Los gatos podrían haber establecido una relación con estos hospederos al ingresar a los microvertederos, ya que estos no reúnen las condiciones necesarias para garantizar su hermeticidad. Por otra parte, esta relación también pudiera haberse establecido dentro de las viviendas, tras la migración de estas poblaciones a los hogares en busca de refugio. Sin embargo, quedaría por explicar las razones de la elevada prevalencia de este protozoo en la zona Periférica.
Tampoco se evidenciaron diferencias estadísticas en la seroprevalencia de T. gondii entre municipios, a pesar de que Habana Vieja, Marianao, San Miguel de Padrón y Regla fueron los municipios de localización central con mayor prevalencia (80 a 88%) y Guanabacoa fue el municipio con menor valor (48%). La prevalencia de T. gondii en el resto de los municipios varió entre 54 a 76%. La falta de significancia estadística pudo estar condicionada a que las variaciones climáticas entre municipios fueran muy pequeñas para modificar las condiciones necesarias de esporulación de los ooquistes o, posiblemente, a que la forma de dispersión más significativa en la infección de esta población felina no haya sido el ooquiste sino el bradizoíto, como refieren Dubey y Frenkel (1976). Por otra parte, es posible que los gatos no solo se hayan infectado con los bradizoítos presentes en las presas vivas, sino además, con estas formas infectivas presentes en las carnes crudas e insuficientemente cocidas suministradas por los propietarios (Gómez, 2004).
Los resultados obtenidos en el presente estudio permiten concluir que la prevalencia de anticuerpos contra T. gondii en los gatos domésticos de La Habana es elevada, lo cual trae consigo un riesgo potencial de infección para todos sus hospederos, ya sean intermediarios o definitivos, exponiendo al ser humano a una posible zoonosis (Dubey, 2010).
LITERATURA CITADA
1. Acha P, Szyfres B. 2003. Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. 3° ed. Washington: OPS. 413 p.
2. Afonso E, Lemoine M, Poulle ML, Ravat MC, Romand S, Thulliez P, Villena I, et al. 2008. Spatial distribution of soil contamination by Toxoplasma gondii in relation to cat defecation behaviour in an urban area. Int J Parasitol 38: 1017-1023.
3. Baker PJ, Bentley AJ, Ansell RJ, Harris S. 2005. Impact of predation by domestic cats Felis catus in an urban area. Mammal Rev 35: 302-312.
4. Barriga O. 1997. Inmunología de las infecciones parasitarias. En: Atías A (ed). Parasitología Médica. Chile: Ed. Mediterráneo. p 67-101.
5. Besné-Mérida A, Figueroa-Castillo JA, Martínez-Maya JJ, Luna-Pastén H, Calderón-Segura E, Correa D. 2008. Prevalence of antibodies against Toxoplasma gondii in domestic cats from Mexico City. Vet Parasitol 157: 310-313.
6. Dhein CR. 2009. Manipulación, restricción y examen físico de perros y gatos. Washington State University. [Internet], [3 abril 2011]. Disponible en: http://www.vetmed.wsu.edu/resources/restraint/&usg=AlkJrhhp_ZezGFe3qFVWTjr1UuLtSjFxw-Positional%20restraint
7. Dorny P, Speybroeck N, Verstraete S, Baeke M, De Becker A, Berkvens D, Vercruysse J. 2002. Serological survey of Toxoplasma gondii, feline immunodeficiency virus and feline leukaemia virus in urban stray cats in Belgium. Vet Rec 151: 626-629.
8. Dubey JP. 2010. Toxoplasmosis of animals and humans. 2nd ed. Maryland: CRC Press. 319 p.
9. Dubey JP, Frenkel JK. 1976. Feline toxoplasmosis from acutely infected mice and the development of Toxoplasma cysts. J Protozool 23: 537-546.
10. Dubey JP, Lopez-Torres HY, Sundar N, Velmurugan GV, Ajzenberg D, Kwok OCH, Hill R, et al. 2007. Mouse-virulent Toxoplasma gondii isolated from feral cats on Mona Island, Puerto Rico. J Parasitol 93: 1365-1369.
11. Entrena AAG. 2011. Desarrollo de un sistema inmunoenzimático de inhibición de un anticuerpo, para el diagnóstico de Toxoplasma gondii en diferentes especies. Tesis Doctoral. San José de las Lajas, Cuba: Universidad Agraria de La Habana. 126 p.
12. Gómez F. 2004. Estudio sobre la toxoplasmosis en Andorra y el Alto Urgel. Tesis Doctoral. Barcelona: Universidad de Barcelona. 289 p.
13. Huang X, Xuan X, Kimbita EN, Battur B, Miyazawa T, Fukumoto S, Mishima M, et al. 2002. Development and evaluation of an Enzyme-Linked Immunosorbent Assay with recombinant SAG2 for diagnosis of Toxoplasma gondii infection in cats. J Parasitol 88: 804-807.
14. Jones JL, Dubey JP. 2010. Waterborne toxoplasmosis – Recent developments. Exp Parasitol 124: 10-25.
15. Martín-Hernández I, García-Izquierdo S. 2003. Prevalencia de anticuerpos IgG contra Toxoplasma gondii en donantes de sangre cubanos. Rev Biomed 14: 247-251.
16. Millán J, Cabezón O, Pabón M, Dubey JP, Almería S. 2009. Seroprevalence of Toxoplasma gondii and Neospora caninum in feral cats (Felis silvestris catus) in Majorca, Balearic Islands, Spain. Vet Parasitol 165: 323-326.
17. Mollinedo PS. 2005. Toxoplasmosis. [Internet], [2 agosto 2011]. Disponible en: http://www.galenored.com/trabajos/?id=128
18. Montoya J, Remington J. 2004. Toxoplasma gondii. En: Mandell GL, Douglas GR, Bennett J (eds). Enfermedades infecciosas, principios y práctica. 5° ed. EEUU: Médica Panamericana. p 3452-3487.
19. Moura L, Kelly P, Krecek RC, Dubey JP. 2007. Seroprevalence of Toxoplasma gondii in cats from St. Kitts, West Indies. J Parasitol 93: 952-953.
20. Pappas G, Roussos N, Falagas ME. 2009. Toxoplasmosis snapshots: Global status of Toxoplasma gondii seroprevalence and implications for pregnancy and congenital toxoplasmosis. Int J Parasitol 39: 1385-1394.
21. Pfeiffer DU. 2002. Veterinary epidemiology. An introduction. UK: Royal Veterinary College, University of London. 102 p.
22. Salant H, Spira DT. 2004. A crosssectional survey of anti-Toxoplasma gondii antibodies in Jerusalem cats. Vet Parasitol 124: 167-177.
23. Sharif M, Daryani A, Nasrolahei M, Ziapour SP. 2009. Prevalence of Toxoplasma gondii antibodies in stray cats in Sari, northern Iran. Trop Anim Health Prod 41: 183-187.
24. Suárez MH, González AF, Gardón BYQ, Martínez RS. 2005. Infección y enfermedad por Toxoplasma gondii en animales y humanos en 23 años de observación en la provincia de Ciego de Ávila, Cuba. Rev Biomed 16: 21-27.
Recibido: 17 de agosto de 2012
Aceptado para publicación: 18 de marzo de 2013