Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.4 Lima dez./dic. 2013
Efecto anestésico del metasulfonato de tricaína en paiches (Arapaima gigas) juveniles
Anesthetic effect of tricaine methanesulfonate in juvenile paiches (Arapaima gigas)
Elizabeth Hinostroza M.1,2, Enrique Serrano-Martínez1
1 Grupo SALUVET-UPCH, Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia, Lima
2 E-mail: clarisa.hinostroza@upch.pe
RESUMEN
El presente estudio tuvo por objetivo evaluar la efectividad anestésica del metasulfonato de tricaína (MS-222) en seis paiches (Arapaima gigas) juveniles (180-243 días). Los peces, procedentes de la ciudad de Iquitos, con peso promedio de 730 g, fueron transportados a la Universidad Peruana Cayetano Heredia, en Lima. Los peces fueron expuestos en cuatro oportunidades a cuatro dosis de MS- 222 (25, 50, 75 y 100 mg/L), para evaluar la duración de la inducción y recuperación, así como la tasa de supervivencia post-anestesia. Se registró la frecuencia de ventilación opercular y la frecuencia cardiaca mediante ecografía, y se tomaron muestras de sangre para un análisis de hemograma pre y post-anestesia. El periodo de inducción fue menor y el periodo de recuperación fue mayor a medida que aumentó la concentración del anestésico. No se observaron diferencias estadísticas en los valores hematológicos y fisiológicos pre y post-anestesia. Se concluye que el MS- 222 (100 ppm) tiene efectos anestésicos eficientes en paiches juveniles en la concentración de 100 mg/L.
Palabras clave: anestesia, Arapaima gigas, frecuencia opercular, tricaína, paiches, MS-222
ABSTRACT
The objective of the present study was to evaluate the effectiveness of tricaine methanesulfonate (MS-222) as anesthetic in six juvenile paiches (Arapaima gigas) (180-243 days) with a body weight of 730 g. The specimens were brought from the Iquitos city to the Universidad Peruana Cayetano Heredia in Lima. They were exposed in four opportunities to four doses of MS-222 (25, 50, 75, and 100 mg/L) to evaluate the duration of induction and recovery as well as the survival rate post anesthesia. The opercular ventilation frequency was counted and heart rate was measured by ultrasound. Blood samples were collected and the haemogram values were obtained pre and post anesthesia. The induction period was shorter and the recovery period was higher when the concentration of anesthetic was increased. None statistical differences were found in the haemogram or in physiological values before and after anesthesia. It was concluded that the MS-222 (100 ppm) have efficient anesthetic effects in paiches at the 100 mg/L concentration.
Key words: anesthesia, Arapaima gigas , opercular frequency, tricaine, paiche, MS-222
INTRODUCCIÓN
La anestesia es un acto médico controlado en el que se utilizan fármacos para bloquear la sensibilidad táctil y dolorosa (Keene et al., 1998). En la actualidad, el uso de la anestesia en peces es importante porque contribuye a disminuir el estrés producido cuando se necesita realizar un manejo clínico, obtener muestras de tejidos o líquidos corporales y realizar mediciones que se requieran para poder llevar a cabo programas de manejo reproductivo, control sanitario y otros (Cho y Heath, 2000; Velasco-Santamaría et al., 2008; Scott et al., 2009).
Uno de los beneficios de la anestesia en los peces en la posibilidad de manipular al animal durante una fracción de tiempo fuera del agua, minimizando el riesgo que implica el estrés (Ferreira et al., 1980; Honczaryk y Kioshi, 2009; Pérez et al., 2010). Las consecuencias de los daños relacionados con el estrés en los peces incluyen, entre otras, el aumento de la susceptibilidad a enfermedades infecciosas.
El metasulfonato de tricaína (MS-222) es un derivado de la benzocaína, aprobado por la FDA (Food and Drug Administration, EEUU) para su uso en peces, y requiere de un periodo mínimo de 21 días de retiro (Cho y Heath, 2000; Murray, 2002; Córdova y Braun, 2007). Es un polvo ligeramente ácido y soluble en el agua, que permite una concentración de 15 a 330 mg/L. Cuando se le utiliza para baños anestésicos, se debe añadir 1 mg de bicarbonato de sodio por cada miligramo de MS-222 (Scott et al., 2009).
La dosis del anestésico depende del grado de anestesia deseada, la especie y tamaño del pez, así como la temperatura y la dureza del agua (Cho y Heath, 2000). Muchos peces, sobre todo los teleósteos, se pueden anestesiar con 60 a 150 mg/L, donde la dosis no siempre depende del tamaño del pez y la edad, siendo el efecto anestésico más eficaz en agua tibia y de dureza baja (Scott et al., 2009). La inducción de la anestesia se da en un periodo corto, produce analgesia y buena miorrelajación. Asimismo, la recuperación de la anestesia depende de su concentración y el tiempo de exposición (Scott et al., 2009).
En el Perú, el paiche (Arapaima gigas), es una especie de gran importancia para el poblador Amazónico, por ser fuente de alimentación y generador de ingresos a través de la comercialización de los subproductos.
Esta especie de agua dulce pertenece a la familia de los Arapaimidae (Osteoglossidae), siendo uno de los mayores peces de agua dulce, llegando a medir hasta 3 m de longitud total y 200 kg de peso total (Sandoval, 2007). Teniendo en consideración la carencia de estudios sobre anestesia en paiche en el Perú, y existiendo la necesidad de innovar protocolos que permitan su aplicación, el presente estudio tuvo como objetivo evaluar la efectividad anestésica del MS-222, y determinar los periodos pre y post-anestesia, así como los cambios hematológicos, conducta y frecuencia cardiaca. Se trabajó con paiches juveniles, grupo etario que está considerado entre los 30 y 180 días de edad.
MATERIALES Y MÉTODOS
Animales
Se trabajó con seis paiches juveniles, clínicamente sanos, provenientes de un mismo desove. Los peces fueron proporcionados por el criadero de paiches «Rancho The Tiger», localizado en el km 45 de la Carretera Nauta, Iquitos y tenían 159 días de edad, 730 g de peso y 30 cm de longitud en promedio cuando fueron trasladados a Lima por vía aérea.
El traslado se realizó en cajas de transporte con oxígeno y los peces tuvieron tres semanas de aclimatación en el laboratorio en Lima.
Fase Pre-experimental
El estudio se llevó a cabo en el laboratorio de Farmacología y Fisiología de la Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia (UPCH), Lima. Los peces se alojaron en una piscina desmontable (Bestway®) de fibra de polyester y PBC de 1000 L de capacidad, con aeración constante con bombas de aire (Flowclear®), temperatura ambiente de 25 a 32 °C, y temperatura del agua de 28 a 30 °C, con oxígeno disuelto en 8 ppm, anhídrido carbónico de 0.9 ppm, conductividad eléctrica de 19.3 Umhos/cm y pH de 5.5 a 6.
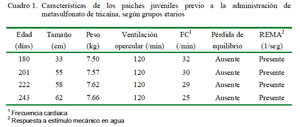
Los individuos fueron alimentados con peces (Poecilia reticulata) vivos o descongelados, a razón de dos veces al día y en cantidad ad libitum; sin embargo, el alimento fue suspendido 24 horas previo a la fase de experimentación. En la etapa pre-experimental se evaluaron las características fisiológicas (Cuadro 1) para confirmar el estado pre-anestésico.
Fase Experimental
Como sustancia anestésica se empleó el MS-222 (Tricaine-S®, Western Chemical Inc.) en polvo, en frasco de 100 g (100% de pureza), aplicándose en cuatro grupo etarios (180, 201, 222 y 243 días de edad) y en cuatro concentraciones (25, 50, 75 y 100 mg/L), en forma tal que cada pez fue anestesiado en cuatro oportunidades conforme fueron desarrollando. El tiempo de descanso entre las evaluaciones por edades fue de 21 días.
Se empleó el método de anestesia por inmersión para facilitar una mayor absorción branquial del anestésico; asimismo, cada animal fue testigo de sí mismo. El tiempo esperado máximo de inducción fue de 10 minutos. Las variables de respuesta a la anestesia fueron:
- Tiempo de inducción (TI), tiempo que media entre la aplicación del anestésico y la pérdida de la conciencia,
- Periodo de anestesia (PA), periodo en que el pez pierde totalmente la conciencia y hay una respuesta motora nula,
- Tiempo de recuperación (TR), tiempo que media entre el cese del anestésico hasta que el animal recupera totalmente la conciencia,
- Frecuencia de ventilación opercular (FO),
- Supervivencia post-anestesia (SPA),
- Pérdida de equilibrio (PE), que se da cuando el pez nada de costado,
- Respuesta al estímulo mecánico (REMA), donde el pez en estado normal huye rápidamente al sentir un chapoteo realizado con la mano del operador, o tiene un desplazamiento lento o nulo cuando está sedado o anestesiado.
El criterio para considerar un pez anestesiado fue la pérdida de la conciencia y falta de respuesta motora, y esto ocurre cuando el pez deja de nadar y tiene una respuesta nula al estímulo mecánico. Asimismo, se consideró que el pez se encuentra recuperado de la anestesia cuando respondió a estímulos mecánicos y puede nadar manteniendo el equilibrio corporal. Los periodos de anestesia considerados en el estudio fueron de sedación leve (0), narcosis leve (1), anestesia leve (2) y colapso medular (3), según lo descrito por Marking y Meyer (1985).
La inducción se realizó en un recipiente con capacidad de 50 litros, de poliestireno expandido (tecnopor) y revestido con una lámina de polietileno. El agua empleada fue de las mismas características y condiciones que aquella en la piscina de alojamiento, con la excepción del MS-222 que se añadió en las concentraciones señaladas. La inducción de la anestesia se realizó de forma individual y el tiempo que se dejó a los peces en la fase de anestesia fue de 10 minutos.
Para la fase de recuperación se empleó un contenedor similar al utilizado en la inducción con agua libre de anestésicos y con las mismas condiciones que el agua del alojamiento.
Se dejó al pez en el contenedor de recuperación por 15 minutos y luego se le pasó a otro contenedor libre de anestésico por 10 minutos adicionales a fin de retirar de la piel el residuo del fármaco.
Colección y Procesamiento de Muestras
La frecuencia cardiaca se tomó en la región pectoral con ayuda de un ecógrafo de uso veterinario (Falcón 100, Pie Medical) con transductor de 5.0 MHz.
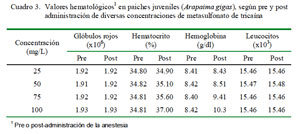
En la fase previa y durante el periodo de anestesia se colectaron muestras de sangre en microcapilares con EDTA y tubos estériles al vacío, mediante punción de la vena caudal con agujas 21 x 1.5". La sangre se centrifugó a 3000 rpm por 10 min y de determinó el valor del hematocrito. Asimismo, se hizo un frotis delgado en láminas portaobjetos (Sumbow®) con la sangre de los tubos con EDTA y se determinó el hemograma. La primera toma de sangre se realizó 5 min antes de la anestesia y la segunda toma fue 10 min después de aplicado el MS-222.
Análisis de Datos
Se realizó estadística descriptiva, expresada como media y desviación estándar (DE).
Se determinó la diferencia entre los valores obtenidos en peces testigos (previo a la anestesia) y tratados (fase de anestesia) a través de la prueba no paramétrica de U de Mann Whitney. Para determinar diferencias entre dosis de anestésico se empleó la prueba de ANOVA de dos vías.
Se calculó la efectividad de la droga con la siguiente fórmula:

La efectividad fue considerada como muy efectiva (>98%), efectiva (90 a 98%), moderadamente efectiva (80 a 89%) e insuficientemente efectiva (<80%) (Kassai, 1998).
RESULTADOS Y DISCUSIÓN
Este estudio es considerado el primer reporte de anestésicos en el paiche en el Perú.
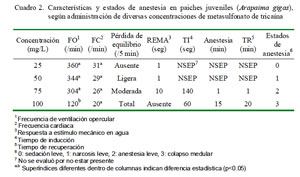
El uso de MS-222 presentó una eficacia de 100% (6/6) cuando se empleó la mayor concentración (100 mg/L) y una eficacia nula (0/6) con las concentraciones menores. Asimismo, no se observó casos de mortalidad antes, durante, o después de la inducción y recuperación anestésica.
Estudios similares en Colossoma macropomum demostraron la eficacia del uso de benzocaína (Gomes et al., 2001) y de eugenol (Roubach et al., 2005). Asimismo, estudios con MS-222 indujeron un efecto anestésico en un tiempo menor a 2 min y con una pronta recuperación en Piaractus brachypomus (cachama blanca) (Velasco- Santamaría et al., 2008).
El MS-222 se absorbe rápidamente a través de las branquias. Su modo de acción es la prevención de la generación y conducción de impulsos nerviosos (Gleed y Ludders, 2001). Tiene acciones directas sobre el sistema nervioso central, sistema cardiovascular, uniones neuromusculares y sinapsis de ganglios. Se metaboliza principalmente por el hígado, y una fracción por los riñones, sangre y músculo. La conjugación y la hidrólisis son las principales vías metabólicas. Los metabolitos primarios son los conjugados de acetil y etil m-aminobenzoato (no polar) y el ácido m-benzoico (polar). El MS-222 y sus metabolitos no polares se excretan a través de las branquias. Los metabolitos polares se excretan por los riñones y, al igual que otros agentes anestésicos para peces, tiene un efecto dosis-dependiente que varía entre especies y entre individuos.
En el presente estudio, al comparar los promedios de tiempos de inducción y recuperación, se observó que los grupos expuestos a una solución de 100 mg/L presentaron el menor y mayor tiempo de inducción y recuperación, respectivamente (p<0.05). Además, se observó cierta disminución de la frecuencia cardiaca a medida que aumentó la concentración del anestésico, aunque sin haber diferencia estadística entre grupos (Cuadro 2).
La frecuencia de ventilación opercular disminuyó a medida que la concentración se incrementó (p<0.05, Cuadro 2). La frecuencia respiratoria se identifica por el movimiento opercular, que disminuye en función de la dosis del anestésico. Se presume que la ventilación disminuye conforme disminuyen los movimientos orales y operculares (Cho y Heath, 2000).
Los valores de hematocrito y hemoglobina no variaron por efecto de la concentración del anestésico (Cuadro 3), aunque Kurt et al. (2001) reportan una elevación del hematocrito con el incremento de la concentración de MS-222 en cachama blanca (Piaractus brachypomus). El origen de este incremento no se ha determinado, pero se postula que durante la anestesia el pez tenga una contracción esplénica que ocasiona un incremento en el volumen de glóbulos rojos.
Asimismo, se ha descrito que el MS- 222 causa hipoxia, hipercapnea y acidosis, causando hiperglicemia e incrementos de los valores de potasio, magnesio, hemoglobina y hematocrito. También puede ocurrir depresión cardiorespiratoria y, eventualmente, la muerte a causa de los cambios hemodinámicos (Murray, 2002). Ferreira et al. (1980) describen que el efecto del incremento del hematocrito por la benzocaína, anestésico químicamente parecido al MS-222, en Cypirinus carpio se debe a la tumefacción de los eritrocitos y no a hipoxia o asfixia, pero que los cambios neuroendocrinos que pueden producir hemoconcentración también dependen del tiempo de exposición a la sustancia.
En el estudio de Honczaryk y Kioshi (2009) de anestesia en paiches se utilizó benzocaína por aspersión branquial en dosis similares a las del presente estudio. La benzocaína, al igual que la tricaína, es un derivado del ácido benzoico, pero puede ser más tóxica para algunas especies (Noga, 2011).
Asimismo, las dosis empleadas pueden tener el efecto deseado de sedación, mas no de anestesia en peces de menor tamaño (Honczaryk y Kioshi, 2009), por lo que se puede concluir que el efecto de la dosis depende del tamaño del pez, no observándose diferencias estadísticas por efecto de la edad.
En el estudio anterior solo fue posible hacer el experimento con dos peces de 32 cm, en tanto que en el presente estudio se utilizaron seis individuos de edades y tamaños similares, partiendo de la dosis de 25 mg e incrementando la concentración hasta los 100 mg que demostró ser una dosis efectiva, sin que pueda ser considerada como dosis alta dado que no se observaron diferencias estadísticas en los parámetros evaluados, ni signos de toxicidad o mortalidad. Sería conveniente probar dosis más altas a fin de conocer la curva dosis-respuesta.
CONCLUSIONES
-
El MS-222 (100 ppm) tiene efectos anestésicos en paiches juveniles en la concentración de 100 mg/L.
-
Las variables frecuencia opercular, frecuencia cardiaca, y niveles de hematocrito, hemoglobina, glóbulos blancos y glóbulos rojos, no se encontraron asociadas con la concentración de MS- 222 en el paiche.
Agradecimiento
Los autores agradecen a los acuicultores Wenseslao Solsol y Manuel García por el apoyo brindado en campo; al MV Ricardo Grandez, Mg Néstor Falcón y Mg Armando Hung por su asesoría profesional; al Tec Marco Quispe por su apoyo técnico; a los profesionales de la Dirección Regional de la Producción (DIREPRO) de Loreto, biólogos Carlos Cabrera, César Correa y Debbie Reátegui; y al Dr. Fred Chu del Instituto de Investigaciones de la Amazonía Peruana (IIAP).
El presente trabajo fue desarrollado con el apoyo financiero de la Presidencia del Consejo de Ministros a través del FINCyT (Contrato N.° 017-FINCyT-PIBAP-2009).
LITERATURA CITADA
1. Cho GK, Heath DD. 2000. Comparison of tricaine methanesulphonate (MS22) and clove oil anaesthesia effects on the physiology of juvenile chinook salmon Oncorhinchus tshawytscha (Walbaum). Aquac Res 31: 537-546.
2. Cordova MS, Braun CB. 2007. The use of anesthesia during evoked potential audiometry in goldfrish (Carassius auratus). Brain Res 1153: 78-83.
3. Ferreira JT, Smit GL, Shoonbee HJ. 1980. Haematological evaluation of the anaesthetic benzocaine hydrochloride in the freshwater fish Cyprinus Carpio L. J Fish Biol 18: 291-297.
4. Gleed RD, Ludders JW. 2001. Recent advances in veterinary anesthesia and analgesia: companion animals. International Veterinary Information Service [Internet], [accessed 18 may 2011]. Available in: http://www.ivis.org
5. Gomes LC, Chippari-Gomes AR, Lopes NP, Roubach R, Araujo-Lima C. 2001. Efficacy of benzocaine as an anesthetic in juvenile tambaqui Colossoma macropomum. J World Aquacult Soc 32: 426-431.
6. Honczaryk A, Kioshi LA. 2009. Anesthesia in piracuru by eugenol sprays in the gills. Cienc. Rural 2: 577-579.
7. Kassai T. 1998. Helmintología veterinaria. Zaragoza: Ed Acribia. p 68-88.
8. Keene JL, Noakes DLG, Moccia RD, Soto CG. 1998. The efficacy of clove oil as an anaesthetic for rainbow trout, Oncorhynchus mykiss (Walbaum). Aquac Res 29: 89-101.
9. Kurt KS, Clifford RS, Michael KS, Michael RL, Gregory AL. 2001. Comparative efficacy of tricaine methanesulfonate and clove oil for use as anesthetics in red pacu (Piaractus brachypomus). Am J Vet Res 3: 337-342.
10. Marking LL, Meyer FP. 1985. Are better anesthetics needed in fisheries? Fisheries Sci 10: 2-5.
11. Murray MJ. 2002. Fish surgery. Semin Avian Exot Pet 11: 246-257.
12. Noga EJ. 2011. Fish disease, diagnosis and treatment. USA: Willey Blackwell. 250 p.
13. Pérez PA, Santos L, Eloy AA, Vieira P, Solis LD. 2010. Aceite de clavo como anestésico para el pez pacu (Piaractus mesopotamicus). An Vet, Murcia 26: 69-76.
14. Roubach R, Gomes LC, Leao Fonseca FA, Val AL. 2005. Eugenol as an efficacious anaesthetic for tambaqui, Colossoma macropomum (Cuvier). Aquac Res 36: 1056-1061.
15. Sandoval Chacón M. 2007. Aspectos de manejo, alimentación y reproducción del paiche (Arapaima gigas) en la Amazonía Peruana. Iquitos, Perú: Instituto de investigación de la Amazonia Peruana. 30 p.
16. Scott EP, Weiss Ch, Schwarz T, Innis Ch. 2009. Anesthesia, diagnostic imaging and surgery of fish. Comp Cont Educ Pract 31: E1-E9.
17. Velasco-Santamaría Y, Palacios-Ruiz, C, Cruz-Casallas P. 2008. Eficiencia anestésica de 2-fenoxietanol, benzocaína, quinaldina y metasulfonato de tricaína en alevinos y juveniles de cachama blanca (Piaractus brachypomus). Rev MVZ Córdova 13: 1435-1445.
Recibido: 19 de abril de 2012
Aceptado para publicación: 30 de mayo de 2013