Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.4 Lima dic./dic. 2013
Efecto de la adición de fluido prostático autólogo y heterólogo sobre la calidad espermática del semen canino
Effect of adding autologous or heterologous prostatic fluid on canine sperm quality
Alfonso Sánchez R.1,2, Cristóbal Bravo V.1
1 Hospital Clínico Veterinario, Escuela de Medicina Veterinaria, Universidad Santo Tomás, Viña del Mar, Chile
2 E-mail: profesanchez@gmail.com
RESUMEN
Se evaluó el efecto de la adición de fluido prostático autólogo o heterólogo al semen canino incubado a 38 ºC (termorresistencia) sobre la motilidad y vigor espermático. Se colectaron 15 eyaculados de perros Bulldog inglés adultos, mediante manipulación digital, recuperando por separado la fracción espermática y las fracciones prostáticas. Estas últimas fueron procesadas y conservadas a -18 ºC. Se hizo un espermiograma a cada eyaculado y se fraccionaron en tres partes de 0.5 ml, agregándoseles 1 ml de fluido prostático autólogo, fluido prostático heterólogo o suero fisiológico. Las muestras fueron incubadas a 38 °C por 60 minutos, haciendo mediciones de motilidad progresiva y vigor espermático a los 0, 15, 30, 45 y 60 minutos. Los resultados mostraron una disminución lineal de ambos parámetros con el tiempo de incubación en los tres medios, sin haber diferencia estadística entre medios o entre tiempos de incubación. Se concluye que la motilidad progresiva y el vigor espermático de semen canino diluido con fluido prostático autólogo o heterólogo fueron similares al semen diluido con suero fisiológico.
Palabras clave: semen canino, fluido prostático, termorresistencia espermática
ABSTRACT
The effect of adding autologous or heterologous prostatic fluid in canine sperm and incubated at 38 °C (thermoresistance) on sperm motility and spermatic vigor was evaluated. Fifteen ejaculates were collected from mature English bulldog by digital manipulation. The sperm fraction and the prostatic fractions were kept separated during the collection. Prostatic fluids were processed and stored at -18 °C. An spermiogram was done for each ejaculate and then distributed in three aliquots of 0.5 ml and added 1 ml of autologous prostatic fluid, heterologous prostatic fluid or saline solution. The samples were incubated at 38 °C for 60 minutes measuring the progressive motility and spermatic vigor at 0, 15, 30, 45 and 60 minutes. The results showed a lineal decreased for both parameters during the evaluation period, and without statistical difference between treatments or times of incubation. It is concluded that the progressive motility and spermatic vigor of canine semen diluted with prostatic fluid either analogous or heterologous were similar to those on saline solution.
Key words: canine semen, prostatic fluid, spermatic thermal resistance
INTRODUCCIÓN
En la actualidad, dado que la crianza de perros es una afición y mercado de distribución mundial, la adecuada evaluación de los reproductores y del semen, la preservación del esperma y la inseminación artificial (IA) se han constituido en temas de alto interés, tanto para médicos veterinarios como para criadores.
En la mayoría de especies de interés zootécnico, la IA es una biotecnología empleada fundamentalmente para acelerar el mejoramiento genético; sin embargo, en la reproducción canina tiene, además, una serie de aplicaciones clínicas, destacándose como una herramienta para la solución de problemas físicos en el apareamiento, característicos de razas tales como el Bulldog Inglés (Sánchez et al., 2006). La IA se ha convertido en una práctica habitual en el manejo reproductivo canino, reportándose que alrededor del 65% de las inseminaciones se realizan con semen recién recolectado y depositado con un catéter a nivel vaginal (Linde- Forsberg, 2006).
El volumen del eyaculado canino varía de acuerdo al tamaño de los reproductores, y fluctúa entre 1 y 40 ml. Presenta tres fracciones, siendo la primera y la tercera de origen prostático y la segunda es la fracción rica o espermática que contiene a los espermatozoides. Hasta el 90% del volumen total del eyaculado puede estar constituido por fluido prostático (Farstad, 2010).
El volumen de semen apropiado para realizar la IA se encuentra entre 2 y 8 ml. En aquellos casos en que el volumen seminal sea pequeño, como puede ocurrir con razas pequeñas o en machos con alteraciones prostáticas, se recomienda incorporar un diluyente seminal o fluido prostático a la segunda fracción del eyaculado (Linde- Forsberg, 2006).
En la clínica reproductiva, especialmente en la valoración andrológica y para la IA, se debe evaluar la calidad seminal para determinar la fertilidad potencial de los reproductores. En el caso del canino, al igual que en otras especies, se consideran parámetros tales como motilidad progresiva, morfología espermática y concentración espermática (Root Kustritz, 2007). No obstante, uno de los desafíos para el trabajo de terreno o en la clínica diaria es la búsqueda de técnicas simples de evaluación. Una prueba sencilla y de bajo costo es la prueba de termorresistencia espermática, desarrollada por Dimitropulus (1967) para la valoración de la fertilidad potencial de espermatozoides bovinos.
Considerando la posibilidad de aumentar el volumen de las dosis de semen sin alterar la calidad espermática, el presente estudio tuvo por objetivo evaluar el efecto de la adición de fluido prostático autólogo, fluido prostático heterólogo y suero fisiológico al semen canino incubado a 38 ºC (termoresistencia) sobre la motilidad espermática.
MATERIALES Y MÉTODOS
Obtención de Semen
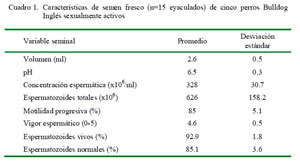
El estudio se realizó en el Hospital Clínico Veterinario de la Universidad Santo Tomás, Sede Viña del Mar, Chile. Se utilizaron cinco canes machos adultos de la raza Bulldog Inglés, clínicamente sanos. Los canes tenían entre 1.5 a 3.5 años y 25.7 ± 2.7 kg de peso corporal.
Se colectó un total de 15 eyaculados. El semen se recolectó mediante el método de manipulación digital en un vaso temperado a 38 °C. La fracción espermática y el fluido prostático fueron recuperados en vasos colectores distintos.
Espermiograma
Los eyaculados fueron evaluados según el procedimiento descrito por England y Allen (1989) y Sánchez et al. (2006), registrándose volumen, color, pH, motilidad progresiva (porcentaje de espermatozoides con movimiento de avance progresivo), vigor espermático (intensidad del movimiento, medido en una escala de 0 a 5, donde 0: sin movimiento, 5: fuerte movimiento de avance), vitalidad espermática, concentración y morfología espermática.
Fluido Prostático
Se hicieron colectas previas de semen para la obtención de fluido prostático, obteniéndose de la tercera fracción del eyaculado entre 3 y 5 ml de cada macho.
Una vez colectado, el fluido prostático fue depositado en tubos plásticos estériles y centrifugados a 3000 rpm por 5 min. El sobrenadante se pasó a través de un filtro de membrana para jeringa de 25 mm de diámetro y poros de 0.45 μm. El filtrado se transfirió en volúmenes de 1 ml a microtubos y se almacenó a -18 °C (Nöthling y Volkmann, 1993).
Para los fines de este estudio, se considera como fluido prostático autólogo (FPA) aquel que corresponde al mismo dador de la fracción espermática y fluido prostático heterólogo (FPH) aquel que corresponde a un dador distinto al de la fracción espermática.
Preparación de las Muestras
Previo a la obtención de cada eyaculado se descongeló un vial de FPA y otro de FPH. Para esto, los viales fueron puestos en baño maría a temperatura controlada de 37 °C por 5 min.
Cada fracción espermática colectada (n=15) se dividió en tres alícuotas de 0.5 ml cada una y depositadas en tubos de microcentrifugado. Se agregó 1 ml de FPA, FPH o suero fisiológico (cloruro de sodio 0.9 %) en las alícuotas correspondientes. La concentración espermática en cada muestra diluida a incubar (1.5 ml) fluctuó entre 125 x 106 y 175 x 106 espermatozoides.
Prueba de Termorresistencia Espermática Las muestras fueron incubadas por una hora en un baño controlado a 38 ºC, adaptando la técnica original (Dimitropulus, 1967).
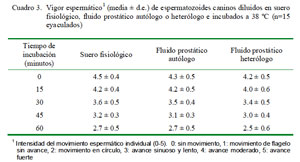
La motilidad progresiva y el vigor espermático fueron evaluados inmediatamente después de realizada la dilución de la fracción espermática (tiempo 0) y a los 15, 30, 45 y 60 minutos. La evaluación de la motilidad se realizó en forma paralela en cada tiempo para las tres muestras de cada eyaculado, tomando una gota de cada dilución y colocándola sobre un portaobjeto temperado a 38 ºC. Las muestras fueron observadas en un microscopio de campo claro, con objetivos de 40X y 100X y un ocular de 10X.
Análisis Estadístico
Los datos fueron transformados a valores angulares (ángulo = arcoseno x) para llevarlos a la distribución normal (Zar, 1999).
Se empleó el análisis de varianza para determinar diferencias estadísticas en la motilidad espermática según el tiempo de incubación (0, 15, 30, 45 y 60 min) y la prueba de Tukey para determinar diferencias entre tratamientos.
Asimismo, se hizo el análisis de correlación de Pearson para la comparación en los tiempos de evaluación. Se trabajó con el programa estadístico Prism® v. 3.0.
RESULTADOS
Los machos respondieron satisfactoriamente al método de extracción de semen y las variables seminales se ubicaron dentro de los rangos descritos como normales para la especie (Cuadro 1) (England y Allen, 1989; Root Kustritz, 2007).
En la prueba de termorresistencia espermática, la motilidad progresiva y el vigor espermático mostraron una disminución lineal según el tiempo de incubación en los tres medios utilizados como dilutores (p<0.05), sin haber diferencia significativa entre dilutores (Cuadro 2 y cuadro 3). No obstante, cabe destacar que la motilidad progresiva en los espermatozoides incubados con suero fisiológico fue levemente superior a la motilidad observada con fluido prostático en todos los tiempos de incubación (Cuadro 2).
DISCUSIÓN
La prueba de termorresistencia espermática tiene por principio la exposición de los espermatozoides a las condiciones fisiológicas de temperatura del tracto genital femenino, a fin de estimar su capacidad de mantener la motilidad espermática (Dimitropulus, 1967). La temperatura intravaginal canina fluctúa entre 37.5 y 38.5 ºC (Maeder et al., 2012). En la deposición del semen a través de la monta natural o inseminación intravaginal tradicional, los espermatozoides se encuentran expuestos a dichas temperaturas hasta que ocurra la migración hacia las porciones anteriores del tracto genital (England et al., 2006). En este proceso, el fluido prostático como componente del plasma seminal tiene, entre otras funciones, facilitar el avance de los espermatozoides y protegerlos de las condiciones adversas del ambiente vaginal (Farstad, 2010).
Los medios empleados en el presente estudio fueron ensayados para comparar su capacidad de favorecer o proteger a los espermatozoides en el tracto genital femenino y proponerlos como opción para aumentar el volumen de las dosis de semen en la IA. Los resultados mostraron un comportamiento similar de los tres medios durante los 60 minutos de la prueba de termorresistencia, indicando la ausencia de un efecto positivo sobre la motilidad progresiva y el vigor espermático del fluido prostático adicional que fuera empleado como diluyente. Por otro lado, la disminución de estos parámetros durante el proceso de incubación podría atribuirse a un rápido agotamiento del oxígeno disponible dado el metabolismo aeróbico de los espermatozoides (OConnell et al., 2002).
En la práctica de la IA con semen fresco es habitual colectar la fracción espermática y parte de la tercera fracción del eyaculado con el propósito aumentar el volumen de las dosis de semen (Linde-Forsberg, 2006). En el presente estudio, la adición de un mayor volumen de fluido prostático, autólogo o heterólogo, no mejoró la motilidad ni el vigor espermático en comparación con el uso de suero fisiológico.
La función precisa del fluido prostático canino en el tracto reproductor de la hembra es una interrogante y además, motivo de controversia (England et al., 2012). Es poco lo que se conoce sobre el efecto del fluido prostático en la función espermática, tanto en semen fresco como en semen refrigerado o congelado (Farstad, 2010). England (1993) y Rota et al. (1995) describen un detrimento significativo de la motilidad progresiva de espermatozoides almacenados con fluido prostático en condiciones de congelación y refrigeración, respectivamente, recomendando el fraccionamiento y centrifugación del semen a fin de eliminar el plasma seminal.
Sin embargo, Nöthling y Volkmann (1993) y Nöthling et al. (2005) destacan que la incorporación de fluido prostático autólogo al semen congelado-descongelado mejora las características de motilidad progresiva y la fertilidad del mismo. Asimismo, Hori et al. (2009) trabajando con espermatozoides epididimarios caninos recuperados con fluido prostático y England et al. (2012) utilizando fluido prostático en semen descongelado para inseminaciones transcervicales describen un efecto positivo sobre la calidad espermática y la fertilidad.
CONCLUSIONES
La motilidad progresiva y el vigor espermático de semen canino diluido con fluido prostático autólogo o heterólogo fueron similares al semen diluido con suero fisiológico en la prueba de termorresistencia.
LITERATURA CITADA
1. Dimitropulus E. 1967. La signification du test de la thermoresistance dans l´application de la valeur fecondante du sperme congelé. Ann Med Vet 4: 215-224.
2. England G. 1993. Cryopreservation of dog semen: a review. J Reprod Fert (Suppl 47): 243-255.
3. England G, Allen W. 1989. Seminal characteristics and fertility in the dog. Vet Rec: 125: 399.
4. England G, Burgess C, Freeman S, Pacey A. 2006. Relationship between the fertile periods and sperm transport in the bitch. Theriogenology 66: 1410-1418.
5. England G, Moxon R, Freeman S. 2012. Stimulation of mating-induced contractions in the bitch and their modification and enhancement of fertility by prostatic fluid. Reprod Dom Anim 47 (Suppl 6): 1-5.
6. Farstad W. 2010. Artificial insemination in dogs. In: England G, von Heimendahl A (eds). BSAVA Manual of canine and feline reproduction and neonatology. 2nd ed. England: British Small Animal Veterinary Association. p 80-88.
7. Hori T, Uehara Y, Kawakami E, Tsutsui T. 2009. Influence of the time between removal and cooling of the canine epididymis on post-thaw caudal epididymal sperm quality. J Vet Med Sci 7: 811-815.
8. Linde-Forsberg C. 2006. Inseminación artificial. En: Wanke M, Gobello C (eds). Reproducción en caninos y felinos domésticos. Buenos Aires: Inter-Médica. p 175-194.
9. Maeder B, Arlt S, Burfeind O, Heuwieser W. 2012. Application of vaginal temperature measurement in bitches. Reprod Dom Anim 47 (Suppl 6): 359-361.
10. Nöthling J, Volkmann D. 1993. Effect of addition of autologous prostatic fluid on the fertility of frozen-thawed dog semen after intravaginal insemination. J Reprod Fertil (Suppl 47): 329-333.
11. Nöthling J, Shuttleworth R, de Haas K, Thompson P. 2005. Homologous prostatic fluid added to frozen-thawed dog spermatozoa prior to intravaginal insemination of bitches resulted in better fertility than albumin-free TALP. Theriogenology 64: 975-991.
12. OConnell M, McClure N, Lewis S. 2002. The effects of cryopreservation on sperm morphology, motility and mitochondrial function. Hum Reprod 17: 704-709.
13. Rota A, Ström B, Linde-Forsberg C. 1995. Effects of seminal plasma and three extenders on canine semen stored at 4 ºC. Theriogenology 44: 885-900.
14. Root Kustritz M. 2007. The value of canine semen evaluation for practitioners. Theriogenology 68: 329-337.
15. Sánchez A, Cartagena A, Berland M. 2006. Comparación del efecto de dos diluyentes sobre la fertilidad potencial de semen canino refrigerado. Rev Inv Vet Perú 17: 1-7.
16. Zar J. 1999. Biostatistical analysis. 4th ed. New Jersey: Prentice Hall. 929 p.
Recibido: 14 de marzo de 2013
Aceptado para publicación: 27 de mayo de 2013