Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.4 Lima dic./dic. 2013
Evaluación in vitro de la respuesta leucocitaria de alpacas (Vicugna pacos) en presencia de antígenos clostridiales
Evaluation in vitro of the leukocyte response of alpacas (Vicugna pacos) in presence of clostridial antigens
Luis Tambillo G.1, Alberto Manchego S.1,3, Kim-Lam Chiok C.1, Nieves Sandoval C.2, Juan More B.1, Hermelinda Rivera G.1
1 Laboratorio de Microbiología y Parasitología Veterinaria,
2 Laboratorio de Histología, Embriología y Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
3 E-mail: amanchegos@gmail.com
RESUMEN
El objetivo del presente estudio fue evaluar la expresión de citoquinas proinflamatorias de leucocitos circulantes de alpaca al enfrentarlos a extracto total de Clostidium perfringens (componentes estructurales y toxinas). Se colectó sangre entera de la vena yugular de 5 alpacas hembras y 5 alpacas machos adultos. Los leucocitos fueron separados utilizando cloruro de amonio para lisar los eritrocitos, seguido de centrifugación y luego cultivados a una concentración de 500 000 leucocitos/ml de medio MEM (Medio Mínimo Esencial) en placas de cultivo de 12 pocillos. Simultáneamente, fueron enfrentados a extracto total de C. perfringens cultivados en caldo tioglicolato a concentraciones de 400, 80, 16, 0.8 y 0.2 μg/ml, para luego cuantificar, mediante la RTPCR, la expresión de las citoquinas TNFα, IL-1α, IL-1β e IL-6 a 1, 12 y 24 h de exposición. Los resultados demostraron que dosis bajas de extractos clostridiales (0.2 a 0.8 μg/ml) son capaces de inducir expresiones de TNFα, IL-1α, e IL-1β a 1, 12 y 24 h de incubación, a diferencia de dosis altas donde no sobrepasan la expresión de las citoquinas en leucocitos no estimulados (control). No se evidencia producción considerable de IL-6 hasta las 24 h post exposición a extracto completo de C. perfringens. Los resultados indican que el C. perfringens y sus toxinas a dosis bajas inducen la activación de los leucocitos circulantes de alpacas produciendo la secreción de citoquinas proinflamatorias.
Palabras clave: camélidos sudamericanos, enterotoxemia, citoquinas, RT-PCR en tiempo Real
ABSTRACT
The aim of this study was to evaluate the expression of proinflammatory cytokines of alpaca circulating leukocytes when confronting total extract of Clostridum perfringens (structural components and toxins). Whole blood was collected from the jugular vein of 5 female and 5 male adult alpacas. The leukocytes were separated using ammonium chloride to lyse erythrocytes followed by centrifugation and then cultured at a concentration of 500 000 cells/ml of MEM (Minimal Essential Medium) in culture plates of 12 wells. Simultaneously were challenged with total extract of C. perfringens grown in thioglycolate broth at concentrations of 400, 80, 16, 0.8 and 0.2 μg/ml and then quantifying by RT-PCR the expression of cytokines TNFα, IL-1α, IL-6 and IL-1β at 1, 12 and 24 h of exposure. The results showed that low doses of clostridial extracts (0.2 to 0.8 mg/ml) are capable of inducing expression of TNF, IL-1α and IL-1β at 1, 12 and 24 h of incubation, whereas higher doses do not exceed the expression of cytokines in unstimulated (control) leukocytes. There was no significant production of IL-6 up to 24 h after exposure to whole extract of C. perfringens. These results indicate that C. perfringens and its toxins at low doses induce activation of circulatory leukocyte in alpacas producing proinflammatory cytokine secretion.
Key words: South American camelids, enterotoxemia, cytokines, real time RT-PCR
INTRODUCCIÓN
La enterotoxemia es la enfermedad infecciosa responsable de las mayores pérdidas económicas que afectan a los productores alpaqueros (Moro, 1987; Ramírez, 1990; Ameghino y DeMartini, 1991). La enterotoxemia, denominada también diarrea bacilar, es una infección aguda ocasionada por el Clostridium perfringens que afecta principalmente a las crías entre la segunda y tercera semana de edad (Ramírez et al., 1985). El cuadro patológico es consecuencia de un evento tóxico primario a nivel intestinal que se deriva en una toxemia generalizada a consecuencia de la acción de las toxinas del C. perfringens tipo A que ocasionan daños irreversibles en el endotelio vascular y el sistema nervioso. Generalmente, estas manifestaciones clínicas transcurren rápidamente y finalizan con la muerte súbita del animal (Novoa y Florez, 1991).
La enfermedad se observa como brotes o epizootias, con mortalidades que pueden alcanzar el 50% de las crías (Ramírez et al.,1985). La presentación de brotes epidémicos de la enfermedad es compleja, producto de las condiciones de manejo y posiblemente de la capacidad inmunológica de la cría, y está determinada por la presencia de los anticuerpos específicos transmitidos por la madre o de la propia respuesta inmune del neonato al agente causal (Ortíz, 1988; Ramírez y Ellis, 1988).
En la prevención de la enterotoxemia se emplean medidas de higiene y de manejo como la adecuada ingestión del calostro dentro de las primeras 12 horas de vida (Ameghino y DeMartini, 1991) y la vacunación. El objetivo de la vacunación es proporcionar una inmunidad efectiva al establecer niveles adecuados de anticuerpos y generar una población programada de células de memoria, capaces de expandirse con rapidez ante un nuevo contacto con el antígeno y de este modo proteger contra la infección (Roitt, 2003).
Las células del sistema inmune secretan cientos de proteínas diferentes que regulan las respuestas inmunes mediante la comunicación entre las células. Estas proteínas son las citoquinas inflamatorias que tienen un rol importante en el desenlace de un proceso infeccioso e inflamatorio (Murtaugh et al., 1996). Las citoquinas IL-1α, IL-1β, IL-6 y TNFα han sido estudiadas en el bovino, porcino, hombre, etc. En la llama, se ha estudiado la liberación de citoquinas proinflamatorias como IL-1α, IL-1β, IL-6 y TNFα por leucocitos sanguíneos periféricos al ser estimulados por el lipopolisacárido (LPS) de E. coli, dosis y tiempo dependiente (Odbileg et al., 2005), pero no existen estudios sobre estas importantes citoquinas en alpacas cuando se estimulan con antígenos de otros agentes bacterianos. El presente estudio tuvo por objetivo determinar los niveles de expresión relativos de las citoquinas IL-1α, IL-1β, IL-6 en los leucocitos sanguíneos circulantes de las alpacas ante la presencia de los antígenos clostridiales.
MATERIALES Y MÉTODOS
Muestras y Preparación de Antígenos Sangre. Se trabajó con 10 alpacas (5 hembras y 5 machos) adultas criadas en confinamiento.
La sangre se obtuvo por venopunción de la vena yugular en tubos de 7 ml con EDTA como anticoagulante.
Antígeno de C. perfringens. Se empleó el extracto completo de C. perfringens obtenido de cinco cepas bacterianas aisladas de crías de alpaca con diagnóstico de enterotoxemia. El extracto fue purificado mediante precipitación con ácido tricloroacético (TCA) y lavado con acetona para eliminar residuos de TCA. La dosis de extracto fue ajustada a 400 μg/ml de proteínas totales empleando el equipo Qubit (Qubit-itTM protein assay kit) (Invitrogen, EEUU). Se hicieron diluciones a partir de los 400 μg/ml de proteínas totales para obtener concentraciones de 80, 16, 0.8 y 0.2 μg/ml.
Obtención de Leucocitos
Los leucocitos se obtuvieron por centrifugación de la sangre entera a 3500 g por 5 min. La capa flogística (leucocitos) fue purificada de glóbulos rojos mediante lavado agregando Buffer Fosfato Salino (PBS) 0.15M a pH 7.2 y centrifugación a 2500 g por 5 min. Se eliminó el sobrenadante, se agregó cloruro de amonio 0.85% frío, homogenizando e incubando en refrigeración a 4 °C por 1 h, y luego se centrifugó a 2500 g por 10 min eliminando el sobrenadante. Los leucocitos se lavaron tres veces con PBS conforme ha sido descrito para eliminar los restos de cloruro de amonio, y finalmente se re-suspendieron en Medio Mínimo Esencial (MEM) libre de antibióticos.
Activación Leucocitaria
Se hizo una incubación previa con colorante vital azul de tripán al 0.3% en proporción 1:2 con los leucocitos suspendidos en MEM para contar las células vivas usando la cámara de Neubauer. Se empleó la fórmula: Número de leucocitos/ml = Promedio de la sumatoria de los 4 cuadrantes x 2 x 10 000 (Darling y Morgan, 1993).
Una vez obtenido el promedio total de células viables, se hicieron diluciones para obtener suspensiones de 500 000 leucocitos/ml. Estas suspensiones se enfrentaron a concentraciones decrecientes de extracto total de C. perfringens (400, 80, 16, 0.8 y 0.2 μg/ml) por 1, 12 y 24 h. Para cada periodo de tiempo se tuvo un control de leucocitos inoculados con suero fisiológico (SF) para evaluar las variaciones normales en la expresión de las citoquinas.
Los enfrentamientos se realizaron en microplacas de poliestireno para cultivo celular de 24 pocillos y bajo incubación a 37 °C con 5% de CO2. Transcurridos los periodos de incubación, las microplacas se extrajeron de la estufa y se separaron las células mediante centrifugación a 3000 g por 10 min. Se volvió a contar los leucocitos después de 1 h de incubación empleando azul de tripán como ha sido descrito anteriormente. La activación leucocitaria se detuvo congelando las suspensiones a -20 °C y se almacenaron a esta temperatura hasta su uso.
Obtención de ARN Total
Las muestras se descongelaron y centrifugaron a 5000 g por 5 min. Al sedimento celular se le agregó el reactivo TRIzol (Invitrogen, EEUU) y se adicionó cloroformo absoluto frío, siguiendo las instrucciones del fabricante. El ARN fue precipitado con alcohol isopropílico frío y lavado con etanol frío al 75%. El ARN total obtenido fue resuspendido en 60 μl de agua libre de nucleasas y congelado a -70 ºC hasta su uso.
Síntesis de ADN Complementario (ADNc) por Transcripción Reversa
Para la transcripción reversa del ARN total obtenido en cada tratamiento se utilizó el kit SuperScript III Platinum® SYBR® Green Two-Step qRT-PCR Kit with ROX (Invitrogen, EEUU), de acuerdo a las instrucciones del fabricante. Se colocó 18 μl del master mix con 2 μl de muestra (ARN total) para obtener un volumen final de reacción de 20 μl. Las muestras fueron llevadas al termociclador PTC 200 (Peltier therme cycler) Chromo 4 de MJ Research-BioRad (EEUU), incubándose a 25 °C por 10 min, 37 ºC por 20 min y 85 °C por 5 min para terminar la reacción. El ADNc obtenido fue congelado a -70 °C hasta su uso en el PCR en tiempo real.
PCR en Tiempo Real
Para el PCR en tiempo real, se empleó el kit SYBR® Green Two-Step qRT-PCR Kit with ROX (Invitrogen, EEUU). Las pruebas fueron realizadas en el mismo termociclador PTC 200 usado para el proceso anterior. Se utilizó el ADNc obtenido, los oligonucleótidos específicos descritos por Obdileg et al. (2005) y oligonucleótidos específicos para la amplificación de GAPDH como control interno endógeno y para su empleo en la cuantificación relativa de expresión (Cuadro 1).
Para la reacción en tiempo real se empleó el kit SuperScript III Platinum® SYBR® Green Two-Step qRT-PCR (Invitrogen, EEUU), de acuerdo a las instrucciones del fabricante. Se colocó 18 μl del master mix en viales para PCR en tiempo real y se adicionaron 2 μl de ADNc templado. Se llevó al termociclador empleándose protocolos de acuerdo a la temperatura de hibridación de cada juego de oligonucleótidos según el Cuadro 1.
Los protocolos de PCR fueron los siguientes:
Para GAPDH (gliceraldehído 3 fosfato deshidrogenasa): 50 ºC por 2 min (incubación con UDG), 95 ºC por 10 min (inactivación UDG y activación de ADN polimerasa), seguido de 40 ciclos de 95 ºC por 15 s y 60 ºC por 1 min. Para las citoquinas TNFα, IL-1α, IL-1β e IL-6: 50 ºC por 2 min (incubación con UDG), 95 ºC por 10 min (inactivación UDG y activación de ADN polimerasa), seguido de 40 ciclos de 94 ºC por 30 s, temperatura de hibridación de cada juego de oligonucleótidos en grados Celsius por 30 s y 72 ºC por 30 s, análisis de temperatura de disociación desde 55 hasta 95 °C, con incrementos de temperatura de 0.3 °C y, finalmente, 14 °C indefinidamente para conservar los productos.
Los resultados fueron evaluados a través del programa Opticon Monitor 2 v. 2.0.3, obteniéndose los valores de Ct (Cycle threshold o ciclo umbral) para su uso en el análisis 2-ΔΔCt como método de cuantificación relativa y el valor de Tm (Temperatura de melting o disociación) de cada uno de los productos para evaluar la especificidad de los productos amplificados. Se hicieron tres repeticiones por tratamiento y por cada citoquina evaluada para obtener los promedios de Ct y Tm de cada uno. Finalmente, todos los productos obtenidos por PCR en tiempo real fueron sometidos a electroforesis en gel de agarosa al 1.5% para evaluar la correspondencia de los productos y su pureza de acuerdo a las longitudes de cada producto descritas, según Obdileg et al. (2005).
Cuantificación Relativa de los Productos del PCR Tiempo Real
La cuantificación relativa de los resultados de las citoquinas TNFα, IL-1α, IL-1β e IL-6 se realizó con el Método 2-ΔΔCt o Método Ct comparativo (Livak y Schmittgen, 2001). El método se basa en el análisis comparativo de los Cts de las muestras comparados con el Ct de un control endógeno (muestras usando el set de oligonucleótidos GAPDH) en relación a una muestra calibrador.
Los resultados son presentados como cantidades en número de veces con respecto a un calibrador (individuo con expresión basal del gen a analizar). De esta forma, se obtuvo los niveles de expresión de las citoquinas TNFα, IL-1α, IL-1β e IL-6, con respecto a un calibrador (control de leucocitos inoculados con SF). Se empleó un calibrador para cada periodo de tiempo evaluado (tres calibradores que consistieron de leucocitos inoculados con SF incubados por 1, 12 y 24 h).
Igualmente, se compararon los niveles de expresión de ARNm de las citoquinas evaluadas bajo la misma concentración de extracto completo pero en diferentes periodos de tiempo para evaluar el cambio de expresión a través del tiempo. Para este efecto, se tomó como calibrador al control de leucocitos con SF con 1 h de incubación como nivel basal de expresión.
Análisis Estadístico
Se calcularon los valores de promedio 2-ΔΔCt por cada tratamiento y tiempo expresándose como número de veces más respecto al calibrador. Mediante un análisis de varianza se determinaron las diferencias estadísticas entre tratamientos por cada periodo y entre los periodos de un mismo tratamiento, y se utilizó la prueba de Tukey para identificar diferencias entre grupos. Se empleó el software Stata/SE v. 10.1.
RESULTADOS
PCR en Tiempo Real del ARNm de GAPDH, TNFα, IL-1α e IL-1β
Todos los tratamientos mostraron la presencia de ARNm de GAPDH por PCR en tiempo real y corroborado en gel de agarosa al 1.5%. Se observó un producto único de aproximadamente 356 pb similar al descrito por Patil et al. (2004). Igualmente, la electroforesis en gel de agarosa al 1.5% de los productos del PCR en tiempo real para TNFα, IL-1α e IL-1β mostraron una banda única y específica de ADN amplificado de aproximadamente 251, 172 y 259 pb, respectivamente, como fuera descrito por Odbileg et al. (2005). No se observaron productos en el PCR de IL-6.
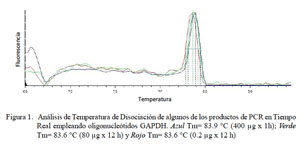
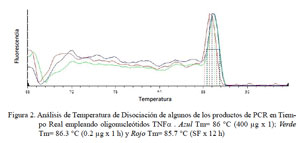
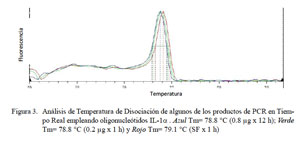
En el PCR en tiempo real de GAPDH, todas las muestras (18/18) amplificaron un producto único y específico con un Ct en un rango de 31.32 a 34.19, con una Tm entre 80.3 y 84.1 °C (Fig. 1). Para TNFα, las curvas de amplificación tuvieron valores de Ct entre 30.1 y 35.3 en todas las muestras y cada muestra expresa un producto único con Tm entre 83.0 a 86.3 °C (Fig. 2). Para el IL-1α, todas las muestras presentaron Ct entre 31.0 a 36.5, con curva de Tm única de los productos dentro de un rango de 78.8 a 79.7 °C (Fig. 3).
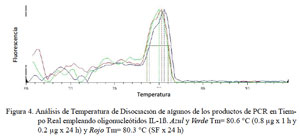
Para IL-1β, todas las muestras presentaron Ct con valores entre 30.6 a 37.3 y su producto único con un Tm en el rango de 79.4 a 80.9 °C (Fig. 4).
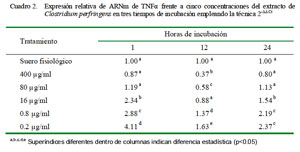
Cuantificación Relativa de TNFα
La cuantificación relativa de la expresión de TNFα a distintas concentraciones y tiempo de incubación se muestra en el Cuadro 2. La dosis de 0.2 μg/ml produjo la mayor cantidad de expresión relativa de TNFα en los tres tiempos de incubación. Asimismo, los niveles de expresión presentaron una curva descendiente dependiente de la dosis, siendo la menor en la concentración de 400 μg/ml a las 12 h de incubación. Los coeficientes de correlación fueron de -0.72, -0.75 y -0.78 para 1, 12 y 24 h de incubación, respectivamente, entre los niveles de expresión de ARNm de TNFα y la concentración de C. perfringens.
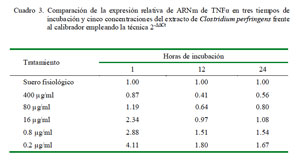
Al comparar la expresión de TNFα en el tiempo de cada tratamiento según la concentración del extracto empleando el calibrador de leucocitos con SF por 1 h de incubación, se observó que todas las dosis a 1 y 24 horas de incubación (excepto la de 400 μg/ml) lograron incrementar la expresión relativa del ARNm de TNFα superando al calibrador. Se observa un decremento de la expresión a las 12 h hasta niveles por debajo del calibrador para las dosis más altas (400 y 80 μg/ml) y ligeramente por encima del calibrador para las dosis más bajas (16, 0.8 y 0.2 μg/ml) (Cuadro 3). El conteo de las células después de 1 h de incubación indicó que solo sobrevivió el 26% de las células iniciales.
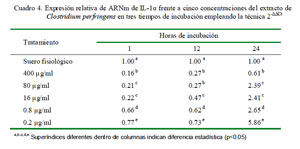
Cuantificación Relativa de IL-1α
La cuantificación relativa de la expresión de IL-1α a distintas concentraciones y tiempos de incubación se muestra en el Cuadro 4. La dosis de 0.2 μg/ml produjo la mayor cantidad de expresión relativa de IL-1α en los tres tiempos de incubación. Asimismo, los niveles de expresión mostraron una curva descendiente dependiente de la concentración del extracto. Además, los niveles de expresión fueron inferiores al control en todas las concentraciones de extracto después de una hora de incubación. Los coeficientes de correlación fueron de -0.58, -0.67 y -0.70 para 1, 12 y 24 h de incubación, respectivamente, entre los niveles de expresión de ARNm de IL-1α y la concentración de C. perfringens.
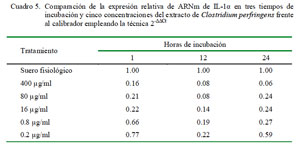
En la cuantificación relativa de IL-1α en diferentes periodos de tiempo bajo la misma concentración del extracto de C. perfringens usando como calibrador al control de leucocitos con suero fisiológico con 1 h de incubación como nivel basal de expresión para todos los tiempos, se determinó que las expresiones para todas las dosis en todos los tiempos no superan al valor del calibrador empleado (Cuadro 5).
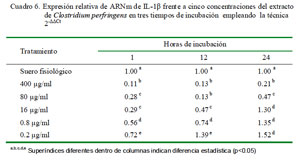
Cuantificación Relativa de IL-1β
La cuantificación relativa de la expresión de IL-1β a distintas concentraciones y tiempo de incubación se detallan en el Cuadro 6. Se determinó que se producen niveles superiores al control únicamente en la concentración de 0.2 μg/ml a las 12 h de incubación y en las concentraciones de 0.2, 0.8 y 16 μg/ml a las 24 h de incubación. La concentración de 0.2 μg/ml produce la mayor cantidad de expresión relativa de IL-1β a los tres tiempos de incubación. Asimismo, los niveles de expresión tienen una curva descendiente dependiente de la concentración de extracto. Los coeficientes de correlación fueron de -0.74, -0.60 y -0.84 para 1, 12 y 24 h de incubación, respectivamente, entre los niveles de expresión de ARNm de IL-1α y la concentración de C. perfringens.
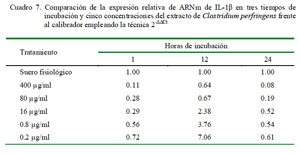
En la cuantificación relativa de IL-1β en diferentes periodos de tiempo bajo la misma concentración del extracto de C. perfringens usando como calibrador al control de leucocitos con suero fisiológico con 1 h de incubación como nivel basal de expresión para todos los tiempos, se observa que a 1 h de incubación la expresión se encuentra por debajo del control en todas las dosis; sin embargo, las expresiones incrementan considerablemente a las 12 h de incubación, superando al valor del control en las dosis más bajas (16, 0.8 y 0.2 μg/ml); no obstante, la expresión decae a las 24 h de incubación llegando a un valor ligeramente por debajo del obtenido a la hora (excepto con la dosis de 16 μg/ml) (Cuadro 7).
DISCUSIÓN
En el presente estudio se determinaron los niveles de expresión de las citoquinas proinflamatorias TNFα, IL-1α y IL-1β en alpacas. Los ARN mensajeros obtenidos tuvieron valores de Tm únicos para cada una de ellas (Fig. 2, Fig 3 y Fig 4). No se detectó la expresión de la IL-6 en las 24 h de evaluación. Leucocitos enfrentados con dosis antigénicas altas como 400, 80 y en algunos casos con 16 μg/ml resultan en bajos niveles de expresión de citoquinas proinflamatorias.
Esto se encuentra asociado a una alta muerte celular a la hora de incubación (promedio de 26% de supervivencia de leucocitos cultivados), siendo uno de los factores de mayor influencia la actividad leucotóxica del extracto (Guillouard et al., 1996). Igualmente, la expresión frente a 80 μg/ml del extracto es muy variable, guardando relación al efecto citotóxico del antígeno clostridial descrito por Guillouard et al. (1996).
Se pudo observar que conforme se reduce la dosis del extracto se detecta más citoquinas con respecto al control por efecto de una mayor cantidad de células viables (Cuadros 2, cuadro 4 y cuadro 6). Sin embargo, las dosis de 0.2 y 0.8 μg/ml expresan una cantidad mayor de citoquinas que las células controles no estimuladas, indicando un efecto dependiente de dosis de extracto total, aunque no se ha determinado la dosis mínima de extracto que estimula a los leucocitos periféricos.
La expresión de citoquinas proinflamatorias en los mamíferos está regulada por señales celulares que son iniciadas por receptores TLR (Toll-Like Receptors) que reconocen moléculas extrañas denominadas patrones moleculares asociados a patógenos (PAMPS) (Mencin et al., 2009). En el extracto de C. perfringens existen estas moléculas que son reconocidas por los leucocitos (principalmente neutrófilos, monocitos, basófilos y eosinófilos), y que en otros mamíferos expresan receptores TLR y NOD (nucleotide-binding oligomerization domain) que reconocen estos PAMPS (Mitchell et al., 2007). Molecularmente, hay diversos tipos de TLR que en otras especies de mamíferos identifican a exotoxinas, ácidos teitoicos y péptidoglucanos de bacterias gram positivas, siendo el TLR2 el que tiene las propiedades de interaccionar con estos patrones (Schwandner et al., 1999). Estas vías deben ser las que estimulan a los leucocitos tratados con el extracto de C. perfringens a la expresión de los genes estudiados.
La cuantificación relativa de las citoquinas TNFα, IL-1α e IL-1β a las 24 h de incubación tiene patrones similares a 1 y 12 horas. Las dosis bajas tuvieron una mayor expresión, lo que parece ser debido a una reducción de la leucotoxicidad por el extracto a las 24 h tal y como ocurre en las intoxicaciones alimentarias en personas donde los malestares no persisten por más de 24 h (Hatheway et al., 1980). La relación de citotoxicidad y concentración del extracto está determinada principalmente por la presencia de muchas exotoxinas que tienen diversas actividades enzimáticas que afectan la integridad de los leucocitos; sin embargo, existen otros mecanismos como la apoptosis en que las bacterias gram positivas pueden inducir a muerte celular. Esto fue demostrado en un ensayo con lipoproteínas bacterianas que inducen a la apoptosis de monocitos sanguíneos por activación celular vía TLR2 (Aliprantis et al., 1999) y vía de la ruta del fosfoinositol 3 quinasa (PI3K) - Akt/PKB (Kobayashi et al., 2003). Los niveles de expresión bajos de TNFα, IL-1α, IL-1β, IL-6 en todas las dosis debe incluir como factor a la apoptosis ya que se ha demostrado que las células polimorfonucleares que entran en apoptosis vía PI3K, regulan negativamente la capacidad de expresar los genes de las citoquinas proinflamatorias (Kobayashi et al., 2003).
Otro punto importante es que cuando se hace una comparación de cada dosis usada contra los tiempos de incubación usando como calibrador al control de leucocitos con SF con 1 h de incubación como nivel basal de expresión, resultan en niveles de expresión diversos para cada citoquina. Las dosis altas como la de 400 μg/ml trae como resultado niveles de expresión bajos de todas las citoquinas, pero para las dosis más bajas se observa un patrón de expresión diferente para cada citoquina. Para TNFα se observa que a la hora de incubación hay producción elevada que supera al control; sin embargo, decae a las 12 h y a las 24 h se observa un ligero aumento de la expresión (Cuadro 3).
Es posible que esta dosis produjera una máxima expresión a la hora de enfrentamiento, disminuyendo gradualmente su producción a las 12 y 24 h debido a un posible «agotamiento » antigénico y de ARNm. Esta molécula no se almacena intracelularmente, por lo que es producida luego de una señalización celular, preferentemente por la vía del NF-κB; además, es una de las primeras citoquinas que se expresan después de una activación de los receptores TLR (Schwandner, 1999; Ferrarini et al., 2008).
Para IL-1α se observa un patrón similar a la hora de incubación destacando que en ninguno de los tratamientos (incluso en las dosis más bajas) se logra superar al control.
Esta reducción se debe a la disminución de células viables y degradación de los ARNm de las células lisadas. También se observa que la expresión se reduce a las 12 h (sobre todo para las dosis más bajas); sin embargo, se puede notar un ligero incremento de la expresión de citoquinas a las 24 h para todos tratamientos excepto para la más alta (400 μg/ml), posiblemente debido a que el efecto leucotóxico del antígeno contenido en el extracto se reduce a las 24 h (Cuadro 5).
Los niveles de expresión de IL-1β a la hora de incubación fue similar al de IL-1α, donde no llegan a superar al control. Las plaquetas no estimuladas, que son anucleadas pero participan secretando citoquinas y eicosanoides, contienen y almacenan ARNm de citoquinas como la IL-1β en su citoplasma asociadas a ribosomas que son traducidas inmediatamente después de un estímulo (Lindemann et al., 2001). Este mecanismo hace cuantificar un buen número de ARNm de esta citoquina en el control celular del experimento, que junto a la citotoxicidad del extracto conduce a escasa cuantificación relativa a la hora. No obstante, a las 12 h ocurre una alta expresión de citoquinas que sobrepasa al control, excepto en las dosis de 400 y 80 μg/ml, que podría deberse a que la transcripción de ARNm que codifica la IL-1β ocurre 15 minutos después de la unión con el ligando, alcanza un pico máximo a las 3 o 4 h, manteniéndose los niveles durante varias horas (Tizard, 2009). Sin embargo, la producción de la citoquina decae a las 24 h por debajo del control (Cuadro 7), probablemente a la reducida duración del ARNm, ya que la vida media de los ARNm en las células de los mamíferos varía desde 30 minutos hasta cerca de 20 h (Cooper, 2004).
Los resultados para IL-6 no fueron obtenidos debido a que posiblemente la incubación no se realizó en los tiempos necesarios para poder detectar su expresión, tal como fue obtenido por Odbileg et al. (2005) en 3 a 6 horas de incubación con LPS de E. coli a dosis de 100 a 1000 pg/ml. En consecuencia, la expresión de las citoquinas siguieron un orden cronológico de expresión, donde el TNFα se produce al principio de la inflamación continuando con oleadas de IL-1 y posteriormente por IL-6 (Tizard, 2009); sin embargo, cabe recordar que el presente estudio fue realizado in vitro.
CONCLUSIONES
-
Los leucocitos de alpaca estimulados por moléculas de C. perfringens expresan citoquinas proinflamatorias de manera secuencial como ocurre en otros mamíferos, siendo primero TNFα y luego IL-1.
-
Los leucocitos sanguíneos de alpacas estimuladas no evidencian producción de IL-6 hasta las 24 horas post exposición a extracto completo de C. perfringens.
-
Dosis bajas de extractos clostridiales (0.2 a 0.8 μg) son capaces de inducir expresiones de citoquinas proinflamatorias en mayor cantidad que dosis antigénicas altas.
LITERATURA CITADA
1. Aliprantis AO, Yang R, Mark MR, Suggett S, Devaux B, Radolf JD, Klimpel GR, et al. 1999. Cell activation and apoptosis by bacterial lipoproteins through Toll-like receptor-2. Science 285: 736-737.
2. Ameghino E, De Martini J. 1991. Mortalidad de crías de alpacas. Programa Colaborativo de Apoyo a la Investigación en Rumiantes Menores. Grant N.° AID/DSAN/XII G0049. p 71-80.
3. Cooper G, Hausman RE. 2004. La célula. 3° ed. Madrid. Ed Marbán. 716 p.
4. Darling D, Morgan S. 1993. Cultivo de células animales. 18° ed. España: Ed Acribia. 159 p.
5. Ferrarini M, Delfanti F, Gianolini M, Rizzi C, Alfano M, Lazzarin A, Biswas P. 2008. NF-κB modulates sensitivity to apoptosis, proinflammatory and migratory potential in short- versus long-term cultured human γδ lymphocytes. J Immunol 181: 5857-5864.
6. Guillouard I, Alzari PM, Saliou B, Cole ST. 1996. Use of site directed mutagenesis to probe structure-function relationships of alpha toxin from Clostridium perfringens. Infect Immunol 64: 2440-2444.
7. Hatheway C, Whaley DN, Dowell VR. 1980. Epidemiological aspects of Clostridium perfringens food borne illness. Food Technol 34(4): 77-79.
8. Kobayashi SD, Voyich JM, Braughton KR, DeLeo FR. 2003. Down-regulation of proinflammatory capacity during apoptosis in human polymorphonuclear leukocytes. J Immunol 170: 3357-3368.
9. Lindemann S, Tolley N, Dixon D, McIntyre T, Prescott SM, Zimmerman GA, Weyrich AS. 2001. Activated platelets mediate inflammatory signaling by regulated interleukin 1 beta synthesis. J Cell Biol 154: 485-490.
10. Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods 25: 402-408.
11. Mencin A, Kluwe J, Schwabe RF. 2009. Toll-like receptors as targets in chronic liver diseases. Gut 58: 704-720.
12. Mitchell JA, Paul-Clark MJ, Clarke GW, McMaster SK, Cartwright N. 2007. Critical role of toll-like receptors and nucleotide oligomerisation domain in the regulation of health and disease. J Endocrinol 193: 323-330.
13. Moro M. 1987. Enfermedades infecciosas de las alpacas. Diarrea bacilar o enterotoxemia de las crías de alpacas. Rev Camélidos Sudam 4: 8-13.
14. Murtaugh MP, Baarsch MJ, Zhou Y, Scamurra RW, Lin G. 1996. Inflammatory cytokines in animal health and disease. Vet Immunol Immunopathol 54: 45-55.
15. Novoa C, Flórez A. 1991. Producción de rumiantes menores: alpacas. Lima: Ed Rerumen. 311 p.
16. Odbileg R, Konnai S, Usui T, Ohashi K, Onuma M. 2005. Quantification of llama inflammatory cytokine mRNAs by Real-Time RT-PCR. J Vet Med Sci 67: 195-198.
17. Ortíz S. 1988. Evaluación de algunos métodos de control de la mortalidad en crías de alpaca (Lama pacos) en explotaciones familiares. Tesis de Bachiller. Lima: Facultad de Medicina Veterinaria, Univ Nacional Mayor de San Marcos. 58 p.
18. Patil A, Hughes A, Zhang G. 2004. Rapid evolution and diversification of mammalian α-defensins as revealed by comparative analysis of rodent and primate genes. Physiol Genomics 20: 1-11.
19. Ramírez A. 1990. Aplicación de la enterotoxina de Clostridium perfringens tipo A en el diagnóstico y control de la enterotoxemia en camélidos sudamericanos. Bol Div UNMSM 33: 11-24.
20. Ramírez A, Huamán D, Ellis RP. 1985. Enterotoxemia de la alpaca. Programa Colaborativo de Apoyo a la Investigación en Rumiantes Menores. Lima: Serie Reporte Técnico 63: 1-17.
21. Ramírez A, Ellis R. 1988. Nuevos conceptos sobre la enterotoxemia y colibacilosis en alpacas. Rev Camélidos Sudam 6: 9-17.
22. Roitt I. 2003. Inmunología Fundamentos. 10° ed. Madrid: Ed Médica Panamericana. 559 p.
23. Schwandner R, Dziarski E, Wesche H, Rothe M, Kirsching CJ. 1999. Peptidoglycan- and lipoteichoic acidinduced cell activation is mediated by Toll-like receptor 2. J Biol Chem 274: 17406-17409.
24. Tizard I. 2009. Inmunología veterinaria. 8° ed. México: McGraw-Hill Interamericana. 574 p.
Recibido: 4 de noviembre de 2012
Aceptado para publicación: 7 de junio de 2013