Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.24 no.4 Lima dez./dic. 2013
Saneamiento y eliminación de la toxicidad de carne de alpaca (Vicugna pacos) con sarcocistiosis mediante ahumado y curado
Sanitation and detoxification of alpaca (Vicugna pacos) meat with sarcocystiosis through smoked and cured
Miguel Vilca L.1,2, Julio Durán O.1, Daphne Ramos D.1, Juan Lucas L.1
1 Laboratorio de Salud Pública y Salud Ambiental, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 E-mail: mvilcal@unmsm.edu.pe
RESUMEN
Se evaluó la capacidad de sanear y eliminar la toxicidad de la carne de alpaca (Vicugna pacos) naturalmente infectada con macroquistes de Sarcocystis aucheniae a través de ahumado en caliente, ahumado en frío, curado húmedo, curado seco, curado húmedo y ahumado, y curado seco y ahumado. Se utilizaron 18 perros de 4-6 meses de edad que consumieron carne (100 macroquistes por animal) previamente tratada con uno de los métodos bajo evaluación. Se prepararon lisados a partir de macroquistes provenientes de carnes tratadas y se inocularon en 18 conejos (100 ìg/kg de peso vivo en forma subcutánea). Asimismo, lisados de macroquistes se sometieron a tratamiento térmico de ebullición (100º C por 10 min) y se inocularon en 8 conejos. Solamente los perros del grupo control y del tratamiento de curado húmedo eliminaron esporoquistes el día 15 post-ingestión. Ninguno de los métodos evaluados logró eliminar la toxicidad de los macroquistes, causando la muerte de los conejos entre las 12 y 27 h post inoculación de los lisados. El tratamiento térmico adicional a los lisados desnaturalizó la proteína de los macroquistes y ninguno de los conejos murió a consecuencia de la inoculación.
Palabras clave: Sarcocystis aucheniae, macroquistes, carne, alpaca, conejo, perro, esporoquiste, ahumado, curado
ABSTRACT
Hot and cold smoked, dry and wet cured, wet-cured and smoked, and dry-cure and smoked techniques for sanitation and detoxification of alpaca meat naturally infected with macrocysts of Sarcocystis aucheniae were evaluated. Eighteen puppies of 4-6 months of age were fed with the infected and treated alpaca meat (100 macrocysts per puppy).
Lysates of macrocysts from treated meats were prepared and inoculated into 18 rabbits (100 μ/kg of body weight, subcutaneously). Furthermore, lysates were boiled (100º C for 10 min) and inoculated into 8 rabbits. Only dogs of the positive control group and the wet cured group eliminated sporocysts after 15 days of ingestion. None of the treatments were able to detoxify alpaca meat infected and rabbits died within 12-27 h post-inoculation of lysates. The heat treatment denatured macrocysts lysates protein and none of the rabbits die after inoculation.
Keys words: Sarcocystis aucheniae , macrocysts, meat, alpaca, rabbit, dog, sporocysts, smoked, cured
INTRODUCCIÓN
La sarcocistosis o sarcosporidiosis es una enfermedad parasitaria producida por un protozoo del Phylum Apicomplexa, clase Sporozoea y género Sarcocystis (Fayer, 2004). El género Sarcocystis posee un ciclo digenético que confía en los actos de carnivorismo para asegurar su paso a nuevos hospederos; es decir, requiere un hospedero definitivo (predador) y uno intermediario (presa). Existen muchas especies que parasitan a los animales de abasto, pero solo dos afectan a las alpacas, S. aucheniae (Sa), que forma macroquistes, y S. lamacanis, que forma microquistes (Guerrero et al., 1967; Leguía et al., 1989). Esta parasitosis es una limitante de la producción alpaquera, pudiendo llegar a causar la muerte de las alpacas (Gorman et al., 1984; Leguía et al., 1990; Chávez et al., 2008).
La sarcocistosis disminuye la productividad de los camélidos sudamericanos mermando una de las principales fuentes proteicas del poblador andino (Chávez et al., 2008) y ocasionando pérdidas económicas por decomisos de canales debido a la presencia de macroquistes (Concha, 1999). Asimismo, el consumo de la carne pobremente cocida e infectada con Sarcocystis ocasiona en el hombre un síndrome de tipo intoxicación alimentaria con trastornos gastroentéricos, causado por la toxina sarcocistina de los quistes (Leguía, 1991; Subercaseaux, 1994; Leguía y Casas, 1999; Moreno, 2003).
Se han evaluado diversas formas de interrumpir el ciclo biológico del parásito, así como técnicas domésticas que permitan sanear y eliminar la toxicidad de la carne volviéndolas apta para consumo. Entre ellas, técnicas culinarias con tratamientos físicos y químicos (Gorman et al., 1984; Euzéby, 1998; Leguía y Arévalo, 1990; Godoy et al., 2007; Granados et al., 2007). El objetivo del presente estudio fue sanear y eliminar la toxicidad de la carne de alpaca naturalmente infectada con macroquistes de Sa mediante el uso de técnicas de ahumado y curado en combinación con tratamientos térmicos.
MATERIALES Y MÉTODOS
Carne Infectada con S. aucheniae La carne infectada con quistes de Sa procedió de seis alpacas de ambos sexos y de 5 años de edad, beneficiadas en el camal de Huancavelica, Perú. La carne de los cuellos (zona corporal con mayor presencia de quistes) se fileteó en 24 porciones de 200 g, de forma y tamaño irregular, pero con cantidades similares de quistes (aproximadamente 100 quistes por porción).
Tratamientos
El trabajo de laboratorio se realizó en la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima.
Las porciones de carne infectada fueron distribuidas al azar en ocho tratamientos:
- T0: Grupo control. Carne cruda fresca no tratada.
- T1: Ahumado caliente por 2 h. La carne se colocó en ahumador accionado con carbón y coronta seca a 70-80 ºC.
- T2: Ahumado caliente por 4 h. Similar al anterior, pero con dos horas más de ahumado.
- T3: Ahumado en frío. La carne se colocó en ahumador a 18-25 ºC por 24 h.
- T4: Curado húmedo. Solución conteniendo 1 kg de sal + 1.3 g de nitrito + 100 g de azúcar en 10 L de agua hervida para cada 2 kg de carne. Se inyectó la carne infectada con la solución y se le sumergió en ella por 20 días en refrigeración. Luego, se extrajo, se lavó y se sumergió en agua fría por 24 h para eliminar las sales.
- T5: Curado seco. La mezcla de 1 kg de sal + 1 g de nitrito + 250 g de azúcar por cada 2 kg de carne se espolvoreó en la carne. La carne tratada se guardó en refrigeración por 20 días; luego se extrajo y se sumergió en agua fría por 24 h para eliminar las sales.
- T6: Curado húmedo y ahumado. Se siguió el procedimiento de T4 y luego se ahumó en caliente por 2 h.
- T7: Curado seco y ahumado. Se siguió el procedimiento de T5 y luego se ahumó en caliente por 2 h.
Cada tratamiento fue aplicado a tres trozos de carne de 200 g, dos de ellos utilizados para evaluar el riesgo de infección y viabilidad y uno para evaluar la toxicidad de la carne después del tratamiento.
Evaluación del Riesgo de Infección Se utilizaron 18 perros cruzados de 4-6 meses de edad de ambos sexos para evaluar la viabilidad de los macroquistes de las carnes tratadas. Los cachorros fueron evaluados clínicamente y estuvieron en cuarentena por 30 días. Se les aplicó una vacuna quíntuple comercial y controló los parásitos internos con Fenbendazol y Praziquantel y los parásitos externos con Fipronil. Posteriormente, 20 días después de la desparasitación, se realizaron exámenes coprológicos para verificar la ausencia de parasitosis. Los animales recibieron un alimento balanceado comercial y agua ad limitum y se les mantuvo libres de contacto con otros animales.
Los cachorros fueron distribuidos al azar en 9 grupos de 2 animales. Los primeros ocho grupos consumieron las porciones de carne después de recibir alguno de los tratamientos (tratamientos T0 a T7), y el último grupo solo consumió alimento comercial (control negativo).
Se tomaron muestras de heces entre el día 9 al 25 post-ingestión para la búsqueda de esporoquistes por el método de flotación con solución saturada de sal.
Evaluación de la Toxicidad de la Carne
Se extrajeron los macroquistes de las carnes tratadas (T0 a T7). Fueron suspendidos en solución salina fosfatada (PBS) 0.15 M (pH 7.2), decantados y machacados en un mortero congelado a -20 ºC. Se agregó 8 ml de PBS al machacado. Esta solución (conteniendo extractos de bradizoitos) fue tamizada con gasa y colocada en un vaso estéril de 10 ml. Finalmente, se lisó las membranas de los bradizoitos por ultrasonido a 60 ciclos/s en 4 intervalos de 60 s y se centrifugó a 12 000 g por 20 min (Sam et al., 1998). Se añadió antibiótico (100 UI de penicilina y 100 mg de estreptomicina) a la solución resultante, se colectó el sobrenadante (inóculo o LMS) y se guardó a -20 ºC. Se midió la concentración de proteínas en un espectofotómetro (Photometro 4010 Manheim Boehringer) a una longitud de onda de 540 nm.
Se utilizaron 26 conejos machos Nueva Zelanda con pesos vivos de 2-2.5 kg. Se les mantuvo en cuarentena por 30 días antes del inicio del experimento, donde recibieron concentrado comercial y agua ad libitum. De estos, 16 conejos (2 por tratamiento) fueron inoculados subcutáneamente con 100 μg de proteína/kg peso vivo, proveniente del LMS.
Esta concentración es el doble de la dosis obtenida por Mansilla (1993) como mínima letal de LMS para conejos. Dos conejos (control negativo) fueron inoculados con 1 ml de suero fisiológico.
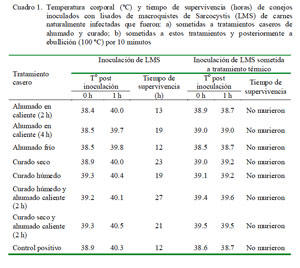
Los lisados de macroquistes obtenidos de las carnes tratadas recibieron un tratamiento térmico adicional, siendo calentadas hasta ebullición (100 ºC por 10 min). Estos lisados con tratamiento térmico fueron inoculados a los 8 conejos restantes (1 conejo por tratamiento). El efecto de la toxicidad se evaluó durante 27 h post-inoculación, registrándose los signos clínicos que presentaron los conejos (hiperemia, postración, pupila contraída, disnea, diarrea). Además, se registró la temperatura rectal previa a la inoculación (0 h) y 1 h post-inoculación. Se realizó la necropsia de los animales muertos, tomándose muestras de hígado, riñón, bazo, corazón, pulmón, cerebro y cerebelo para el estudio histopatológico.
Las muestras fueron fijadas en una solución de formol al 10%, y luego embebidas en parafina, seccionadas y teñidas con hematoxilina y eosina.
RESULTADOS
La viabilidad de los quistes de Sa fue afectada por los tratamientos de ahumado y curado, no observándose presencia de esporoquistes en las heces de los perros que consumieron la carne tratada, excepto en los perros del tratamiento T4 (curado húmedo).
Los perros de este grupo y del T0 (carne sin tratar) eliminaron esporoquistes a partir de los 15 días de la infección. Sin embargo, ninguno presentó signos clínicos que puedan asociarse a la infección de Sarcocystis o al efecto de la toxina del parásito.
Ninguno de los tratamientos inactivó la toxina. Todos los conejos murieron entre las 12 y 27 h de la inoculación, siendo los del grupo T0 los primeros en morir (a las 12 h).
Se presentaron signos clínicos severos sin diferencias entre tratamientos, caracterizándose por postración, disnea, pupila contraída, hipertermia y ligera diarrea. Los resultados histopatológicos evidenciaron lesiones en todos los órganos evaluados tales como congestión, necrosis, alteraciones vasculares y degeneración celular. Los conejos que fueron inoculados con lisados con tratamiento térmico adicional no presentaron signos clínicos ni el efecto letal de la toxina (Cuadro 1).
DISCUSIÓN
Los tratamientos de ahumado y curado, excepto el ahumado en frío, permitieron sanear la carne de alpaca infectada con Sarcocystis interrumpiendo el ciclo biológico del parásito, ya que los perros que ingirieron esta carne no eliminaron esporoquistes en las heces. Estos resultados concuerdan con los obtenidos por Granados et al. (2007).
Es probable que el ahumado en frío (T4) no afectara la viabilidad del macroquiste pues no son las bajas temperaturas las que afectan su viabilidad sino las temperaturas a partir de los 60 ºC (Gorman et al., 1984; Saleque et al., 1990). El periodo prepatente mostrado por los cachorros que consumieron la carne ahumada en frío y la carne sin tratar (T0) fue de 15 días, el cual se encuentra dentro de los 11 a 20 días del rango esperado (Leguía et al., 1989).
La letalidad de la toxina no fue inhibida por los tratamientos efectuados, ya que murieron todos los conejos inoculados con el lisado de macroquistes; sin embargo, Granados et al. (2007) reportan la inactivación de la toxina de los macroquistes mediante los tratamientos de curado seco y ahumado a 60 ºC por 2 h.
El curado seco en pilas incrementa la concentración de sal (aumento de la fuerza iónica), lo que produce un flujo inicial de agua desde las proteínas del músculo hacia el medio, que luego se invierte cuando la sal se difunde al interior, desnaturalizando las proteínas (Heinz y Hautzinger, 2007). Asimismo, esta desnaturalización requiere un tiempo mínimo, el cual está en relación directa al grosor de la porción de carne (Heinz y Hautzinger, 2007). Granados et al. (2007) realizaron un curado seco en pilas, colocando trozos de carne de 0.5 cm de espesor en capas alternas con la mezcla de sales curantes, usando además un contrapeso (durante 10 días de refrigeración) para facilitar el drenaje de líquido desde la carne, manejo que probablemente facilitó la desnaturalización proteica de la toxina. El presente trabajo utilizó el método del espolvoreo sobre un corte de carne de tamaño irregular, el cual probablemente requiera un tiempo mayor de almacenamiento en refrigeración para ejercer su efecto desnaturalizador.
Asimismo, la temperatura y tiempo del ahumado se relacionan con el diámetro de la pieza de carne. Productos gruesos con temperaturas altas (ahumado en caliente) desecan más rápidamente la parte externa, formando una especie de costra o cubierta que evita que su parte interna se deseque y caliente completamente (Marianski et al., 2009).
Es probable que la menor temperatura de ahumado (60 ºC) y el grosor de las porciones de carne (0.5 cm) usados por Granados et al. (2007) hayan facilitado una mejor desnaturalización de las proteínas de los macroquistes. Es probable que la temperatura y desecación interna no haya sido suficiente para desnaturalizar la toxina de los macroquistes en la carne empleada en el presente estudio, dada sus formas y tamaños irregulares.
Los signos de intoxicación observados en los conejos post inoculación del LMS son compatibles con los reportados por otros estudios (Subercaseaux, 1994; Sam et al., 1998; Granados et al., 2007). La sarcocystina tiene actividad neurotóxica y altera las membranas celulares, presentando una excesiva captación de agua y liberando de mediadores inflamatorios que producen hipertermia (Hiepe et al., 1981; Subercaseaux, 1994). Los lisados inoculados causaron la muerte a todos los conejos, con lesiones histopatológicas compatibles con las descritas por Mansilla (1993).
El tratamiento térmico adicional, a 100 ºC por 10 min para los LMS procedentes de carnes tratadas y no tratada desnaturalizó la toxina, resultando no letal al ser inoculada a los conejos. Céspedes et al. (2013) obtuvo resultados similares al realizar tratamientos térmicos complementarios (60 a 135 ºC) a los LMS procedentes de carne de alpaca tratada por métodos físicos y químicos de uso doméstico.
CONCLUSIONES
-
El ahumado en caliente, el curado húmedo y seco, y el curado en combinación con ahumado caliente aplicado a carne de alpaca infectada con Sarcocystis lograron afectar la viabilidad del macroquiste del parásito, mas no así la toxicidad de las proteínas de los macroquistes.
-
El ahumado en frío no afectó la viabilidad de los quistes ni detoxificó la carne infectada con Sarcocystis.
LITERATURA CITADA
1. Céspedes C, Vilca M, Ramos D, Sam R, Lucas J. 2013. Saneamiento y detoxificación de carne de alpaca (Vicugna pacos) con sarcocistiosis mediante tratamientos físicos y químicos (marinado y salazón de uso doméstico). Rev Inv Vet Perú 24: pp-pp.
2. Chávez A, Leyva V, Panez S, Ticona D, García W, Pezo D. 2008. Sarcocistosis y la eficiencia productiva de la alpaca. Rev Inv Vet Perú 19: 160-167.
3. Concha S. 1999. Strategical plan of communication in marketing for the open consumption of alpacas meat in Arequipa-Perú. In: Progress in South American Camelids Research. Göttingen, Germany: The European Association for Animal Production. p 122-131.
4. Euzéby J. 1998. Les parasites des viandes: épidémiologie, physiopathologie, incidences zoonosiques. Paris: Tec & Doc-Lavoisier; Editions Médicales Internationales. 402 p.
5. Fayer R. 2004. Sarcocystis in animal and human infections Clin Microbiol Rev 17: 894-902.
6. Godoy R, Vilca M, Gonzáles A, Leyva V, Sam R. 2007. Saneamiento y detoxificación de carne de llama (Lama glama) infectada con Sarcocystis aucheniae mediante cocción, horneado, fritura y congelado. Rev Inv Vet Perú 18: 51-56.
7. Gorman TR, Alcaíno HA, Muñoz H, Cunazza C.1984. Sarcocystis sp in guanaco (Lama guanicoe) and effect of temperature on its viability. Vet Parasitol 15: 95-101.
8. Granados L, Vilca M, Sam R. 2007. Saneamiento y detoxificación de carne de llama (Lama glama) infectada con Sarcocystis aucheniae mediante métodos químicos: marinado, ahumado, curado seco y curado húmedo. Rev Inv Vet Perú 18: 57-63.
9. Guerrero C, Hernández J, Alva J. 1967. Sarcocystis en alpacas. Rev Fac Med Vet UNMSM 1(2): 69-76.
10. Heinz G, Hautzinger P. 2007. Meat processing technology for small to medium scale producers. FAO Regional Office for Asia and the Pacific. Bangkok. 456 p. [Internet]. Available in: http://www.fao.org/docrep/010/ai407e/ai407e00.htm
11. Hiepe F, Lietzke L, Scheibner G, Jungmann R, Hiepe T, Montag T. 1981. Untersuchungen zur toxischen wirkung von extrankten aus Sarcocystis ovifelis-Macrocysten auf Kanichen. Mh Vet Med 36: 908-910.
12. Leguía G. 1991. The epidemiology and economic impact of llama parasites. Parasitol Today 7: 54-56.
13. Leguía G, Arévalo F. 1990. Efecto de la cocción, refrigeración, congelación y deshidratación (charqui) sobre la viabilidad del Sarcocystis de alpacas. MV Rev Cienc Vet 6(1): 19-28.
14. Leguía G, Casas E. 1999. Enfermedades parasitarias y atlas parasitológico de camélidos sudamericanos. Lima: Ed. De Mar. 190 p.
15. Leguía G, Guerrero C, Sam R, Chávez A. 1989. Infección experimental de perros y gatos con micro y macroquistes de Sarcocystis de alpacas (Lama pacos). MV Rev Cienc Vet 5(3): 10-13.
16. Leguía G, Guerrero C, Sam R, Rosadio R. 1990. Patología de Sarcocystis aucheniae en alpacas infectadas experimentalmente. MV Rev Cienc Vet 6(3): 11-13.
17. Mansilla D. 1993. Efecto histopatológico del lisado de macroquistes de Sarcocystis aucheniae en ratones, conejos y cobayos. Tesis de Médico Veterinario. Lima: Univ Nacional Mayor de San Marcos. 60 p.
18. Marianski S, Marianski A, Marianski R. 2009. Meat smoking and smokehouse design. USA: Bookmagic LLC. 316 p.
19. Moreno M. 2003. Higiene e inspección de carnes 2. Madrid: Díaz de Santos. 593 p.
20. Saleque A, Juyal P, Bhatia B. 1990. Effect of temperature on the infectivity of Sarcocystis miescheriana cysts in pork. Vet Parasitol 36: 343-346.
21. Sam R, Mansilla I, Morales C, Ramírez A. 1998. Efecto tóxico de macroquistes de Sarcocystis aucheniae en ratones, cobayos y conejos. Rev Inv Pec IVITA 9(2): 11-18.
22. Subercaseaux P. 1994. Sarcocystis spp in human and domestic animals. Int J Parasitol 18: 821-827.
Recibido: 12 de octubre de 2012
Aceptado para publicación: 18 de abril de 2013