Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.25 no.1 Lima 2014
ARTÍCULOS PRIMARIOS
Descripción anatomopatológica de lesiones por helmintos gastrointestinales en tortugas motelo (Chelonoidis denticulata)
Anatomopathological description of lesions of gastrointestinal helminths in motelo tortoises (Chelonoidis denticulata)
Rosa Julca R.1, Eva Casas A.1,5, Alfonso Chavera C.2, Lidia Sánchez P.3, Nofre Sánchez P.4, Luis Batalla L.4
1 Laboratorio de Microbiología y Parasitología Veterinaria,
2 Laboratorio de Histología, Embriología y Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
3 Departamento de Protozoología, Helmintología e Invertebrados Afines, Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Lima, Perú
4 Estación Experimental del Centro de Investigación IVITA-Iquitos, Universidad Nacional Mayor de San Marcos, Iquitos, Perú
5 E-mail: evacasas99@gmail.com
RESUMEN
El trabajo tuvo por objetivo identificar y describir las lesiones ocasionadas por helmintos en tortugas motelo (Chelonoidis denticulata). Se colectaron 40 tractos gastrointestinales de tortugas en el mercado de Belén, Iquitos, Perú, donde esta especie es comercializada como carne de consumo. El análisis macroscópico mostró que el 42.5, 70.0 y 100% de los estómagos, intestino delgado e intestino grueso, respectivamente, se encontraban parasitados o presentaban cambios patológicos de posible origen parasitario como nódulos, áreas de coloración negruzca, úlceras, perforaciones, engrosamiento, congestión y focos hemorrágicos. Se identificaron 11 especies de helmintos: Labiduris gulosa, Labiduris zschokkei, Labiduris irineuta, Atractis marquezi, Klossinemella travassosi, Sauricola sauricola, Chapiniella variabilis, Angusticaecum holopterum y Ophidascaris arndti (Nematoda), y Halltrema avitellina y Helicotrema spirale (Trematoda). Histológicamente, se evidenció la invasión de las cuatro túnicas gastrointestinales por estructuras parasitarias compatibles con H. avitellina (y sus huevos), C. variabilis, S. sauricola y una especie no determinada de atractídeo, rodeadas principalmente por exudados inflamatorios compuestos de eosinófilos, células gigantes, linfocitos y tejido conjuntivo. Asimismo, se observó la presencia de infiltrado eosinofílico en la mucosa como respuesta al contacto con O. arndti y H. spirale. Los resultados indican que todos los individuos presentaron lesiones parasitarias en intestino grueso, siendo la mayoría de grado severo, mientras que las lesiones en estómago e intestino delgado fueron mayormente de grado moderado y leve.
Palabras clave: Chelonoidis denticulata, tracto gastrointestinal, helmintos, lesiones
ABSTRACT
The present aimed to identify and describe lesions caused by helminths in motelo tortoises (Chelonoidis denticulata). Forty gastrointestinal tracts were collected at Belen market in Iquitos, Peru where this species is sold for meat consumption. The macroscopic analysis showed that 42.5, 70.0, and 100% of the stomachs, small intestine and large intestine respectively were parasitized or affected by pathological –possibly due to parasites–changes like nodules, blackish coloration areas, ulcers, perforations, thickening, congestion and hemorrhagic areas. Parasites of 11 species were collected: Labiduris gulosa, Labiduris zschokkei, Labiduris irineuta, Atractis marquezi, Klossinemella travassosi, Sauricola sauricola, Chapiniella variabilis, Angusticaecum holopterum and Ophidascaris arndti (Nematoda), and Halltrema avitellina and Helicotrema spirale (Trematoda). Histologically, an invasion of the four gastrointestinal layers by parasitic structures compatible with H. avitellina (and its eggs), C. variabilis, S. sauricola and un undetermined species of atractideus was observed mostly surrounded by inflammatory exudates formed by eosinophiles, giant cells, lymphocytes and connective tissue. Also, the presence of eosinophilic infiltrate in the mucosa was found as a response to the contact with O. arndti and H. spirale. The results showed that all animals presented parasitic lesions in the large intestine, most of them severe; whereas lesions in stomach and small intestine were mainly moderate and mild.
Key words: Chelonoidis denticulata, gastrointestinal tract, helminths, lesions
INTRODUCCIÓN
Chelonoidis denticulata, llamada anteriormente Geochelone denticulata, es conocida como «tortuga motelo» y es una de las cuatro especies de Testudíneos que se encuentran distribuidas en América del Sur. Se les considera como hospedadoras de algunos agentes potencialmente patógenos, entre ellos, los helmintos gastrointestinales con prevalencias de 94 y 100% en tortugas terrestres (Tittoto et al., 2006; Martínez, 2007).
En el caso de C. denticulata se han reportado 11 especies de nematodos: Labiduris gulosa, L. zschokkei, L. irineuta, Atractis impura, A. thapari, Klossinemella travassosi, Sauricola sauricola, Chapiniella variabilis, C. larensis, C. diazi y Angusticaecum holopterum (Petter, 1966; Díaz-Hungría y Gallardo, 1968; Sarmiento et al., 1999; Salizar y Sánchez, 2007; Muniz-Pereira et al., 2009); dos especies de trematodos: Halltrema avitellina y Helicotrema spirale (Vega, 2008; Muniz-Pereira et al., 2009) y una especie de cestodo: Ophiotaenia lopesi (Muniz-Pereira et al., 2009). De igual modo, se han reportado lesiones gastrointestinales por nematodos en las tortugas G. carbonaria, G. pardalis y Apalone spinifera pallida (Rideout et al., 1987; McAllister et al., 1993).
Roca (1999) y Martínez (2007) señalan que los nematodos gastrointestinales actúan como mutualistas de las tortugas, rompiendo el equilibrio en situaciones de estrés, ocasionando la aparición de signos clínicos. Asimismo, diversos autores señalan que tanto los trematodos como los cestodos tienen un papel poco patogénico en el tubo digestivo de las tortugas terrestres, sucediendo lo contrario con las tortugas marinas (Jacobson, 1986; Greiner y Schumacher, 1998; Mitchell y Tully, 2009).
Dada la escasa información sobre la severidad de las lesiones que estos agentes puedan producir en las tortugas, este estudio buscó identificar las especies de helmintos en tortugas motelo (Chelonoidis denticulata), así como realizar la descripción macroscópica y microscópica de las lesiones ocasionadas a nivel del tracto gastrointestinal.
MATERIALES Y MÉTODOS
Lugar de Estudio
Las tortugas se muestrearon en el mercado de abastos del distrito de Belén, ciudad de Iquitos, departamento de Loreto, Perú. La ciudad de Iquitos se encuentra en latitud 3º77´14" y longitud 73º27´46", a 106 msnm, con temperaturas de 20 a 36 °C, humedad de 68 a 93% y precipitaciones anuales de 2000 a 3000 mm. El procesamiento de las muestras se realizó en los laboratorios de la Estación Experimental del Centro de Investigación IVITA de la ciudad de Iquitos, en el Laboratorio de Histología, Embriología y Patología Veterinaria de la Facultad de Medicina Veterinaria (FMV) y el Laboratorio de Protozoología, Helmintología e Invertebrados Afines del Museo de Historia Natural, ambos en Lima, y pertenecientes a la Universidad Nacional Mayor de San Marcos (UNMSM).
Animales y Muestras
Las tortugas procedían de diversas zonas del departamento de Loreto, donde eran capturadas y trasladadas al mercado de Belén, Iquitos, para la comercialización de su carne. Los comerciantes facilitaron los tractos gastrointestinales (desde el cardias hasta el recto).
Las vísceras fueron colocadas en bolsas de plástico dentro de depósitos refrigerantes y transportadas a los laboratorios del IVITA-Iquitos. En total, se colectaron 40 tractos digestivos, independientemente de la edad y sexo de las tortugas, entre noviembre y diciembre de 2009.
Procesamiento de las Muestras
Los tractos gastrointestinales fueron separados por regiones (estómago, intestino delgado e intestino grueso) mediante cortes transversales. Luego, se practicaron cortes longitudinales para exponer su contenido, el cual se extrajo lavando cada pieza digestiva con suero fisiológico.
Los helmintos fueron colocados en bolsas herméticas conteniendo alcohol de 70º para su fijación. Posteriormente, fueron revisados bajo el estereoscopio, separados de acuerdo a su morfología y contados por localización y hospedador. Los trematodos fueron coloreados con Carmín acético de Semichon, decolorados en alcohol ácido al 2% y deshidratados en una batería de alcoholes (80º, 90º y 100º), mientras que la diafanización
se realizó con esencia de clavo de olor y el montaje en bálsamo de Canadá. Los nematodos se aclararon con lactofenol de Amann o alcohol-fenol. La observación de los helmintos se hizo con ayuda de un microscopio compuesto con objetivos de 10x y 40x, debidamente calibrados. Para la identificación se utilizó claves para trematodos (Travassos et al., 1969) y nematodos de reptiles (Vicente et al., 1993), además de reportes de la literatura (Costa, 1961; Alho, 1965; Costa et al., 1968; Freitas, 1968; Sprent, 1980; Bursey y Flanagan, 2002).
Los 40 tractos gastrointestinales fueron cuidadosamente examinados buscando cambios anatómicos. Solo se tomaron secciones de órganos con alteraciones y con presencia de parásitos sin lesiones aparentes, colocándolos en frascos con formol al 10% (17 estómagos, 28 intestinos delgados y 40 intestinos gruesos). Se hicieron ocho cortes por órgano y se procesaron según las indicaciones sugeridas por Welsch y Sobotta (2009). La tinción se hizo con Hematoxilina-Eosina y la lectura se hizo con microscopio provisto de ocular micrométrico.
Valoración de las Lesiones Gastrointestinales
- El infiltrado eosinofílico, granulomas y tejido conjuntivo, por ser consecuencia del contacto directo o penetración de los parásitos en los tejidos, fueron consideradas como lesiones de origen parasitario.
- El infiltrado linfocítico, al ser causado también por otros agentes, se consideró una lesión no necesariamente parasitaria.
- El edema, linfangiectasia y extravasación eritrocítica, por desarrollarse como consecuencia de la existencia de las lesiones de origen parasitario, se denominaron lesiones secundarias a las parasitarias.
- La congestión de los vasos sanguíneos, por ser fisiológica (en estómago e intestino delgado) y patológica secundaria a inflamación u obstrucción (en intestino grueso), y la hiperplasia epitelial, por ser producto de un proceso adaptativo patológico crónico a agentes infecciosos o al material ingerido, se denominaron cambios fisiopatológicos que podrían indicar lesión.
Análisis de Datos
Los helmintos se agruparon de acuerdo a su clasificación científica. Además, se consideró el número de especies, carga parasitaria por órgano y por hospedador. Las cargas parasitarias se calificaron según el número de helmintos por animal como mínima (de 1 a 100), moderada (mayores de 100 y menores de 500) y abundante (mayores de 500).
Para establecer el número de individuos que conformaban las cargas parasitarias mayores de 7000 y compuestas por gran variedad de especies en el intestino grueso, fue necesario separar a los nematodos menores de 15 mm a fin de pesarlos en conjunto para determinar el número de individuos de cada especie por gramo de peso y luego multiplicarlo por el peso total del conjunto.
Los tractos digestivos fueron clasificados de acuerdo a la presencia o ausencia de parásitos por tracto y por región gastrointestinal, considerándose la frecuencia de alteraciones macroscópicas y microscópicas. Así mismo, de acuerdo a su relación con los parásitos, las alteraciones microscópicas se caracterizaron en cuatro tipos: lesiones ocasionadas por parásitos, lesiones no necesariamente parasitarias (que pueden ser causadas por otros agentes), lesiones secundarias a las de origen parasitario, y cambios fisiológicos que podrían indicar lesión.
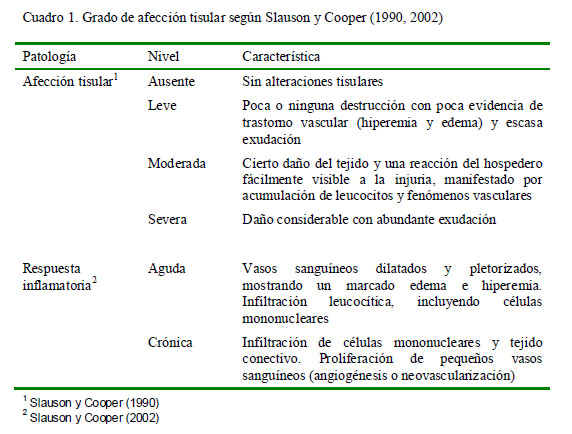
El grado de afección tisular y respuesta tisular se determinó según la clasificación de Slauson y Cooper (1990, 2002) (Cuadro 1).
Para la identificación de los parásitos en los cortes histológicos, se comparó su morfología con aquellas en las especies encontradas en el lumen y con microfotografías de trabajos similares (Rideout et al., 1987; Glazebrook y Campbell, 1990; Cordero-Tapia et al., 2004; Mihalca et al., 2007). Así mismo, los helmintos extraídos mediante el
corte de algunas las lesiones macroscópicas fueron examinados microscópicamente.
RESULTADOS
El estudio parasitológico de los 40 tractos gastrointestinales reveló que 39 (97.5%) presentaron parásitos en el intestino grueso, 22 (55.0%) en el intestino delgado y 7 (17.5%) a nivel de estómago. Asimismo, las cargas parasitarias en intestino grueso fueron de moderadas a abundantes (164 a 258 120), en intestino delgado de mínimas a moderadas (1 a 478) y mínimas en estómago (1 a 3 helmintos por animal).
Se identificaron 11 especies de helmintos (9 nematodos, 2 trematodos y ningún cestodo). Los nematodos identificados fueron Labiduris gulosa (Rudolphi, 1819), L. zschokkei (Linstow 1899), L. irineuta (Costa, 1961), Atractis marquezi (Bursey y Flanagan, 2002), Klossinemella travassosi (Costa, 1961), Sauricola sauricola (Chapin,
1924), Chapiniella variabilis (Chapin, 1924), Angusticaecum holopterum (Chapin, 1924) y Ophidascaris arndti (Sprehn, 1929), mientras que los trematodos digeneos fueron Halltrema avitellina (Lent y Freitas, 1939) y Helicotrema spirale (Diesing, 1850).
Los nematodos L. gulosa, L. zschokkei y O. arndti fueron comunes para las tres regiones digestivas y las únicas especies encontradas en estómago. Asimismo, con excepción de H. spirale y K. travassosi encontrados únicamente en el intestino delgado y grueso, respectivamente, las especies restantes fueron comunes para ambos intestinos.
En el examen macroscópico se hallaron principalmente estructuras nodulares, pequeñas prominencias, áreas de coloración negruzca en las cuatro túnicas, úlceras, focos hemorrágicos, erosiones, engrosamiento de la mucosa, congestión y digeneos atravesando la serosa. Así mismo, todos los tractos digestivos presentaron alteraciones en el intestino grueso, mientras que solo la mitad y la tercera parte de los intestinos delgados y estómagos presentaron alteraciones evidentes.
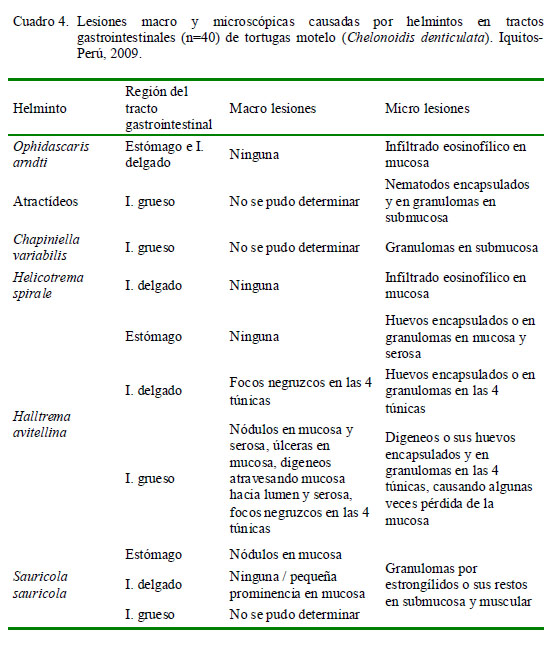
Las estructuras nodulares se localizaron en la mucosa, submucosa y capa muscular del estómago y mayormente del intestino grueso. En un solo caso se observó áreas negruzcas formadas por la aglomeración de focos diminutos de color café en las cuatro túnicas de ambos intestinos, correspondiendo a un animal de pobre condición corporal. En general, las úlceras, focos hemorrágicos, engrosamiento de la mucosa y los nódulos y digeneos atravesando la serosa se hallaron únicamente en el intestino grueso. Histológicamente, estas lesiones correspondieron a granulomas y estructuras parasitarias encapsuladas en las capas gastrointestinales. La presencia de infiltrados compuestos por granulocitos eosinofílicos (acidófilos), linfocitos y eritrocitos, distribuidos de manera difusa o focal, y en ocasiones de linfangiectasia, edema y congestión, estuvo relacionada con estos hallazgos.
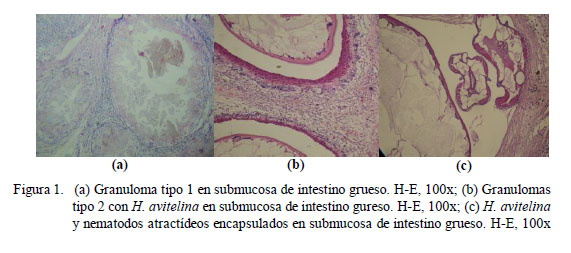
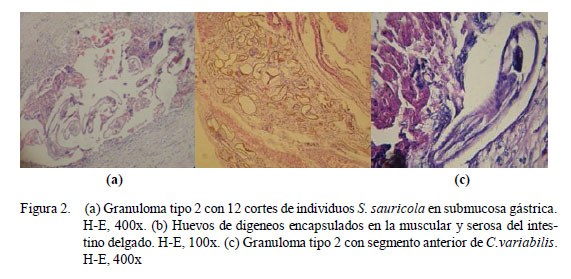
Los granulomas observados fueron de dos tipos: el granuloma propiamente dicho, el cual será referido como Tipo 1 (Fig. 1) y el granuloma eosinofílico, que será referido como Tipo 2 (Fig. 2). El granuloma Tipo 1 estuvo formado por una capa interna de tejido conjuntivo, células gigantes y macrófagos y, con frecuencia, con una capa externa de linfocitos y tejido conjuntivo. El granuloma Tipo 2 estuvo constituido por una capa interna de acidófilos, una capa media de células gigantes y, con frecuencia, de macrófagos, linfocitos, y una capa externa de tejido conjuntivo. Además, se encontró granulomas de una sola capa, en la que se entremezclaban macrófagos, acidófilos y fibras de tejido conjuntivo. Los granulomas de tipo 2 del intestino grueso fueron los más grandes (8.6 x1.2 mm).
Los granulomas presentaron focos de necrosis y contenido variado. Se encontraron helmintos estrongílidos (S. sauricola y C. variabilis) en granulomas en todo el tracto, atractídeos y digeneos paramphistómidos (H. avitellina) en intestino grueso, así como restos de estructuras parasitarias (huevos de digeneos, trozos de cutícula y fragmentos de nematodos) y espacios vacíos. El hallazgo de helmintos en granulomas Tipo 1 fue escaso. La morfología y estructuras (cutícula y sistema digestivo) observadas en los cortes de nematodos clasificados como atractídeos, mostraron características compatibles tanto con el género Labiduris como Atractis, sin poderse determinar a cuál de ellos pertenecía. Así mismo, los restos de cutícula mayormente coincidieron en apariencia y dimensiones con pequeñas placas circulares quitinosas desprendidas de los fragmentos de una larva de S. sauricola extraída de uno de los nódulos gástricos. Los huevos fueron compatibles con aquellos contenidos en los oviductos de los digeneos H. avitellina hallados en los tejidos; sin embargo, es posible que algunos de estos hallados en la mucosa gastrointestinal pertenezcan a H. spirale. Por otro lado, todas estas estructuras, al encontrarse en los tejidos en ausencia de células gigantes próximas, rodeadas o no por tejido conjuntivo, acidófilos, linfocitos o macrófagos, se denominaron estructuras parasitarias encapsuladas. Tanto estas como los granulomas se hallaron compuestas mayormente por más de un parásito, habiendo en un caso 21 segmentos de nematodos atractídeos en intestino grueso.
Mucosas congestionadas fueron observadas en las tres regiones gastrointestinales, pero especialmente en intestino grueso. Histológicamente, congestión y edema de la submucosa en el intestino grueso se hallaron próximas a las lesiones parasitarias. Similarmente, la linfangiectasia relacionada a este tipo de lesiones se observó solo en estómago e intestino grueso, mientras que la hiperplasia epitelial afectó únicamente a los intestinos delgado y grueso.
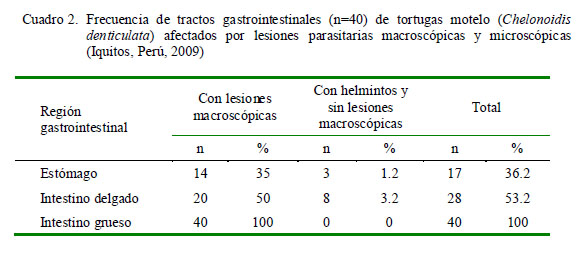
En el Cuadro 2 se resumen los resultados de la valoración de las lesiones gastrointestinales a nivel macroscópico. El 36.2, 53.2 y 100% de los estómagos, intestinos delgados e intestinos gruesos, respectivamente, presentaron parásitos o lesiones macroscópicas causadas por parásitos.
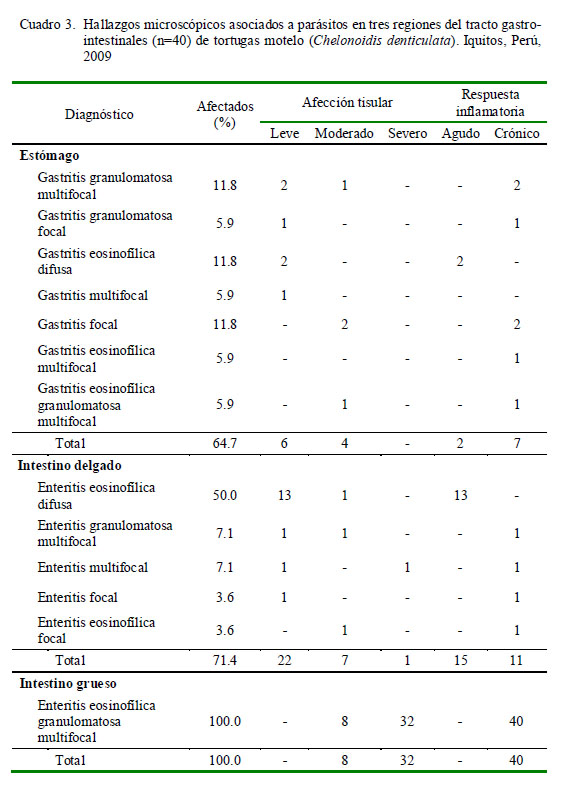
El patrón de lesiones parasitarias a nivel histopatológico fue muy variado en el estómago e intestino delgado en comparación con el intestino grueso. Los 40 especímenes evidenciaron una enteritis eosinofílica granulomatosa multifocal a nivel de intestino grueso, contrastando con los siete y cinco diagnósticos obtenidos en estómago e intestino delgado, respectivamente. En contraste, a nivel de intestino delgado se observó una mayor frecuencia de enteritis eosinofílica difusa aguda y a nivel de estómago fueron varios los tipos de lesiones predominantes (Cuadro 3). Asimismo, lesiones de tipo leve predominaron a nivel de estómago e intestino delgado, en tanto lesiones de tipo severo fueron observadas en intestino grueso (Cuadro 3).
Se examinaron microscópicamente 14 tractos gastrointestinales completos, de los cuales el 42.9% (6/14) presentó gastroenteritis parasitarias. Asimismo, se examinaron microscópicamente 28 tractos intestinales completos, de los cuales el 71.4% (20/28) evidenció enteritis parasitarias en ambas regiones intestinales.
El Cuadro 4 muestra el tipo de lesiones en el tracto gastrointestinal según el parásito encontrado. En cortes histológicos donde se observó la presencia de atractídeos, S. sauricola, C. variabilis y H. avitellina y en hallazgos microscópicos en regiones gastrointestinales parasitados por H. spirale u O. arndti se pudo demostrar que estas especies ocasionan lesiones microscópicas. Sin embargo, a nivel macroscópico solo se pudo observar lesiones ocasionadas por H. avitellina y S. sauricola debido a sus dimensiones. Al parecer, el gran número y extensión de las lesiones causadas por H. avitellina, así como el engrosamiento de la mucosa del intestino grueso, podrían estar escondiendo lesiones de menor tamaño ocasionadas por otras especies parasitarias, las cuales sí se observaron microscópicamente.
DISCUSIÓN
Labiduris irineuta y Klossinemella travassosi han sido reportados en Brasil en Chelonoidis denticulata, pero constituyen nuevos registros de helmintos para el Perú. Por otro lado, Atractis marquezi y Ophidascaris arndti constituyen nuevos registros para Chelonoidis denticulata como hospedador.
Las cargas parasitarias y la riqueza de especies de helmintos, especialmente en la región del intestino grueso concuerdan con investigaciones realizadas sobre la helmintofauna en tortugas terrestres. Petter (1966), Iverson (1982) y Roca (1999) demuestran que es precisamente la última porción del tracto digestivo de estos reptiles donde se establecen habitualmente infecciones masivas de nematodos, debido al microhábitat existente con grandes cantidades de alimento no digerido; sin embargo, se ha observado en este trabajo que algunas especies prefieren colonizar el estómago (O. arndti) o el intestino delgado (H. spirale y A. holopterum).
Estructuras nodulares debidas a granulomas causados por S. sauricola en estómago se asemejan a los nódulos ocasionados por parásitos estrongílidos en serpientes (Mihalca et al., 2007); mientras que los nódulos hallados en el intestino grueso correspondieron a granulomas causados por el trematodo H. avitellina, lo cual discrepa con otros estudios que otorgan un papel poco patogénico a los trematodes (Greiner y Schumacher, 1998; Mitchell y Tully, 2009). No obstante, ambos hallazgos coinciden con la afirmación de que los parásitos causan grandes masas granulomatosas en los reptiles (Merck, 2008).
Los granulomas por huevos de trematodos en intestinos han sido reportados en tortugas marinas (Glazebrook y Campbell, 1990; Cordero-Tapia et al., 2004), donde la magnitud de la respuesta inflamatoria, constituida por células gigantes y linfocitos, se encuentra relacionada al grado de infección, sea esta desde leve (2-3 huevos) hasta severa (20-50 huevos). En el presente estudio, sin embargo, las reacciones hacia los huevos de trematodos consistieron en acidófilos, linfocitos, células gigantes y fibras de tejido conjuntivo.
El hallazgo de trematodos H. avitellina encapsulados en la serosa del intestino grueso con salida hacia la cavidad abdominal y el de sus larvas dentro de vasos sanguíneos de la misma túnica, serían indicios de una posible migración hacia otros órganos. En tortugas marinas se han observado trematodos invadiendo músculos, corazón, hígado, riñón, etc (Glazebrook y Campbell, 1990; Cordero-Tapia et al., 2004), pero esto no sucedió con H. spirale en la tortura motelo, ya que solo ocasionó la formación de infiltrado eosinofílico en mucosa y submucosa del intestino delgado, posiblemente alrededor de los sitios de adhesión del parásito.
En serpientes se han reportado úlceras (Vaz, 1935) y nódulos fibrosos en los sitios de adhesión de helmintos del género Ophidascaris (Sprent, 1970; Ambrose et al., 1999), pero en este estudio no se observaron lesiones relacionadas a O. arndti e incluso la mayoría de ejemplares fueron hallados libres sobre la mucosa, encontrándose únicamente un leve infiltrado eosinofílico a nivel histológico. Posiblemente, la ausencia de lesiones se deba al bajo número de ejemplares presentes, infecciones recientes o que el hospedador no sea el habitual.
El hallazgo histológico de S. sauricola y C. variabilis en las túnicas gastrointestinales coincide con Urquhart et al. (2001), quienes manifiestan que las larvas de los estrongílidos que parasitan a los equinos penetran la mucosa, migrando a submucosa o muscular donde forman nódulos, los cuales al romperse liberan a las larvas hacia la luz
intestinal.
Los granulomas con atractídeos fueron hallados con menor frecuencia que los granulomas de estrongílidos. Los cortes de estos nematodos se asemejaban a los cortes histológicos de las lesiones ocasionadas por Proatractis spp en intestino grueso de G. carbonaria (Rideout et al., 1987), debido a que pertenecen a la misma familia. Además, no se descarta que la presencia de Labiduris spp, Atractis marquezi y Klossinemella travassosi en el lumen ocasione o contribuya a exacerbar reacciones inflamatorias tisulares.
McAllister et al. (1993) y Mihalca et al. (2007) clasificaron a los granulomas de acuerdo a su estado de madurez en dos tipos: los granulomas recién formados, rodeados por un gran infiltrado eosinofílico, que contienen a la larva intacta; y los granulomas maduros, rodeados mayormente por una cápsula fibrosa y por un mínimo o inexistente infiltrado eosinofílico, que contienen a la larva degenerada o en degeneración. De acuerdo a ello, los granulomas eosinofílicos (primer tipo) son lesiones recientes que con el tiempo se degradan junto con su contenido, transformándose eventualmente en granulomas maduros.
Según Lenzi et al. (1998), la encapsulación de los huevos de Schistosoma por células mononucleares, con presencia o ausencia de producción de fibra, es una fase pre-granulomatosa, la cual es seguida por diversas fases de maduración hasta finalizar con la desintegración, en la cual el granuloma se encoje, la inflamación decrece y predomina la degradación. Es probable que en reptiles suceda lo mismo; y de ser así, los helmintos y restos de estructuras parasitarias intactas, rodeados por acidófilos, linfocitos y tejido conjuntivo serían futuros granulomas, mientras que los restos de parásitos y los focos de necrosis caseosa rodeados por tejido conjuntivo
o de algunas células inflamatorias en proceso de necrosis serían lesiones antiguas.
El infiltrado eosinofílico, de acuerdo a los hallazgos en C. denticulata, además de estar relacionado de manera proporcional al grado de madurez de las lesiones y a su ubicación en las túnicas gastrointestinales, también se relaciona directamente a la cantidad de helmintos presentes, lo que puede verse al comparar la severidad del infiltrado eosinofílico en intestino grueso con la del intestino delgado y estómago. De acuerdo a Montali (1988) y Soldati et al. (2004), quienes afirman que la diferenciación de heterófilos y eosinófilos al corte histológico no es confiable debido a que el procesamiento del tejido deforma los gránulos citoplasmáticos, los granulocitos eosinofílicos que conformaban tanto este infiltrado como el granuloma Tipo 2, se denominaron acidófilos, concordando con diversos patólogos (Stacy y Pessier, 2007). Por otro lado, el infiltrado linfocitario que rodea a los granulomas y estructuras parasitarias encapsuladas, coincide con los hallazgos de Rideout et al. (1987) y McAllister et al. (1993) en otros Testudíneos.
El epitelio gastrointestinal fue afectado por acción exfoliativa, causando la pérdida de porciones del mismo, y por hiperplasia. La pérdida epitelial por exfoliación puede deberse a los parásitos presentes, a otros agentes y a la degradación y manipulación del órgano. Por otro lado, según Trigo y Mateos (1993), la hiperplasia epitelial es una adaptación del crecimiento celular posiblemente como respuesta al contacto con el alimento grosero que consumen estas tortugas, o debido a infecciones por helmintos, protozoarios y otros agentes.
El edema observado en la proximidad de los granulomas coincide con las lesiones que acompañaban a los focos de nematodos Proatractis spp rodeados por células inflamatorias reportadas por Rideout et al. (1987). Según Trigo y Mateos (1993) y Guyton y Hall (2001), los granulomas ejercen presión sobre los vasos linfáticos, ocasionando la obstrucción de la circulación linfática, por consiguiente las proteínas plasmáticas que se escapan al intersticio elevan la presión coloidosmótica del líquido intersticial, acumulándose líquido en los espacios intersticiales. Además, la liberación de sustancias que aumentan la porosidad capilar por las células inflamatorias halladas en intestino grueso puede ocasionar la salida de grandes cantidades de líquidos a la circulación de los tejidos, con aparición de edema. Tanto el edema como la hiperplasia epitelial y las grandes reacciones inflamatorias en las diferentes túnicas pueden ser responsables del engrosamiento de la mucosa del intestino grueso.
Una causa de congestión de los vasos sanguíneos es la hiperemia fisiológica debido al aumento del metabolismo gastrointestinal (Trigo y Mateos, 1993; Guyton y Hall, 2001). Probablemente, esto sucedió en la mucosa de los estómagos e intestinos delgados que evidenciaron lesiones leves o ausentes.
Si bien algunos investigadores consideran como no patogénicos a los helmintos que parasitan a las tortugas de vida libre, el presente trabajo demuestra que tanto nematodos como trematodos digeneos son capaces de causar lesiones gastrointestinales en estos animales, independientemente de la presencia de signos clínicos evidentes. Sin embargo, no se puede descartar la influencia de otros agentes patógenos y el estrés generado por la estación del año (época de crecida del río donde la disponibilidad de refugio y de alimento se ven disminuidas), captura y posterior traslado a los centros urbanos.
CONCLUSIONES
· Los helmintos Labiduris irineuta y Klossinemella travassosi son nuevos registros para el Perú, mientras que Atractis marquezi y Ophidascaris arndti constituyen nuevos reportes para Chelonoidis denticulata.
· Halltrema avitellina, Labiduris spp, Sauricola sauricola y una especie no determinada de la familia Atractidae penetran los tejidos gastrointestinales induciendo la formación de granulomas, infiltrado eosinofílico y linfocítico, y tejido conjuntivo.
· El infiltrado eosinofílico es la única respuesta inflamatoria claramente observada a la presencia de Helicotrema spirale y Ophidascaris arndti.
· El hallazgo macroscópico de nódulos, úlceras y áreas de coloración negruzca en el tracto digestivo corresponde a lesiones granulomatosas parasitarias, cuya presencia ocasiona el desarrollo de lesiones secundarias como congestión, hemorragia, linfangiectasia y edema.
· La túnica submucosa del intestino grueso es la región del tracto gastrointestinal afectada con mayor frecuencia por lesiones parasitarias de grado severo.
LITERATURA CITADA
1. Alho CJR. 1965. Contribuição ao conhecimento da fauna helmintológica de quelonios do estado do Pará, Brasil. Bol Mus Paraense Emilio Goeldi 58: 1-13. [ Links ]
2. Ambrose DL, Little SE, Latimer KS. 1999. Ophidascaris in a reticulated python (Python reticulatus). Proc International Virtual Conferences in Veterinary Medicine. Diseases of reptiles and amphibians. [Internet], [3 mayo
2011]. Available in: http://www.vet.uga.edu/vpp/archives/ivcvm/1999/ambrose/index.php [ Links ]
3. Bursey CR, Flanagan JP. 2002. Atractis marquezi n.sp. (Nematoda: Atractidae) and a revision of Atractis Dujardin, 1845, Sensu Baker, 1987. J. Parasitol 88: 320-324. [ Links ]
4. Cordero-Tapia A, Gardner SC, Arellano-Blanco J, Inohuye-Rivera RB. 2004. Learedius learedi infection in black turtles (Chelonia mydas agassizii), Baja California Sur, México. J Parasitol 90: 645-647. [ Links ]
5. Costa SCG. 1961. Nota prévia sobre um novo nematódeo do gênero Labiduris Schneider, 1866 (Atractoidea). Atas Soc Biol Rio J 4: 17-18. [ Links ]
6. Costa SCG, Motta CS, Gomes DC. 1968. Revisão do gênero Klossinemella Costa, 1961 (Nematoda, Cobboldinidae), com descrição de uma nova subfamília e de uma nova espécie. Mem Inst Oswaldo Cruz 66: 169-179. [ Links ]
7. Díaz-Hungria C, Gallardo M. 1968. Nematodes de reptiles venezolanos con descripción de varias especies nuevas. Bol Soc Venez Cienc Nat: 550-570. [ Links ]
8. Freitas JFT. 1968. Revisão do gênero Ophidascaris Baylis, 1921 (Nematoda: Ascaridoidea). Mem Inst Oswaldo Cruz 66: 1-78. [ Links ]
9. Glazebrook J, Campbell R. 1990. A survey of the diseases of marine turtles in northern Australia. II. Oceanariumreared and wild turtles. Dis Aquat Org 1: 97-104. [ Links ]
10. Greiner EC, Schumacher J. 1998. Parasitology. In: Ackerman L (ed). The biology, husbandry and health care of reptiles. Vol III. New Jersey, USA: TFH Publications. p 689-672. [ Links ]
11. Guyton AC, Hall JE. 2001. Tratado de fisiología médica. X ed. Madrid: Interamericana McGraw-Hill. 1279 p. [ Links ]
12. Iverson JB. 1982. Adaptations to herbivore in iguanine lizards. In: Iguanas of the world: their behavior, ecology and conservation. New York, USA: Noyes Publ. p 60-76. [ Links ]
13. Jacobson ER. 1986. Parasitic diseases of reptiles. In: Fowler ME (ed). Zoo and wild animal medicine. Washington, USA: Ed Saunders. p 162-181. [ Links ]
14. Lenzi HL, Kimmel E, Schechtman H, Pelajo-Machado M, Romanha WS, Pacheco RG. 1998. Histoarchitecture
of Schistosomal granuloma development and involution: morphogenetic and biomechanical approaches. Mem Inst
Oswaldo Cruz 93: 141-151. [ Links ]
15. Martínez A. 2007. Parásitos digestivos en reptiles. Argos, Informativo veterinario 88: 48. [Internet], [15 febrero 2009]. Disponible en: http://www.ucm.es/BUCM/compludoc/S/10705/B17820765_1.htm [ Links ]
16. McAllister CT, Goldberg SR, Holshuh HJ. 1993. Spiroxys contorta (Nematoda: Spirurida) in gastric granulomas of Apalone spinifera pallid (Reptilia: Testudines). J Wildlife Dis 29: 509-511. [ Links ]
17. Merck. 2008. The Merck veterinary manual. 9th ed. New Jersey, USA. [Internet], [17 enero 2009]. Disponible
en: http://www.merckvetmanual.com/mvm/index.jsp?cfile=htm/present/mvm_about.htm [ Links ]
18. Mihalca A, Fictum P, Skoric M, Sloboda M, Kärvemo S, Ghira I, et al. 2007. Severe granulomatous lesions in
several organs from Eustrongylides larvae in a free-ranging dice snake, Natrix tessellata. Vet Pathol 44: 103-105. [ Links ]
19. Mitchell M, Tully T. 2009. Manual of exotic pet practice. Missouri, USA: Saunders Elsevier. 560 p. [ Links ]
20. Montali RJ. 1988. Comparative pathology of inflammation in the higher vertebrates (reptiles, birds and
mammals). J Comp Path 99: 1-26. [ Links ]
21. Muniz-Pereira LC, Vieira FM, Luque JL. 2009. Checklist of helminth parasites of threatened vertebrate species from Brazil. Zootaxa 2123: 1-45. [ Links ]
22. Petter AJ. 1966. Equilibre des especes dans les populations the nematodes parasites du colon des tortues terrestres. Mem Mus Nat Hist Ser A Zool 39: 1-252. [ Links ]
23. Rideout BA, Montali RJ, Phillips LG, Gardiner CH. 1987. Mortality of captive tortoises due to viviparous nematodes of the genus Proatractis (Family Atractidae). J Wildlife Dis 23: 103-108. [ Links ]
24. Roca V. 1999. Relación entre las faunas endoparásitas de reptiles y su tipo de alimentación. Rev Esp Herp 13(1): 101-121. [ Links ]
25. Salizar P, Sánchez L. 2007. Nuevos registros de nematodos en dos especies de tortugas (Reptilia: Testudines) en el Perú. Neotrop Helmintol 1: 43-45. [ Links ]
26. Sarmiento L, Tantaleán M, Huiza A. 1999. Nematodos parásitos del hombre y de los animales en el Perú. Rev Per Parasitol 14: 9-65. [ Links ]
27. Slauson D, Cooper B. 1990. Mechanisms of disease. A textbook of comparative general pathology. 2nd ed.
Baltimore, Maryland, USA: Williams & Wilkins. 560 p. [ Links ]
28. Slauson D, Cooper B. 2002. Mechanisms of disease. A textbook of comparative general pathology. 3rd ed.
St Louise, Missouri, USA: Williams & Wilkins. 430 p. [ Links ]
29. Soldati G, Lu ZH, Vaughan L, Polkinghorne A, Zimmerman DR, Huder JB, Pospischil A. 2004. Detection of Mycobacteria and Chlamydiae in granulomatous inflammation of reptiles: A retrospective study. Vet Pathol 41: 388-397. [ Links ]
30. Sprent JFA. 1970. Studies on ascaridoid nematodes in pythons: the life-history and development of Ophidascaris moreliae in Australian pythons. Parasitology 60: 97-122. [ Links ]
31. Sprent JFA. 1980. Ascaridoid nematodes of amphibians and reptiles: Angusticaecum and Krefftascaris n.g.
J Helminthol 54: 55-73. [ Links ]
32. Stacy BA, Pessier AP. 2007. Host response to infectious agents and identification of pathogens in tissue section. In: Jacobson ER (ed). Infectious diseases and pathology of reptiles. Color atlas and text. Boca Ratón, USA: CRC Press. p 257-270. [ Links ]
33. Tittoto de Oliveira R, Vicente A, Santos M. 2006. Endoparasitas em Jabutis (Geochelone carbonaria e Geochelone denticulata) em cativerio. [Internet], [31 mayo 2009]. Disponible en: http://www.propp.ufu.br/revistaelectronica/edicao2005/vida2005/endoparasitas.pdf [ Links ]
34. Travassos L, Freitas JFT, Kohn A. 1969. Trematódeos do Brasil. Mem Inst Oswaldo Cruz 67: 1-886. [ Links ]
35. Trigo F, Mateos A. 1993. Patología general veterinaria. 2° ed. México DF: Interamericana McGraw-Hill. 420 p. [ Links ]
36. Urquhart GM, Armour J, Duncan JL, Dunn AM, Jennings FW. 2001. Parasitología veterinaria. 2° ed. Zaragoza:
Acribia. 354 p. [ Links ]
37. Vaz Z. 1935. Lesões producidas no estomago de cobras por um novo nematoide - Ophidascaris trichuriformis
sp. Arch Inst Biol, Sao Paulo 6(4): 41-48. [ Links ]
38. Vega J. 2008. Identificación de helmintos en tortuga motelo (Geochelone denticulata), mediante estudios
coproparasitológicos, provenientes de la comercialización en el Mercado de Belén- Iquitos. Tesis de Médico Veterinario. Lima, Perú: Univ Nacional Mayor de San Marcos. 54 p. [ Links ]
39. Vicente J, Oliveira H, Corrêa D, Magalhâes R. 1993. Nematoides do Brasil. Parte III: Nematóides de Repteis.
Rev Bras Zool 10(1): 19-168. [ Links ]
40. Welsch U, Sobotta J. 2009. Histología. 2° ed. España: Médica Panamericana. 677 p. [ Links ]
Recibido: 30 de marzo de 2012
Aceptado para publicación: 26 de octubre de 2013