Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.25 no.1 Lima 2014
ARTÍCULOS PRIMARIOS
Seroprevalencia de anticuerpos anti-Toxoplasma gondii en alpacas de un centro de crianza de Cusco, Perú
Seroprevalence of antibodies against Toxoplasma gondii in alpacas of a breeding centre in Cusco, Peru
José Angulo T.1,4, Gina Casas 2, Raquel Watanabe W. 1, Danilo Pezo C.3, Enrique Serrano-Martínez 2
1 Escuela de Posgrado, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 Laboratorio de Parasitología, Facultad de Veterinaria y Zootecnia, Universidad Peruana Cayetano Heredia, Lima
3 Estación Experimental del Centro de Investigación IVITA-Maranganí, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Cusco
4 E-mail: jangulot@yahoo.es
RESUMEN
El objetivo del presente estudio fue determinar la seroprevalencia de anticuerpos anti-Toxoplasma gondii en alpacas de un centro de crianza de la provincia de Canchis, Cusco, Perú, mediante la técnica de inmunofluorescencia indirecta (IFI), empleando un punto de corte de 1:200. Se recolectaron 318 muestras de sangre de alpacas hembras de 1 a 13 años de edad. La seroprevalencia fue de 25.8 ± 4.8% (82/318). De los 82 sueros positivos, el 62.2% presentó títulos de 1:200. Los resultados obtenidos ratifican la presencia de anticuerpos específicos frente al T. gondii en alpacas de Cusco.
Palabras clave: Toxoplasma gondii, seroprevalencia, camélidos sudamericanos, inmunofluorescencia indirecta, IFI
ABSTRACT
The aim of this study was to determine the seroprevalence of anti-Toxoplasma gondii antibodies in alpacas of a breeding centre in the province of Canchis, Cusco, Peru, by the indirect inmunofluorescence technique (IFAT) using a cut off of 1:200. A total of 318 blood samples were collected from female alpacas. The seroprevalence was of 25.8 ± 4.8% (82/318). Out of 82 positive sera, 62.2% showed titres of 1:200. The results confirm the presence of specific anti-T. gondii antibodies in alpacas in Cusco
Key words: Toxoplasma gondii, seroprevalence, South American camelids, immunofluorescence antibody test, IFAT
INTRODUCCIÓN
La alpaca (Vicugna pacos) constituye el mayor capital pecuario para los pobladores altoandinos, representando el principal recurso económico para este sector; sin embargo, los productores se ven seriamente afectados por la presencia de diversos problemas sanitarios, dentro de ellos, los causados por agentes infecciosos y parasitarios (Ameghino y DeMartini, 1991; Franco et al., 1998; FAO, 2005; Pinto et al., 2010). Los problemas sanitarios ocasionan disminución de la calidad y producción de fibra, carne y leche (Guerrero y Leguía, 1987; Guerrero et al., 1994), además de afectar la fertilidad, natalidad y supervivencia embrionaria.
Toxoplasma gondii se encuentra asociado a problemas reproductivos como abortos, momificación de fetos y mortinatos, así como nacimiento de crías débiles (Ramírez, 1991; Acha y Szyfres, 2003); siendo, además, considerado causal de enfermedad zoonótica (Acha y Szyfres, 2003), afectando principalmente a personas con sistema inmunológico comprometido (Martín-Hernández y García-Izquierdo, 2003).
T. gondii afecta a mamíferos y aves, incluyendo los camélidos sudamericanos (Leguía et al., 1988; Jarvinen et al., 1999; Suárez et al., 2004). Su ciclo biológico presenta una etapa de tipo sexual en félidos que permite la eliminación de ooquistes esporulados infectivos al medio ambiente, y una segunda fase de tipo asexual en el hospedador intermediario, que ocurre con la ingestión de ooquistes esporulados o bradizoitos contenidos en quistes tisulares, que se diseminan en diversos órganos causando destrucción celular (Dubey, 2010). En el diagnóstico de este parásito se emplean las técnicas Dye test, Hemoaglutinación indirecta (HAI), Aglutinación directa, ELISA, Inmunoabsorción-aglutinación e Inmunofluorescencia indirecta (IFI), además de PCR (Innes y Esteban-Redondo, 1997; Dubey, 2010).
Se han reportado 36.0, 36.5 y 8.5% de anticuerpos contra T. gondii en alpacas en los departamentos de Cusco, Huancavelica y Junín, respectivamente (Ramírez et al., 2005; Valencia et al., 2009; De La Cruz et al., 2011), y de 37% en llamas en Puno (Loayza et al., 2011) y de 6.5 a 14% en Junín (Chang et al., 2009). No obstante, debido al
empleo de diversas técnicas empleadas como HAI e IFI que presentan diferentes niveles de sensibilidad y especificidad, así como por los medios de diseminación del parásito, se hace necesario determinar la situación actual
de esta parasitosis en alpacas con la finalidad de establecer programas de manejo sanitario para la prevención y control de este parásito. En consecuencia, el objetivo del presente estudio fue determinar la prevalencia de anticuerpos específicos frente a T. gondii en alpacas de una zona de la provincia de Canchis, departamento de Cusco, Perú, mediante la técnica de IFI.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en el Centro de Investigación de Camélidos Sudamericanos (CICAS) La Raya, localizado en la provincia de Canchis, departamento de Cusco. La zona se encuentra ubicada a 4200 metros de altitud, y posee una temperatura media anual de 6 °C con una precipitación media anual de 120 mm (CONAM, 2005). Las
alpacas son criadas de manera extensiva sobre pasturas naturales.
Se realizó un muestreo de tipo aleatorio en alpacas hembras de 1 a 13 años de edad, de raza Huacaya. Para el cálculo del tamaño muestral, se empleó la fórmula de comprobación de una proporción para población finita (Daniel, 1996), utilizando una prevalencia de 35.7% reportada en alpacas de comunidades de la zona (Ramírez et al., 2005). El tamaño de muestra fue de 318 alpacas.
Se tomaron muestras de sangre en tubos estériles al vacío sin anticoagulante mediante punción de la vena yugular, con agujas 21 x 1½”. La sangre fue centrifugada a 1700 g por 3 min y los sueros resultantes se guardaron en congelación (-20 ºC) hasta su procesamiento en el Laboratorio de Parasitología de la Facultad de Veterinaria y Zootecnia de la Universidad Peruana Cayetano Heredia, Lima.
Las muestras fueron analizadas mediante la técnica de IFI para detectar anticuerpos frente a T. gondii, con una dilución de suero de 1:200 (Chávez et al., 2005). Se consideraron como positivos a animales con título de anticuerpos igual o mayor a dicha dilución y con una fluorescencia total. Además, se hizo la titulación de anticuerpos en los sueros positivos, según Chávez et al. (2005).
Los resultados fueron resumidos en forma porcentual con un intervalo de confianza de 95% (Thrusfield, 1990).
RESULTADOS Y DISCUSIÓN
La seroprevalencia de T. gondii en alpacas fue de 25.8 ± 4.8% (82/318), considerándose de nivel moderado. Estudios previos en la zona reportaron prevalencias de 34 a 36% (Suárez et al., 2004; Ramírez et al., 2005), utilizando la técnica de IFI y una dilución de 1/50. Esta prueba diagnóstica tiene una elevada sensibilidad (99%) y especificidad (100%) (Ovalle et al., 2000).
La presencia de esta enfermedad se ve favorecida por una gamma de factores. Entre estos, la crianza extensiva y el estrés en el manejo durante las faenas de campo como esquila y dosificaciones que conllevan a un estado de inmunosupresión (Leguía y Casas, 1999; Tizard, 2009), así como la interrelación de hospederos definitivos (félidos silvestres) y hospederos intermediarios (ovinos y camélidos sudamericanos, entre otros) propios de la zona que favorecen el desarrollo del ciclo de vida de T. gondii (Poma et al., 2008; Dubey, 2010).
Otros factores que condicionarían la presencia de T. gondii serían la temperatura y la humedad (Ramírez et al., 2005), que permiten que el ooquiste infectivo perdure en el medio ambiente (Poma et al., 2008); así como la altitud de la zona alpaquera (4200 msnm), toda vez que se han demostrado seroprevalencias menores frente a este parásito en altitudes superiores a los 4000 metros de altitud (Gómez et al., 2003). Por otro lado, la distancia entre las zonas de pastoreo y los centros poblados puede influir de forma distinta en la presentación del parásito. La cercanía a zonas habitadas aumenta la presencia de felinos domésticos (Saravia et al., 2004; Marcas et al., 2004; Valencia et al., 2009; De La Cruz et al., 2011), mientras que la lejanía a centros poblados favorece la presencia de felinos silvestres (Pastor et al., 2003; Cossíos et al., 2007; Poma et al., 2008).
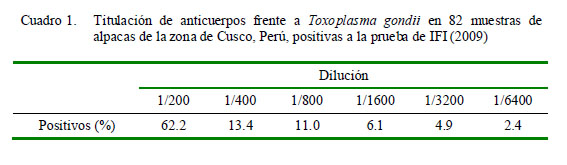
En la titulación de anticuerpos contra T. gondii, se observó que 11 de los 82 animales seropositivos tuvieron una titulación mayor a 1:800 (Cuadro 1), con lo cual se presume que pueden haber estado atravesando una etapa aguda, de reactivación o de reinfección de la enfermedad. Esta situación podría estar ocasionando problemas de tipo reproductivo, como sucede en otras especies (ovinos, caprinos) (Acha y Szyfres, 2003). Asimismo, en el estudio realizado por Dzitko et al. (2006) se encontró una elevación en el título de anticuerpos frente a una reinfección por T. gondii.
CONCLUSIONES
· La seroprevalencia de T. gondii en alpacas de la provincia de Canchis, Cusco, fue moderada (25.8 ± 4.8%).
LITERATURA CITADA
1. Acha P, Szyfres B. 2003. Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. 3° ed. Lima: OPS. Publicación Científica y Técnica. 385 p. [ Links ]
2. Ameghino E, DeMartini J. 1991. El aspecto sanitario en alpacas y ovinos de las comunidades del departamento de
Puno. Lima: IVITA-UNMSM. 89 p. [ Links ]
3. [CONAM] Consejo Nacional del Ambiente - Perú. 2005. Indicadores ambientales Cusco. Lima: Biblioteca Nacional
del Perú. 8 p. [ Links ]
4. Cossíos D, Madrid A, Condori J, Fajardo U. 2007. Update on the distribution of the Andean cat Oreailurus jacobita and the pampas cat Lynchailurus colocolo in Peru. Endang Species Res 3: 313-320. [ Links ]
5. Chang K, Chávez A, Lí O, Falcón N, Casas E, Casas G. 2009. Seroprevalencia de Toxoplasma gondii en llamas hembras de la sierra central del Perú. Rev Inv Vet Perú 20: 306-311. [ Links ]
6. Chávez-Velásquez A, Álvarez-García G, Gómez-Bautista M, Casas-Astos E, Serrano-Martínez E, Ortega-Mora L.
2005. Toxoplasma gondii in adult llamas (Lama glama) and vicunas (Vicugna vicugna) in the Peruvian Andean region. Vet Parasitol 130: 93-97. [ Links ]
7. Daniel W. 1996. Bioestadística: base para el análisis de las ciencias de la salud. 3° ed. México: Limusa. 501 p. [ Links ]
8. De La Cruz H, Chávez A, Casas E, Lí O. 2011. Seroprevalencia de Toxoplasma gondii en alpacas hembras de la SAIS Pachacutec, Sierra Central del Perú. Rev Inv Vet Perú 22: 35-38. [ Links ]
9. Dubey JP .2010. Toxoplasmosis of animals and humans. 2nd ed. New York: Taylor & Francis Group. 336 p. [ Links ]
10. Dzitko K, Staczek P, Gatkowska J, Dlugonska H. 2006. Toxoplasma gondii: serological recognition of reinfection. Exp Parasitol 112: 134-137. [ Links ]
11. [FAO] Food and Agriculture Organization of the United Nations. 2005. Situación actual de los camélidos sudamericanos en Perú. Proyecto de cooperación técnica en apoyo a la crianza y aprovechamiento de los camélidos sudamericanos en la región andina. Lima: FAO. 63 p. [ Links ]
12. Franco E, García W, Pezo D. 1998. Manual de crianza de llamas. Pub Téc FMV Perú N.º 33. Lima: UNMSM. 42 p. [ Links ]
13. Guerrero C, Leguía G. 1987. Enfermedades infecciosas y parasitarias de las alpacas. Rev Camélidos Sudam 4: 32-82. [ Links ]
14. Guerrero O, Chinchilla M, Catarinella G, Castro A, Abrahams E. 1994. Patrón de tránsito intestinal de los ooquistes de Toxoplasma gondii en rata, ratón y hamster. Parasitol Día 18: 71-76. [ Links ]
15. Gómez F, Chávez A, Casas E, Serrano E, Cárdenas O. 2003. Determinación de la seroprevalencia de toxoplasmosis en alpacas y llamas en la estación experimental INIA-Puno. Rev Inv Vet Perú 14: 49-53. [ Links ]
16. Innes EA, Esteban-Redondo MI. 1997. Diagnóstico. En: Ortega L (ed). Tratado de patología y producción ovina.
Cap 3. Madrid: Ed. Luzán. p 51-56. [ Links ]
17. Jarvinen J, Dubey J, Althouset C. 1999. Clinical and serologic evaluation of two llamas (Lama glama) infected with Toxoplasma gondii during gestation. J Parasitol 85: 142-144. [ Links ]
18. Leguía G, Samamé H, Guerrero C, Rojas M, Núñez A. 1988. Prevalencia de anticuerpos contra Toxoplasma gondii en alpacas. Rev Camel Sud 6: 19-22. [ Links ]
19. Leguía G, Casas E. 1999. Enfermedades parasitarias y atlas parasitológico de camélidos sudamericanos. Lima: Ed de Mar. 190 p. [ Links ]
20. Loayza E, Casas E, Chávez A, Coronado L, Venturini C. 2011. Evaluación de Toxoplasma gondii en llamas hembras de dos comunidades campesinas de la región Puno. Rev Inv Vet Perú 22: 239-243. [ Links ]
21. Marcas G, Chávez A, Casas E, García W, Falcón N. 2004. Seroprevalencia de Toxoplasma gondii en llamas de dos
fundos ganaderos de la provincia de Melgar, Puno. Rev Inv Vet Perú 15: 44-48. [ Links ]
22. Martín-Hernández I, García-Izquierdo S. 2003. Toxoplasmosis en el hombre. Bioquímica 28: 19-27. [ Links ]
23. Ovalle F, García A, Thibauth A. 2000. Frecuencia de anticuerpos anti Toxoplasma gondii en gatos de la ciudad
de Valdivia, Chile. Bol Chil Parasitol 55: 94-99. [ Links ]
24. Pastor J, Chávez A, Casas E, Serrano E. 2003. Seroprevalencia de Toxoplasma gondii en vicuñas de Puno. Rev
Inv Vet Perú 14: 79-82. [ Links ]
25. Pinto C, Martín C, Cid M. 2010. Camélidos sudamericanos: clasificación, origen y características. RCCV 4: 23-36. [ Links ]
26. Poma E, Chávez A, Casas E, Falcón N, Zárate D. 2008. Seroprevalencia de Toxoplasma gondii en alpacas (Lama
pacos) en una unidad de producción de la sierra central del Perú. Rev Inv Vet Perú 19: 43-48. [ Links ]
27. Ramírez A. 1991. Enfermedades infecciosas. En: Fernández-Baca S (ed). Avances y perspectivas del conocimiento de los camélidos sudamericanos. Santiago de Chile: FAO. p 334-337. [ Links ]
28. Ramírez J, Chávez A, Casas E, Rosadio R, Falcón N. 2005. Seroprevalencia de Toxoplasma gondii en alpacas de comunidades de la provincia de Canchis, Cusco. Rev Inv Vet Perú 16: 169-174. [ Links ]
29. Saravia M, Chávez A, Casas E, Falcón N, Pinto W. 2004. Seroprevalencia de Toxoplasma gondii en llamas de una
empresa pecuaria en Melgar, Puno. Rev Inv Vet Perú 15: 49-55. [ Links ]
30. Suárez F, Flórez W, Chávez A, Rivera H, Huanca W. 2004. Toxoplasmosis en alpacas de la sierra altoandina. Rev Inv Vet Perú 15: 170-173. [ Links ]
31. Thrusfield M. 1990. Epidemiología veterinaria. España: Acribia. 339 p. [ Links ]
32. Tizard I. 2009. Inmunología veterinaria. 8° ed. Barcelona: Elsevier. 574 p. [ Links ]
33. Valencia N, Chávez A, García M, Suárez F, Casas E. 2009. Toxoplasmosis como agente causal de abortos en alpacas Rev Inv Vet Perú 20: 312-319. [ Links ]
Recibido: 15 de abril de 2013
Aceptado para publicación:16 de setiembre de 2013