Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.25 no.1 Lima 2014
ARTÍCULOS PRIMARIOS
Frecuencia de Toxoplasma gondii Y Neospora caninum en vicuñas (Vicugna vicugna) de la sierra central peruana mediante las técnicas de inmunofluorescencia indirecta y ELISA indirecta
Frequency of Toxoplasma gondii and Neospora caninum in vicuñas (Vicugna vicugna) of the peruvian central sierra by the immunofluorescence indirect (IFI) and indirect ELISA techniques
Karen Pinedo R.1, Amanda Chávez V.1,3, Hermelinda Rivera G.1, Rosa Pinedo V.1, Francisco Suárez A.2
1 Laboratorio de Microbiología y Parasitología Veterinaria,
2 Laboratorio de Medicina Veterinaria Preventiva, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
3 E-mail: achavezvg@gmail.com
RESUMEN
El objetivo del estudio fue determinar la seroprevalencia de Toxoplasma gondii y Neospora caninum en vicuñas de la provincia de la zona de Yauli, Junín, así como determinar el grado de concordancia entre las pruebas de inmunofluorescencia indirecta (IFI) y ELISA indirecta. Se recolectaron 79 muestras de sangre durante un «Chaku». Las frecuencias halladas para T. gondii fueron de 5.1 y 3.1% mediante las pruebas de ELISA indirecta e IFI, respectivamente, no encontrándose reacción seropositiva para N. caninum. Se encontró un valor de kappa de 0.85, pero el escaso número de muestras positivas impide inferir que la concordancia entre ambas pruebas sea buena.
Palabras clave: Toxoplasma gondii, Neospora caninum, vicuña, inmunofluorescencia indirecta, ELISA indirecta
ABSTRACT
The objective of this study was to estimate the frequency of antibodies against Toxoplasma gondii and Neospora caninum in vicuñas in the Yauli province, Junín, Peru, and to determine the degree of concordance between the indirect immunofluorescence (IFA) and indirect ELISA test. A total of 79 blood samples were obtained during a «Chaku» (rodeo). The results showed a frequency of antibodies against T. gondii of 5.1 and 3.1% for indirect ELISA and IFA respectively, whereas none of the samples were positive to N. caninum. The kappa value was 0.85, but the small number of positive samples does not allowed inferring that the degree of concordance between the two test was good.
Key words: Toxoplasma gondii, Neospora caninum, vicuña, indirect immunofluorescence, indirect ELISA
INTRODUCCIÓN
La vicuña (Vicugna vicugna) es el miembro más pequeño de los camélidos sudamericanos (CSA). Habita de forma silvestre entre los 3000 y 4600 msnm en las altas mesetas andinas del centro y sur del Perú, la zona occidental de Bolivia, el norte de Chile y el noreste de Argentina. La importancia de esta especie radica en la producción de fibra
de gran finura, altamente valorizada en el mercado internacional. El aprovechamiento de la fibra implica el manejo racional de estos animales en sus hábitats naturales, minimizando los factores que puedan afectar la salud de los rebaños; sin embargo, son escasos los estudios epidemiológicos referidos a problemas de tipo infeccioso y parasitario, que ocasionarían alteraciones de tipo reproductivo y disminución de las tasas de natalidad, así como en la cantidad y calidad de la fibra (IBCE, 2010).
La toxoplasmosis y la neosporosis son enfermedades parasitarias causadas por protozoarios apicomplexos, que pueden llegar a producir abortos y mortalidad neonatal y perinatal (Buxton, 1998; Buxton y Henderson, 1999). Ambos parásitos presentan un ciclo de vida del tipo predador-presa, donde la reproducción asexual y sexual ocurre en el predador y la asexual solo ocurre en la presa (Rojas, 2003). Los hospederos definitivos de Neospora caninum son el canino doméstico (Lindsay et al., 1999) y el coyote (Gondim et al., 2004), mientras que los hospederos definitivos de Toxoplasma gondii son el gato (Dubey et al., 1970) y otros felinos (Jewell et al., 1972). La vicuña actuaría como hospedero intermediario para ambos parásitos.
Ambos protozoarios tienen tres estadios infectivos: ooquistes esporulados, taquizoítos (pseudoquistes) y bradizoítos (quistes tisulares). Los ooquistes son excretados con las heces, mientras que los taquizoítos y bradizoítos son hallados en los tejidos de los hospederos intermediarios (Dubey y Lappin, 1998). Las vicuñas adquirirían la infección a través de la ingestión de pastos y agua contaminados con ooquistes esporulados o por vía transplacentaria (Leguía y Casas, 1999).
La prueba de hemaglutinación indirecta (HAI) presenta especificidad del 96.6% y sensibilidad del 45.9% para el diagnóstico de T. gondii (Dubey et al., 1992), y constituye una de las técnicas más utilizadas en estudios de CSA por su practicidad y economía. Actualmente, se emplean, además, otras técnicas para el diagnóstico de Toxoplasma y Neospora que ofrecen una mayor sensibilidad y especificidad, como la técnica de inmunofluorescencia indirecta (IFI) con sensibilidad y especificidad de 96 y 98%, respectivamente, y la técnica de ELISA indirecta comercial, usado en otras especies, con sensibilidad y especificidad de 96.6 y 100%, respectivamente.
En el Perú se dispone de escasos estudios sobre la presencia de anticuerpos contra T. gondii en vicuñas. Pastor et al. (2003) encontró en Puno una frecuencia de 14.8% con la prueba de HAI, y Zuzunaga et al. (2006) en la Reserva de Pampas Galeras hallaron una frecuencia de 5.8% utilizando la prueba de IFI. Asimismo, Wolf et al. (2005) hallaron la presencia de anticuerpos contra N. caninum en alpacas y llamas, mas no así en vicuñas.
Debido a la diversidad de pruebas de alta sensibilidad y especificidad existentes para el diagnóstico de toxoplasmosis y neosporosis, el objetivo del estudio fue determinar la frecuencia de anticuerpos contra T. gondii y N. caninum en vicuñas de la sierra central del país, así como determinar el grado de concordancia entre las pruebas de IFI y ELISA indirecta.
MATERIALES Y MÉTODOS
Lugar de Estudio y Animales
El estudio se llevó a cabo en octubre de 2011 en la SAIS Túpac Amaru, en el área ubicada en distrito de Paccha, provincia de Yauli, departamento de Junín, a 3742 msnm. La zona presenta un clima frío y lluvioso, con temperaturas de 20 a -4 ºC, siendo la época de lluvia entre septiembre y marzo y la época de sequía entre abril y agosto.
Las vicuñas son animales silvestres y deben ser manejadas con cautela. Para su captura, se realiza un «Chaku», técnica ancestral de arreo, a cargo de personas especializadas, que permite la captura de animales vivos, donde son esquilados en un tiempo de dos minutos (Tuppia, 2009). Se aprovechó este manejo para tomar muestras de sangre del mayor número de animales posibles, los cuales fueron elegidos por los comuneros. Se llegó a recolectar 79 muestras, anotándose el sexo y grupo etario [cría (<1 año), juvenil (1- 3 años), adulto (>3 años)] del animal.
Recolección y Análisis de Muestras
Las muestras de sangre fueron obtenidas por punción directa de la vena yugular, utilizando vacutainers estériles de 7 ml y agujas 20 x 1½”. Las muestras fueron trasladadas con geles refrigerantes al Laboratorio de Parasitología de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos (FMV-UNMSM), Lima, donde se procedió a extraer el suero y se almacenó en viales de 2 ml a -20 ºC.
En la detección de anticuerpos contra T. gondii y N. caninum se usó un kit comercial de ELISA indirecta (IDEXX, EEUU), con un conjugado IgG anti-rumiante, siguiendo las instrucciones del fabricante. Asimismo, se empleó la prueba de IFI utilizada por Tress et al. (1993) y modificada en los laboratorios de parasitología de la Universidad Complutense de Madrid y de la FMV-UNMSM. Para esto, los sueros se emplearon en una dilución de 1:50, utilizándose taquizoitos de T. gondii y N. caninum formolizados como antígeno y un conjugado comercial anti-Ig G de llama (VMRD, EEUU), considerando como muestras positivas aquellas que mostraron una fluorescencia completa del taquizoito.
Análisis Estadístico
Se calculó la frecuencia relativa porcentual de reactores a T. gondii y N. caninum (Daniel, 1996). Asimismo, el grado de concordancia entre las pruebas IFI y ELISA indirecta fue determinado mediante la prueba de Kappa (Cohen, 1960).
RESULTADOS
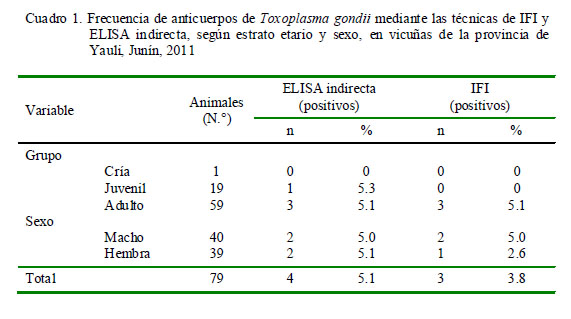
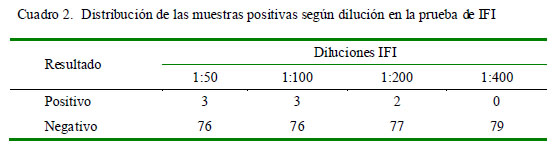
La frecuencia de anticuerpos anti-T. gondii fue de 5.1 y 3.8% mediante ELISA indirecta e IFI, respectivamente (Cuadro 1). Asimismo, se encontraron muestras positivas hasta la dilución 1:200 (Cuadro 2).
El grado de concordancia entre ambas pruebas (k) fue 0.85, lo que significa que el grado de concordancia entre ambas pruebas es muy bueno.
DISCUSIÓN
El 5.1 y 3.8% de frecuencia de anticuerpos anti-T. gondii obtenido mediante las técnicas de ELISA indirecta e IFI, respectivamente, en vicuñas de la sierra central del país (Cuadro 1), demuestran una baja frecuencia, similar al 5.8% hallado por Zuzunaga et al. (2006) en la Reserva de Vicuñas de Pampas Galeras, Ayacucho, con la prueba
de IFI. Sin embargo, Pastor et al. (2003) reportaron 14.8% de seroprevalencia en vicuñas de Puno que pastoreaban conjuntamente con llamas y alpacas, empleando HAI, técnica de menor sensibilidad (Blood y Radostis, 1992; Dubey et al., 1992). Posteriormente se determinaron prevalencias para T. gondii de 10.2 y 35.7% en llamas y alpacas, respectivamente, de estas mismas localidades, con la prueba de IFI (Saravia et al., 2004; Ramírez et al., 2005).
Por otro lado, las vicuñas evaluadas se encuentran en zonas de puna seca, entre 3800 y 4500 msnm, con temperaturas promedio de 6 a 8 ºC, y con heladas nocturnas con vientos que aumentan la sequedad y disminuyen la temperatura (Brenes et al., 2001), donde los únicos hospederos definitivos serían los felinos silvestres. Estas condiciones dificultarían la supervivencia de los ooquistes infectivos del medio ambiente, disminuyendo la probabilidad de infección.
La seroprevalencia a T. gondii en alpacas varía de moderada a alta, con valores de 34.5 a 50% (Leguía et al., 1988; Suárez et al., 2004), lo cual estaría relacionada al manejo de las alpacas que generalmente son trasladadas a lugares próximos a poblados para cumplir con los programas de dosificaciones, destete y esquila, actividades estresantes que pueden causarles una disminución de las defensas inmunitarias, exponiéndolas a otros tipos de infección (Tizard, 1995); además, en dichas áreas es notorio el mayor número de felinos domésticos.
No hubo mayor variación entre animales juveniles y adultos, posiblemente debido a la baja frecuencia de animales positivos a T. gondii. Sin embargo, sería de esperarse que animales de mayor edad muestren mayor seroprevalencia al presentar un mayor tiempo de exposición a la infección en comparación con individuos de menor edad (Barberan y Marco, 1997). Asimismo, la similitud de seroprevalencia entre sexos corrobora los hallazgos de Zuzunaga et al. (2006).
Estudios serológicos realizados en alpacas y llamas demostraron la presencia de N. caninum en Perú (Chávez et al., 2004). Estudios preliminares reportaron frecuencias de 42.4 y 18.4% en alpacas y llamas, respectivamente, en CSA domésticos de comunidades de la zona central del país (Chávez et al., 2002) con diluciones 1:50. En la actualidad se utiliza la dilución de 1:100, habiéndose reportado 2.9% de seroprevalencia en llamas de la sierra central (Casas et al., 2006). Estos resultados indicarían que si N. caninum afecta a los CSA domésticos, podría igualmente afectar a las vicuñas; sin embargo, siendo una especie silvestre que se le maneja en forma eventual, tendría escaso contacto con seres humanos, perros pastores y ganado en general, por lo que los factores de riesgo serían menores.
En el presente trabajo no se logró demostrar la presencia de anticuerpos anti-N. caninum en vicuñas. Por otro lado, cabe mencionar que en la zona de estudio sólo se pudo observar la presencia del zorro andino (Pseudalopex culpaeus), el cual no se ha demostrado que puede actuar como hospedero definitivo de N. caninum, a diferencia del perro y el coyote (Cañón et al., 2004).
Ambas técnicas resultaron eficientes en el diagnóstico de T. gondii y N. canimum; sin embargo, podría considerarse una ventaja del ELISA indirecta sobre IFI al tenerse la posibilidad de evaluar mayor número de muestras por hombre/día y obtener resultados automatizados que no dependen de la subjetividad en la interpretación, como ocurre en el caso de IFI. Además, esta última considera como resultado positivo una fluorescencia completa del taquizoíto, dado que fluorescencias parciales restringidas a la parte apical del taquizoíto son consecuencia de reacciones cruzadas o de concentraciones pobres de anticuerpos (Paré et al., 1995). Por este motivo, se prefiere emplear diluciones altas como 1/100, 1/200 y 1/400 para incrementar la especificidad (Chávez et al., 2005), y evitar
la sobreestimación de la infección.
En la prueba de IFI se empleó un conjugado anti-llama IgG (VMRD) de uso exclusivo en CSA, a diferencia del ELISA indirecta que se utilizó un conjugado antirrumiante IgG (Laboratorios IDEXX) validado en bovinos, ovinos y caprinos. En el presente estudio se observó una adecuada interacción del anti-IgG rumiante con las inmunoglobulinas de la vicuña, posiblemente debido a una relación filogenética entre rumiantes y camélidos, ya que ambos pertenecen al orden Artiodactyla, en el cual se encuentran los animales ungulados (Pachaly, 2001).
CONCLUSIONES
· La frecuencia de anticuerpos contra Toxoplasma gondii en vicuñas en la provincia de Yauli, Junín fue baja (5.1 y 3.1% con las pruebas de ELISA indirecta e IFI, respectivamente).
· No se detectó la presencia de anticuerpos contra Neospora caninum en las vicuñas.
· El valor de kappa (k) fue de 0.85 para el grado de asociación encontrado entre las pruebas de IFI y ELISA indirecta para detectar anticuerpos de T. gondii en vicuñas; sin embargo, debido al escaso número de muestras positivas no se puede inferir que la concordancia entre ambas pruebas sea buena.
LITERATURA CITADA
1. Barberan M, Marco J. 1997. Patogenia, cuadro clínico y lesional en toxoplasmosis - neosporosis. Rev Aula Veterinaria OVIS 52: 35-48. [ Links ]
2. Blood D, Radostits O. 1992. Medicina veterinaria. 7° ed. México: McGraw-Hill Interamericana. 1087 p. [ Links ]
3. Brenes E, Madrigal K, Pérez F, Valladares K. 2001. El cluster de los camélidos en Perú: diagnóstico competitivo
y recomendaciones estratégicas. En: Proyecto Andino de Competitividad. INCAE. 71 p. [ Links ]
4. Buxton D. 1998. Protozoan infections (Toxoplasma gondii, Neospora caninum and Sarcocystis spp) in sheep and goats: recent advances. Vet Res 29: 289-310. [ Links ]
5. Buxton D, Henderson D. 1999. Infections abortion in sheep. In Practice: 21: 360-368. [ Links ]
6. Cañón W, Yai L, Souza S, Santos L, Farias N, Ruas J, Rossi F, et al. 2004. Detection of antibodies to Neospora
caninum in two species of wild canids, Lycalopex gymnocercus and Cerdocyon thous from Brazil. Vet Parasitol 123: 275-277. [ Links ]
7. Casas G, Chávez A, Casas E, Leyva V, Alvarado A, Serrano E, et al. 2006. Presencia de Neospora caninum en llamas de una empresa ganadera de la sierra central. Rev Inv Vet Perú 17: 8-13. [ Links ]
8. Chávez A, Serrano E, Casas E, Ortega L. 2002. Neospora caninum en camélidos sudamericanos peruanos. Rev Inv Vet Perú 13(2): 1-3. [ Links ]
9. Chávez A, Alvarez G, Collantes E, Casas E, Rosadio R, Serrano E, Ortega L. 2004. First report of Neospora caninum infection in adult alpacas (Vicugna pacos) and llamas (Lama glama). J Parasitol 90: 864-866. [ Links ]
10. Chávez A, Álvarez G, Gómez M, Casas E, Serrano E, Ortega L. 2005. Toxoplasma gondii infection in adult llamas (Lama glama) and vicunas (Vicugna vicugna) in the Peruvian Andean region. Vet Parasitol 130: 93-97. [ Links ]
11. Cohen J. 1960. A coefficient of agreement for nominal scales. Educ Psychol Meas 20: 37-46. [ Links ]
12. Daniel W. 1996. Bioestadística: bases para el análisis de las ciencias de la salud. 3° ed. México: Limusa. 501 p. [ Links ]
13. Dubey J, Lappin M. 1998. Toxoplasmosis and neosporosis. In: Greene CE (eds). Infectious diseases of the dog and cat. 2nd ed. Philadelphia: Saunders. p 493-509. [ Links ]
14. Dubey J, Miller N, Frenkel J. 1970. The Toxoplasma gondii oocyst from cat feces. J Exp Med 132: 636-662. [ Links ]
15. Dubey J, Rickard L, Zimmerman G, Mulrooney D. 1992. Seroprevalence of Toxoplasma gondii in llamas (Lama
glama) in the northwest USA. Vet Parasitol 44: 295-298. [ Links ]
16. Gondim L, McAllister M, Pitt W, Zemlicka D. 2004. Coyotes (Canis latrans) are definitive hosts of Neospora caninum. Int J Parasitol 34: 159-161. [ Links ]
17. [IBCE] Instituto Boliviano de Comercio Exterior. 2010. Perfil de mercado, fibra de vicuña. [Internet]. Disponible en: http://www.ibce.org.bo/documentos/perfil_mercado_vicuna_CB06.pdf [ Links ]
18. Jewell M, Frenkel J, Johnson K, Reed V, Ruiz A. 1972. Development of Toxoplasma oocysts in neotropical felidae.
Am J Trop Med Hyg 21: 512-517. [ Links ]
19. Leguía G, Casas E. 1999. Enfermedades parasitarias y atlas parasitológico de camélidos sudamericanos. Lima: De
Mar. 190 p. [ Links ]
20. Leguía G, Samamé H, Guerrero C, Rojas M, Núñez A. 1988. Prevalencia de anticuerpos contra Toxoplasma gondii en alpacas. Rev Camel Sudamer 6: 19-22. [ Links ]
21. Lindsay D, Dubey J, Duncan R. 1999. Confirmation that the dog is a definitive host for Neospora caninum. Vet Parasitol 82: 327-333. [ Links ]
22. Pachaly J. 2001. Zoología de los camélidos sudamericanos. Arq Cienc Vet Zool UNIPAR 4(1): 81-83. [ Links ]
23. Paré J, Hietala S, Thumond M. 1995. Interpretation of an indirect fluorescent antibody test for diagnosis of Neospora sp. infection in cattle. J Vet Diagn Invest 7: 273-275. [ Links ]
24. Pastor J, Chávez A, Casas E, Serrano E. 2003. Seroprevalencia de Toxoplasma gondii en vicuñas de Puno. Rev Inv Vet Perú 14: 79-82. [ Links ]
25. Ramírez J, Chávez A, Casas E, Rosadio R, Falcón N. 2005. Seroprevalencia de Toxoplasma gondii en alpacas de comunidades de la provincia de Canchis, Cusco. Rev Inv Vet Perú 16: 169-174. [ Links ]
26. Rojas M. 2003. Nosoparasitosis de perros y gatos peruanos. Lima: Martegraf. 83 p. [ Links ]
27. Saravia M, Chávez A, Casas E, Falcón N, Pinto W. 2004. Seroprevalencia de T. gondii en llamas de una empresa
pecuaria en Melgar, Puno. Rev Inv Vet Perú 15: 49-55. [ Links ]
28. Suárez F, Flores W, Chávez A, Rivera H, Huanca W. 2004. Toxoplasmosis en alpacas de la sierra altoandina. Rev Inv Vet Perú 15: 170-173. [ Links ]
29. Tizard I. 1995. Inmunología veterinaria. 5° ed. México: Interamericana. 517 p. [ Links ]
30. Trees A, Guy F, Tennant B, Balfourd A, Dubey J. 1993. Prevalence of antibodies to Neospora caninum in a population of urban dogs in England. Vet Rec 132: 125-126. [ Links ]
31. Tuppia M. 2009. Manejo sustentable de la vicuña con inclusión social, económica, ambiental. Lima, Perú: Dirección General Forestal y Fauna Silvestre, Ministerio de Agricultura. 27 p. [ Links ]
32. Wolf D, Schares G, Cárdenas O, Huanca W, Cordero A, Barwald A, Conraths F, et al. 2005. Detection of specific antibodies to Neospora caninum and Toxoplasma gondii in naturally infected alpacas (Lama pacos), llamas (Lama glama) and vicuñas (Lama vicugna) from Peru and Germany. Vet Parasitol 130: 81-87. [ Links ]
33. Zuzunaga M, Chávez A, Li O, Evaristo R. 2006. Toxoplasma gondii en vicuñas de la Reserva Nacional de Pampa Galeras. Rev Inv Vet Perú 17: 1-6. [ Links ]
Recibido: 23 de enero de 2013
Aceptado para publicación: 12 de setiembre de 2013