versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.25 no.2 Lima abr. 2014
Seroprevalencia de leptospirosis en ovinos de dos ganaderías de Puno, Perú Seroprevalence of leptospirosis in sheep from two farms in Puno, Peru
Lucy Bautista R.1, Francisco Suárez A.1,4, Wilfredo Huanca L.2
1 Laboratorio de Medicina Veterinaria Preventiva, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
2 Laboratorio de Reproducción Animal, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima
4 E-mail: francisco_suarez2001@hotmail.com
RESUMEN El objetivo del estudio fue determinar la seroprevalencia de Leptospira spp en ovinos de dos ganaderías del departamento de Puno, Perú. Se recolectaron sueros de 100ovinosentremarzoymayode2006delaEstación ExperimentalILLPA(INIA) yde la Ganadería Asiruni. Las muestras se procesaron mediante la prueba serológica de aglutinación microscópica. La seroprevalencia total fue de 57%, sin diferencias entre ganaderías.
Palabras clave: leptospirosis, Leptospira spp, ovinos, anticuerpos, MAT, Puno
ABSTRACT
The objective of the present study was to determine the seroprevalence of Leptospira sppin twosheepfarmsin Puno,Peru.Bloodsamples(n=100)werecollected fromMarch toMay2006 at theILLPAExperminental Research FarmofINIAand the Asiruni farm. The samples were processed using the microscopic agglutination serological test. The total prevalence was 57%, without differences between farms.
Key words: leptospirosis, Leptospira spp, sheep, antibody, MAT, Puno
INTRODUCCIÓN La leptospirosis es una enfermedad de carácter zoonótico y de distribución mundial, que afecta a una gran variedad de animales domésticos y silvestres; no obstante, solo un reducido número de animales llegan a manifestar la enfermedad (Levett, 2001).
La Leptospira se clasifica en la actualidad en 17 especies, incluyendo las leptospiras patógenas y no patógenas, en base al grado de relación genética determinada por el secuenciamiento del gen ARN ribosomal de 16S (Morey et al., 2006). Los ovinos, dentro de las especies domésticas, son considerados los de menor susceptibilidad. La infección es usualmente de curso asintomático, pero pueden ocurrir brotes con abortos y muerte de los corderos (Ciceroni et al., 2000). El serovar más frecuente a nivel mundial es el hardjo; asimismo, es el mayor responsable de problemas reproductivos en ovejas y de la muerte de corderos. Entre otros serovares en el ovino, se puede destacar la presencia de pomona, ballum, bratislava y grippotyphosa (Ellis, 1983).
Los resultados de la pruebas serológicas para el diagnóstico de leptospirosis dependen de la técnica empleada, del antígeno utilizado, del punto de corte de la reacción y de variables relacionadas a la localidad, periodo del año y movilización de los animales. Así, en el Estado de Rio Grande do Sul, Brasil, se reporta 34.3% de ovinos reactores, con títulos de anticuerpos entre 100 y 3200, donde el serovar hardjo fue el más frecuente (28.4%) (Herrmann et al., 2004); mientras que Favero et al. (2002), también en Brasil, reportan solamente el 0.7% de animales reactores.
En el Perú, la información sobre leptospirosis ovina es escasa, a pesar de ser una enfermedad relacionada a problemas reproductivos. Se dispone del trabajo de Vargas et al. (1986), quienes encontraron una seroprevalencia de 0.6 a 5.4%, dependiendo del serovar, en ovinos de una empresa ganadera del departamento de Áncash, donde el serovar icterohaemorrhagiae fue el de mayor frecuencia, seguido de los serovares butembo y hardjo. Asimismo, se tiene el trabajo de Flores et al. (2009), quienes reportaron 24.8% de animales reactores en la Sierra Central.
Por otro lado, se han encontrado reactores en animales de la zona que se crían conjuntamente o muy cercanamente al ovino, como es el caso de los camélidos sudamericanos. Rosadio et al. (2012), trabajandoconanimales deHuancavelicayAyacucho, hallaron 90% de alpacas y 77% de vicuñas positivas a leptospirosis. Santos et al. (2009) detectaron 45% de alpacas reactoras en Quimsachata, Puno, y Rivera (2007) detectó 22 y 10% de alpacas reactoras a leptospirosis en las épocas de lluvia y seca, respectivamente, en Maranganí, Cusco. Asimismo, Herrera et al. (2000) reportaron 6.5% en alpacas, en tanto que Macedo y Hung (1993) hallaron 70% de positivos a L. castellonis, 10% a L. shermani, 6%a L. andamana y 8% a L. icterohaemorrhagiae. El objetivo del presente estudio fue, por lo tanto, determinar la seroprevalencia de leptospirosis en ovinos de dos localidades de Puno.
MATERIALES Y MÉTODOS
El estudio se realizó con ovinos de la Estación Experimental IILPA del INIA-Puno (n=44), situada en el distrito de Paucarcolla (3820 msnm), provincia de Puno y en la ganadería Asiruni (n=56), en el distrito de Santa Lucía, provincia de Lampa (4025 msnm); ambas en el departamento de Puno. La zona presenta dos periodos estacionales: seco (abril-agosto) y lluvioso (septiembre-marzo).
Se recolectaron muestras de sangre por punción de la vena yugular del total de ovinos de ambas ganaderías, entre marzo y mayo de 2006. Los sueros se separaron mediante centrifugación a 3000 rpm durante 10 minutos y almacenados a -20 °C. Las muestras se analizaron mediante la técnica de microaglutinación microscópica (MAT) en la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima.
Se utilizó una batería de nueve serovares de Leptospira: pomona, canicola, icterohaemorrhagiae, ballum, hardjo, pyrogenes, bratislava, georgia y australis. Se utilizó el medio Fletcher como medio de cultivo base para el desarrollo de las leptospiras. Se utilizaron microplacas de 96 pocillos con 245 µl de suero fisiológico. En el primer pocillo se añadió 5 µl del suero problema, se homogenizó y se traspasó 50 µl al siguiente pocillo para obtener una dilución de 1/100. Los sueros fueron considerados positivos cuando a la observación en microscopio de campo oscuro presentaron aglutinación igual o mayor al 50% a por lo menos un serovar (dilución 1:100).
La seroprevalencia de animales reactores a leptospirosis se calculó en base al total de sueros y al número de sueros positivos. Además, se tomó en consideración la seroprevalencia por edad (<2, 2-4, >4) y procedencia (Thrusfield, 1990). Asimismo, para evaluar la posible asociación entre animales reactores a leptospirosis y las variables en estudio se determinó el Odds Ratio (OR) (Colimon, 2010).
La seroprevalencia de leptospirosis fue de 57% (57/100), siendo de 57.1% para la ganadería de Asiruni y de 56.8% para ILLPA, con un OR de 1.01 indicando que el riesgo de padecer la enfermedad es similar en ambas localidades. Los resultados según grupo etario se muestran en el Cuadro 1.
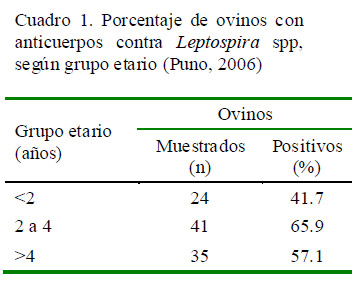
Se detectaron ovinos con anticuerpos contra 2 y 3 serovares indicando infecciones mixtas, siendo la asociación entre serovares icterohaemorrhagiae y ballum la más frecuente.
Se determinó una prevalencia de 57% ante la presencia de anticuerpos contra nueve serovares de Leptospira, indicando que estos animales estuvieron expuestos a infecciones naturales de Leptospira, posiblemente porque el manejo sanitario en ambas instituciones no incluye la vacunación contra esta bacteria.
El nivel de serorreactores se puede justificar por las posibilidades de supervivencia de las leptospiras patógenas en la zona, debido a que las lluvias tienden a concentrar la fuente de infección y convierten al agua en diluyentes de los lugares infectados con orina de roedores, perros y cerdos. No obstante, la tasa de seroprevalencia encontrada fue mayor al 15.3 y 24.8% reportados por Quiroz (1969) y Flores et al. (2009) en el país, aunque en diferentes medioambientes y calidad de animales. Por otro lado, estos resultados son superiores a las prevalencias reportadas en otros países como el 5.7% en Chile (Zamora y Riedemann, 1999), 14.3% en Bolivia (Ciceroni et al., 1997), 34.3% en Brasil (Herrmann et al., 2004) y 6.1% en Italia (Ciceroni et al., 2002), debiendo considerar-se que las diferencias podrían deberse a los serovares utilizados en los diagnósticos. Por otro lado, los resultados fueron similares al 56-58% de seroprevalencia reportada en México (Luna et al., 2005, 2008).
Los serovares icterohaemorrhagiae y ballum fueron los más frecuentes, donde los roedores son sus hospedadores de mantenimiento, los cuales fueron observados en las zonas del estudio. Estos serovares fueron, asimismo, los más frecuentes en el estudio de Flores et al. (2009) en la SAIS Túpac Amaru.
Se concluye que la infección por Leptospira spp está presente en los ovinos de Puno, Perú.
LITERATURA CITADA
1. Ciceroni L, Bartoloni A, Pinto A, Guglielmetti P, Valdez C, Gamboa H, Roselli M, et al. 1997. Serological survey of leptospiral infections in sheep, goats and dogs in Cordillera province, Bolivia. New Microbiol 20: 77-81. [ Links ]
2. Ciceroni L, Ciarrocchi S, Ciervo A, Petrucca A, Pinto A, Calderaro A, et al. 2002. Differentiation of leptospires of the serogroup pomona by monoclonal antibodies, pulsed-field gel electrophoresis and arbitrarily primed polymerase chain reaction. Res Microbiol 153: 37-44. [ Links ]
3. Ciceroni L, Lombardo D, Pinto A, Ciarrocchi S, Simeoni J. 2000. Prevalence of antibodies to Leptospira serovars in sheep and goats in Alto Adige-South Tyrol. J Vet Med B 47: 217-223. [ Links ]
4. Colimon K. 2010. Fundamentos de epidemiología. 3ª ed. Colombia: Ed CIB. 345 p. [ Links ]
5. Ellis W. 1983. Possible involvement of leptospires in abortion stillbirths and neonatal deaths in sheep. Vet Rec 26: 291-293. [ Links ]
6. Favero A, Pinheiro S, Vascobcellos S, Morais Z, Ferreira F, Ferreira Neto J. 2002. Sorovares de leptospiras predominantes em exames sorológicos de bubalinos, ovinos, caprinos, eqüinos, suínos e cães de diversos estados brasileiros. Cienc Rural 32: 613-619. [ Links ]
7 . Flores A, Rivera H, Gavidia C. 2009. Asociación entre infección leptospiral y problemas reproductivos en ovejas de una empresa ganadera en la sierra central del Perú. Rev Inv Vet Peru 20: 120-127. [ Links ]
8. Herrera J, Vasconcellos S, Morais Z, Ferreira F, Sakamoto S, Ferreira J, Pinheiro S. 2000. Soropositividade para leptospirose em alpacas criadas no altiplano peruano. Puno, Peru. Análise de associação com o índice pluviométrico. Arq Inst Biol 67: 171-176. [Internet]. Disponible en: http://www.biologico.sp.gov.br/docs/arq/V67_2/5.pdf [ Links ]
9. Herrmann G, Lage A, Moreira E, Haddad J, de Resende J, Rodrigues R, Leite R. 2004. Soroprevalência de aglutininas anti-Leptospira spp em ovinos nas Mesorregiões Sudeste e Sudoeste do Estado Rio Grande do Sul, Brasil. Cienc Rural 34: 443-448. [ Links ]
10. Levett P. 2001. Leptospirosis. Clin Microbiol Rev 14: 296-326. [ Links ]
11. Luna M, Moles L, Gavaldón D, Nava C, Salazar F. 2005. Estudio retrospectivo de seroprevalencia de leptospirosis bovina en México considerando las regiones ecológicas. Rev Cubana Med Trop 57(1): 28-31. [ Links ]
12. Luna AMA, Santos ME, Socci EG, Herrera LE, Banda RVM, Hernández OI, Moles CLP. 2008. Primeras observaciones realizadas con una vacuna experimental para el control de la leptospirosis ovina en Irapuato. En: Memoria XXXII Congreso Nacional de Buiatría. Guanajuato, México. p 192. [ Links ]
13. Macedo S, Hung A. 1993. Leptospirosis: estudio serológico en alpacas (Lama pacos) de la SAIS Picotani Puno. Rev Per Med Trop 7(2): 11-14. [ Links ]
14. Morey RE, Galloway RL, Bragg SL Steigerwalt AG, Mayer LW, Levett PN. 2006. Species-specific identification of Leptospiraceae by 16S rRNA gene sequencing. J Clin Microbiol 44: 35103516. [ Links ]
15. Quiroz JE. 1969. Encuesta serológica de leptospirosis en ovinos sacrificados en el camal de Yerbateros (Lima). Tesis de Bachiller. Lima: Univ Nacional Mayor de San Marcos. 35 p. [ Links ]
16. River a Z. 2007. Prevalencia de leptospirosis en alpacas de la Estación Experimental de Maranganí – IVITA, Cusco y su asociación con la época del año. Tesis de Médico Veterinario. Lima: Univ Nacional Mayor de San Marcos. 53 p. [ Links ]
17. Rosadio R, Véliz AQ, Castillo H, Yaya K, Rodríguez A, Rivera H, Wheeler J. 2012. Seroprevalencia a serovares de leptospiras patógenas en alpacas y vicuñas de los departamentos de Huancavelica y Ayacucho, Perú. Rev Inv Vet Perú 23: 350-356. [ Links ]
18. Santos Y, Suárez F, Rivera H, Huanca W, Cárdenas O, Camacho J. 2009. Seroprevalencia de leptospirosis en alpacas de Quimsachata, Puno. Rev Inv Vet Perú 20: 108-113. [ Links ]
19. Thrusfield M. 1990. Epidemiología veterinaria. Zaragoza, España: EdAcribia. 352 p. [ Links ]
20. Vargas A, Inope L, Ameghino E, Reif E. 1986. Leptospirosis en ovinos deÁncash. En:Res IXReuniónAsociación Peruana de Producción Animal, Tingo María, Perú. S-13. [ Links ]
21. Zamora J, Riedemann S. 1999. Animales silvestres como reservorios de leptospirosis en Chile. Una revisión de los estudios efectuados en el país. Arch Med Vet 31: 151-156. [ Links ]
 Citado por SciELO
Citado por SciELO  Similares en
SciELO
Similares en
SciELO  uBio
uBio 














