Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.26 no.1 Lima ene. 2015
http://dx.doi.org/10.15381/rivep.v26i1.10942
http://dx.doi.org/10.15381/rivep.v26i1.10942
Evaluación de la Calidad Espermática del Semen Ovino Posdescongelación al Emplear Dos Fuentes Energéticas y Dos Crioprotectores
Evaluation of ram sperm quality post-thawing by using two energy sources and two cryoprotectants
Luis Ruiz G.1,3, Rocío Sandoval M.1, Alexei Santiani A.2
1 Clínica de Animales Mayores, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Laboratorio de Reproducción Animal, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
3 E-mail: lfrg81@hotmail.com
RESUMEN
El objetivo del presente trabajo fue estudiar el efecto de dos fuentes energéticas (fructosa y glucosa) y dos crioprotectores (glicerol y etilenglicol) sobre la calidad seminal luego del proceso de criopreservación en un arreglo factorial de 2 x 2. Se evaluó la motilidad progresiva, la viabilidad y la integridad acrosomal. La motilidad fue superior con el uso de glicerol (65.5%) en comparación con el uso de etilenglicol (49.0%) (p<0.05); asimismo, la motilidad fue superior con el uso de fructosa (59.3%) que con glucosa (55.1%) (p<0.05). La integridad acrosomal fue superior con el uso de glicerol (58.2%) en comparación con el etilenglicol (42.0%); asimismo, la integridad acrosomal fue superior con el uso de fructosa (53.8%) que con glucosa (46.4%) (p<0.05). La interacción fuente energética x crioprotector no fue significativa. Los resultados demuestran que la utilización de glicerol como agente crioprotector y de fructosa como fuente energética previenen en forma más efectiva la pérdida de calidad seminal durante el proceso de criopreservación, en comparación con el etilenglicol y la glucosa, respectivamente.
Palabras clave: semen congelado; diluyentes de semen; fructosa; glucosa; glicerol; etilenglicol
ABSTRACT
The aim of this study was to evaluate the effect of two monosaccharides (fructose and glucose) and two cryoprotectants (glycerol and ethylene glycol) on semen quality after the cryopreservation process under a 2 x 2 factorial arrangement. The variables evaluated were progressive motility, viability, and acrosomal integrity. Motility was greater with the use of glycerol (65.5%) compared to the use of ethylene glycol (49.0%) (p<0.05); also, motility using fructose was higher with the use of fructose (59.3%) than when using glucose (55.1%) (p<0.05). Acrosomal integrity was superior with the use of glycerol (58.2%) compared with ethylene glycol (42.0%); also, acrosomal integrity was superior with the use of fructose (53.8%) than when using glucose (46.4%) (p<0.05). The energy source x cryoprotectant interaction was not statistically significant. The results showed that the use of glycerol as a cryoprotectant and fructose as an energy source more effectively prevent loss of semen quality during cryopreservation in comparison to ethylene glycol and glucose, respectively.
Key words: frozen semen; extenders; fructose; glucose; glycerol; ethylene glycol
INTRODUCCIÓN
La criopreservación de semen y la inseminación artificial (IA) son técnicas reproductivas utilizadas en la mayoría de especies domésticas (Juliani y Henry, 2008); sin embargo, la IA con semen congelado no está muy difundida en ovinos, debido principalmente a las bajas tasas de fertilidad obtenidas (Salamon y Maxwell, 2000; Santiani et al., 2007; Barbas et al., 2013). La baja fertilidad podría deberse a los daños ocasionados en los espermatozoides durante el proceso de criopreservación (Aisen et al., 2002; Ruiz et al., 2007; Santiani et al., 2007; Barbas et al., 2013). Los daños en las membranas espermáticas alteran su función metabólica, causando una capacitación espermática prematura (Santiani, 2003; Ruiz et al., 2007); y consecuentemente, los espermatozoides no sobreviven mucho tiempo en el tracto reproductivo de la hembra, disminuyendo las posibilidades de fecundar el ovocito (Aisen et al., 2002; Santiani et al., 2007).
Los daños producidos en los espermatozoides podrían ser prevenidos usando un diluyente adecuado (Molinia et al., 1994a,b; Aisen et al., 2000; Sandoval et al., 2007). Los dilutores están principalmente compuestos por una sustacia tampón, una fuente energética y agentes crioprotectores (Salamon y Maxwell, 2000). Los crioprotec-tores son sustancias de bajo peso molecular, pudiendo ingresar a la célula a través de la membrana plasmática (Ball et al., 2001; Bittencourt et al., 2004), evitando los efectos nocivos de la deshidratación excesiva causada por la congelación lenta (Salamon y Maxwell, 2000).
Entre los dilutores más utilizados están el glicerol y el etilenglicol (Ball et al., 2001; Bittencourt et al., 2004; Juliani y Henry, 2008; Madeira et al., 2013). El empleo del glicerol en la criopreservación de semen ovino ha tenido buenos resultados en relación con la motilidad progresiva posdescongelamiento (Molinia et al., 1994a; Santiani, 2003; Sandoval et al., 2007); sin embargo, algunos autores señalan que el etilenglicol tiene un efecto similar o mejor al glicerol en otras especies (Bittencourt et al., 2004; Madeira et al., 2013).
Las fuentes energéticas empleadas en la criopreservación de semen son principalmente carbohidratos del tipo monosacáridos (Fernández-Santos et al., 2007). Los más empleados son la fructosa y la glucosa (Molinia et al., 1994b; Aisen et al., 2000). Según Fernández-Santos et al. (2007), la fructosa tiene un mejor efecto en comparación con la glucosa, aunque otros indican que ambos tienen un efecto similar (Molinia et al., 1994b; Ponglowhapan et al., 2004).
Los azúcares también incrementan la presión osmótica del medio y actúan como crioprotectores (Purdy, 2006). Su principal efecto es su capacidad para reemplazar la molécula de agua en los grupos polares normalmente hidratados, lo cual ayuda a estabilizar la membrana durante la transición a través de las zonas de temperatura crítica (Aisen et al., 2000, 2002). Además, aumentan la viscosidad del diluyente (Purdy, 2006), lo que evita la cristalización eutéctica de los solutos (Vishwanath y Shannon, 2000; Garde et al., 2008; Naing et al., 2010).
Por tal motivo, la finalidad del estudio fue conseguir una composición alterna de un diluyente empleado para la criopreservación de semen de ovino. Así, se evaluó la combinación de dos fuentes energéticas (glucosa y fructosa) y dos crioprotectores (glicerol y etilenglicol), tomando como referencia el diluyente de semen ovino descrito por Aisen et al. (2000).
MATERIALES Y MÉTODOS
Lugar de Estudio y Muestras Biológicas
El estudio se realizó en la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (FMVUNMSM), Lima. Se emplearon seis ovinos adultos y la colección de semen se realizó utilizando una vagina artificial de ovino. El semen colectado se llevó en forma inmediata al Laboratorio de Reproducción Animal de la FMV-UNMSM en un tubo Falcón, protegido de la luz, dentro de una caja de tecnopor, para su procesamiento y congelación.
Se evaluó la calidad del semen fresco, aceptando los eyaculados que cumplieron los siguientes requisitos: volumen mayor de 0.8 ml, motilidad masal mayor de 3, motilidad progresiva mayor de 70% y una concentración mayor de 1000 x 106 espermatozoides/ml. Se trabajó con 24 eyaculados (4 eyaculados por macho), los cuales cumplieron los criterios de inclusión.
El estudio tuvo un diseño factorial de 2 x 2, trabajándose con dos fuentes energéticas (fructosa o glucosa) y dos crioprotectores (glicerol o etilenglicol).
Dilución y Congelación de Semen
Se utilizó el diluyente descrito por Aisen et al. (2000), el cual consiste en dos fracciones. La fracción 1 compuesta por tris 27.1 g/l, ácido cítrico 14 g/l, fuente energética (fructosa o glucosa, según tratamiento) 10 g/l y yema de huevo 10%. La fracción 2 compuesta por un crioprotector (glicerol 6% o etilenglicol 4.5%, según tratamiento, para obtener la misma concentracion molar), trehalosa 76 g/l, EDTA 1.5 g/l y fracción 1 csp 1 litro.
Se empleó un protocolo de criopreservación de semen de congelación lenta, conformado por un proceso de enfriamiento y uno de congelación. En la primera fase del enfriamiento, se diluyó el semen 1:1 con la primera fracción del diluyente a 35 ºC; luego se disminuyó la temperatura hasta llegar a los 5 ºC en un lapso de 90 min (1 ºC por cada 3 min). En la segunda fase, se agregó la segunda fracción del diluyente en una relación 1:1 con el semen previamente diluido y se incubó a 5 ºC durante 30 min, para estabilizar la muestra (Salamon y Maxwell, 2000).
Al término del periodo de estabilización, el semen se envasó en pajillas de 0.5 ml. Luego, las pajillas fueron congeladas con los vapores de nitrógeno líquido, disminuyendo la temperatura de 5 a -25°C en un lapso de 6 min (5 °C/min), para finalmente sumergirlas en el nitrógeno líquido (Byrne et al., 2000).
Evaluación del Semen Congelado
La evaluación del semen congelado se realizó 24 h después de haber finalizado el proceso de congelación. Para el descongelamiento, se colocaron las pajillas en baño María a 37 °C por 10 s. El semen se diluyó 1:10 en una solución base isotónica (27.1 g de Tris, 14 g de ácido cítrico, 10 g de fructosa y agua bidestilada csp 1000 ml) a 37 ºC. La evaluación se realizó 20 min después, determinando la motilidad progresiva y el porcentaje de espermatozoides vivos con acrosoma intacto.
Motilidad Progresiva
El semen fue descongelado y se diluyó con suero fisiológico a 37 ºC en una relación 1:2. Se colocó una gota (25 µl) de la dilución sobre una lámina portaobjeto temperada, se cubrió con una lámina cubreobjeto y se observó en microscopio óptico a 400x. Se calculó el porcentaje de espermatozoides con motilidad progresiva, considerándose solo a aquellos que presentaron un movimiento rápido hacia delante (Sandoval et al., 2007).
Viabilidad e Integridad Acrosomal
La evaluación de la viabilidad e integridad acrosomal se realizó mediante la técnica de doble tinción descrita por Didion et al. (1989). La técnica consiste en la adición del colorante azul tripán para diferenciar espermatozoides vivos de muertos, y Giemsa para visualizar la membrana acrosomal.
Se observó un mínimo de 200 espermatozoides en diferentes campos ópticos con lente de inmersión (1000x). Se consideraron espermatozoides vivos con acrosoma intacto a los que presentaron una coloración pálida o transparente en la parte posterior a la línea ecuatorial de la cabeza y, al mismo tiempo, tenían el acrosoma teñido de color fucsia. El resultado se expresó en porcentaje (Sandoval et al., 2007).
Análisis Estadístico
Con la finalidad de evaluar el efecto de los tratamientos sobre el porcentaje de motilidad progresiva y el porcentaje de espermatozoides vivos con acrosomas intactos, sin que influya la condición inicial del semen fresco, los resultados se calcularon de la siguiente manera (Aisen et al., 2000, 2002): Porcentaje final = (Valor inmediatamente descongelado) / (Valor en el semen fresco) x 100.
Los datos fueron transformados a valores angulares (ángulo = arcoseno √ porcentaje final) para acercar los datos a la distribución normal (Sandoval et al., 2007). Se utilizó el análisis de varianza para evaluar el efecto de los tratamientos sobre los porcentajes de motilidad progresiva y espermatozoides vivos con acrosomas intactos. Las monosacáridos y los crioprotectores se analizaron como factores fijos y los animales como factores aleatoreos. En el análisis de datos se utilizó el programa estadístico SPSS v. 22.0.
RESULTADOS
En el Cuadro 1 se muestran los resultados de motilidad progresiva. Los grupos donde se empleó el glicerol como crioprotector mostraron una mayor motilidad (65.5%) que aquellos donde se empleó el etilenglicol (49.0%) (p<0.001). En forma similar, se observa que los grupos tratados con fructosa tuvieron un porcentaje de motilidad superior a los grupos tratados con glucosa (59.3 vs 55.1%, respectivamente; p<0.05). No obstante estos resultados, la interacción fuente energética x crioprotector no fue significativa (p=0.483).
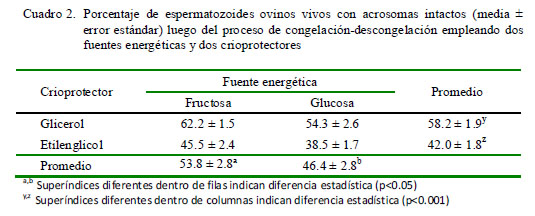
En el Cuadro 2 se puede observar que los grupos tratados con glicerol tuvieron un porcentaje de espermatozoides vivos con acrosoma intacto superior a los grupos en que se empleó el etilenglicol (58.2 vs 42.0%, respectivamente; p<0.001). Asimismo, se puede observar que los grupos tratados con fructosa tuvieron un porcentaje de espermatozoides vivos con acrosoma intacto superior a los grupos tratados con glucosa (53.8 vs 46.4%, respectivamente; p<0.05). No obstante, y en forma similar al caso de la motilidad progresiva, la interacción fuente energética x crioprotector no fue significativa (p=0.272).
En ambas variables evaluadas, se puede observar que tanto el empleo de glicerol y fructosa en el diluyente del semen preservan mejor la calidad del semen por efecto del proceso de criopreservación.
DISCUSIÓN
Los resultados del presente trabajo demostraron que la utilización de glicerol, como agente crioprotector, y fructosa, como fuente energética, previenen en forma más efectiva la pérdida de calidad seminal durante el proceso de criopreservación, en comparación con el etilenglicol y la glucosa, respectivamente.
La motilidad progresiva por efecto de la congelación/descongelación tuvo una mayor protección con el uso del glicerol en comparación con el uso del etilenglicol, habiéndose encontrado resultados similares en congelación de semen ovino (Molinia et al., 1994a; Salamon y Maxwell, 2000; Santiani, 2003; Sandoval et al., 2007). Adicionalmente, se reportan mejores resultados en caprinos con el uso del glicerol (Bittencourt et al., 2004); sin embargo, en otras especies como humanos (Gilmore et al., 2000; Deppe et al., 2003), equinos (Ball y Vo, 2001), bovinos (Guthrie et al., 2002) y chinchillas (Carrascosa et al., 2001), se han encontrado mejores resultados al usar etilenglicol.
A diferencia de lo que ocurre en especies donde el etilenglicol es una buena alternativa para la criopreservación de semen, en el ovino no lo es y podría deberse a una mayor permeabilidad del espermatozoide al glicerol o a una mayor susceptibilidad de los espermatozoides a los efectos tóxicos producidos por el etilenglicol.
El semen criopreservado suele tener una menor capacidad fecundante que el semen fresco (Salamon y Maxwell, 2000), de allí la importancia de evaluar la viabilidad del espermatozoide y la integridad del acrosoma (Didion et al., 1989; Ruiz et al., 2007; Sandoval et al., 2007).
La mayor protección conferida por la fructosa podría estar relacionada con la alta concentración de esta que se observa en el plasma seminal de ovino y su elevada capacidad glicolítica (Salisbury y Lodge, 1962); sin embargo, Molinia et al. (1994b) no encontraron diferencias significativas al comparar glucosa con fructosa en semen ovino. Asimismo, tampoco se han reportado diferencias en el uso de estos dos monosacáridos en la criopreservación de semen caprino (Naing et al., 2010) y en semen de gacelas (Garde et al., 2008). Por otro lado, se reporta que la fructosa tiene un efecto ligeramente superior al de la glucosa en el semen de verraco (Chanapiwat et al., 2012).
Los mecanismos exactos de las diferencias entre los azúcares en los espermatozoides no se han revelado plenamente. Sin embargo, el espermatozoide utiliza la glucosa y la fructosa a través de la glucólisis en diferentes formas, lo que resulta en diferentes tipos de fosforilación celular que está estrechamente relacionado con la formación de L-lactato extracelular (Chanapiwat et al., 2012).
CONCLUSIONES
El empleo de glicerol, como crioprotector y fructosa, como monosacárido en los diluyentes de semen ovino para el proceso de criopreservación, previenen la disminución de la calidad seminal en comparación con el etilenglicol y la glucosa.
LITERATURA CITADA
1. Aisen E, Álvarez H, Venturino A, Garde J. 2000. Effect of trehalose and EDTA on cryoprotective action of ram semen diluents. Theriogenology 53: 1053-1061. doi: 10.1016/S0093-691X(00)00251-X [ Links ]
2. Aisen E, Medina V, Venturino A. 2002. Cryopreservation and post-thawed fertility of ram semen frozen in different trehalose concentrations. Theriogenology 57: 1801-1808. doi: 10.1016/S0093-691X(02)00653-2 [ Links ]
3. Ball B, Vo A. 2001. Osmotic tolerance of equine spermatozoa and the effects of soluble cryoprotectants on equine sperm motility, viability, and mitochondrial membrane potential. J Androl 22: 1061-1069. [ Links ]
4. Barbas J, Marques C, Baptista M, Mascarenhas R, Pereira R, CavacoGonçalves S, et al. 2013. Fertilidade de carneiros de raça Saloia com sémen refrigerado ou congelado. Arch Zootec 62: 303-306. doi: 10.4321/S0004-05922013000200018 [ Links ]
5. Bittencourt R, Ribeiro A, Santos A, Fürst R, Teixeira R, Chalhoub M. 2004. Freezing goat semen with glycerol and ethylene glycol as the cryoprotective agents. In: 15th International Congress on Animal Reproduction. Porto Seguro: Brazilian College of Animal Reproduction.
6. Byrne G, Lonergan P, Wade M, Duffy P, Donovan A, Hanrahan J, Boland M. 2000. Effect of freezing rate of ram spermatozoa on subsequent fertility in vivo and in vitro. Anim Reprod Sci 62: 265275. doi: 10.1016/S0378-4320(00)00121-4 [ Links ]
7. Carrascosa R, Martini A, Ponzio M, Busso J, Ponce A, Lacuara J. 2001. Storage of Chinchilla lanigera semen at 4 degrees C for 24 or 72 h with two different cryoprotectants. Cryobiology 42: 301-306. doi: 10.1006/cryo.2001.2326 [ Links ]
8. Chanapiwat P, Kaeoket K, Tummaruk P. 2012. Cryopreservation of boar semen by egg yolk-based extenders containing lactose or fructose is better than sorbitol. J Vet Med Sci 74: 351-354. doi: 10.1292/jvms.11-0273 [ Links ]
9. Deppe M, Ortloff C, Salinas G, Bravo D, Sánchez R. 2003. Efecto de agentes crioprotectores sobre la preservación del acrosoma. En: II Reunión Anual Sociedad de Andrología y Gametología de Chile. Temuco: Sociedad de Andrología y Gametología de Chile.
10. Didion B, Dobrinsky J, Giles J, Graves C. 1989. Staining procedure to detect viability and the true acrosome reaction in spermatozoa of various species. Gamete Res 22: 51-57. [ Links ]
11. Fernández-Santos M, Martínez-Pastor F, García-Macías V, Esteso M, Soler A, Paz P, et al. 2007. Extender osmolality and sugar supplementation exert a complex effect on the cryopreservation of Iberian red deer (Cervus elaphus hispanicus) epididymal spermatozoa. Theriogenology 67: 738-753. doi: 10.1016/ j.theriogeno-logy.2006.10.005 [ Links ]
12. Garde J, del Olmo A, Soler A, Espeso G, Gomendio M, Roldan E. 2008. Effect of egg yolk, cryoprotectant, and various sugars on semen cryopreservation in endangered Cuvier’s gazelle (Gazella cuvieri). Anim Reprod Sci 108: 384-401. doi: 10.2164/jandrol.108.006395 [ Links ]
13. Gilmore J, Liu J, Woods E, Peter A, Critser J. 2000. Cryoprotective agent and temperature effects on human sperm membrane permeabilities: convergence of theoretical and empirical approaches for optimal cryopreservation methods. Hum Reprod 15: 335-343. [ Links ]
14. Guthrie H, Liu J, Critser J. 2002. Osmotic tolerance limits and effects of cryoprotectants on motility of bovine spermatozoa. Biol Reprod 67: 1811-1816. doi: 10.1095/biolreprod67.6.1811 [ Links ]
15. Juliani G, Henry J. 2008. Efeito do glicerol, etilenoglicol, acetamida, e leite desnatado na criopreservação de espermatozóides eqüinos. Arq Bras Med Vet Zootec 60: 1103-1109 [ Links ]
16. Madeira E, Bianchi I, Vieira M, Schneider A, Servero N, Pfeifer L, Corrêa M. 2013. Avaliação de diferentes crioprotetores intra e extracelulares na criopreservação de sêmen de touros. Arq Bras Med Vet Zootec 65: 415-420. doi: 10.1590/S0102-09352013000200017 [ Links ]
17. Molinia F, Evans G, Maxwell W. 1994a. Incorporation of penetrating cryoprotectants in diluents for pelletfreezing ram spermatozoa. Theriogenology 42: 849-858. doi: 10.1016/0093-691X(94)90453-P [ Links ]
18. Molinia F, Evans G, Quintana-Casares P, Maxwell W. 1994b. Effect of monosaccharides and disaccharides in Tris-based diluent on motility, acrosome integrity and fertility of pellet frozen ram spermatozoa. Anim Reprod Sci 36: 113-122. doi: 10.1016/0378-4320(94)90058-2 [ Links ]
19. Naing S, Wahid H, Mohd Azam K, Rosnina Y, Zuki A, Kazhal S, et al. 2010. Effects of sugars on characteristics of Boer goat semen after cryopreservation. Anim Reprod Sci 122: 23-28. doi: 10.1016/j.anireprosci.2010.06.006 [ Links ]
20. Ponglowhapan S, Essén-Gustavsson B, Linde-Forsberg C. 2004. Influence of glucose and fructose in the extender during long-term storage of chilled canine semen. Theriogenology 62: 1498-1517. doi: 10.1016/j.theriogenology.2004. 02.014 [ Links ]
21. Purdy P. 2006. A review on goat sperm cryopreservation. Small Ruminant Res 63: 215-225. doi: 10.1016/j.smallrumres.2005.02.015 [ Links ]
22. Ruiz L, Santiani A, Sandoval R, Huanca W, Delgado A, Coronado L, Alzamora C. 2007. Efecto de dos antioxidantes (tempo y tempol) en la criopreservación de semen ovino empleando un dilutor en base a Tris. Rev Inv Vet Perú 18: 99-106. [ Links ]
23. Salamon S, Maxwell W. 2000. Storage of ram semen. Anim Reprod Sci 62: 77111. doi: 10.1016/S0378-4320(00)00155-X [ Links ]
24. Salisbury W, Lodge J. 1962. Metabolism of spermatozoa. En: Nord F (ed). Advances in enzymology and related subjects of biochemistry. Vol XXIV. New York: Interscience Publishers. p 35-104
25. Sandoval R, Santiani A, Ruiz L, Leyva V, Coronado L, Delgado A. 2007. Criopreservación de semen ovino empleando tres dilutores y cuatro combinaciones de agentes crioprotectores permeantes y no permeantes. Rev Inv Vet Perú 18: 107-114. [ Links ]
26. Santiani A. 2003. Criopreservación de semen ovino: efecto de la adición de antioxidantes al diluyente. Tesis de Magíster. Temuco: Univ dela Frontera. 95 p. [ Links ]
27. Santiani A, Ruiz L, Sandoval R, Evangelista S, Urviola M, Catacora N, et al. 2007. Incremento de la tasa de no retorno de celo en ovejas utilizando un antioxidante análogo de superóxido dismutasa (Tempo) durante la criopreservación de semen. En: XX Reunión de la Asociación Latinoamericana de Producción Animal. Cusco, Perú: Asociación Peruana de Producción Animal.
28. Vishwanth R, Shannon P. 2000. Storage of bovine semen in liquid and frozen state. Anim Reprod Sci 62: 23-53. doi: 10.1016/S0378-4320(00)00153-6 [ Links ]
Recibido: 22 de junio de 2014
Aceptado para publicación: 8 de noviembre de 2014