Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.26 no.2 Lima abr. 2015
http://dx.doi.org/10.15381/rivep.v26i2.11001
http://dx.doi.org/10.15381/rivep.v26i2.11001
Redescripción de Lamanema chavezi por Microscopía Óptica y Microscopía Electrónica de Barrido
Redescription of Lamanema Chavezi by Optical Microscopy and Scanning Electron Microscopy
José Angulo T.1,4, Manuel Tantaleán-Vidaurre1, Raquel Watanabe-Watanabe2, Jonatan Mikhail Del Solar Velarde3
1 Laboratorio de Parasitología de Fauna Silvestre y Zoonosis, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
3 Programa de Pós-graduação em Zootecnia, Universidade Federal da Bahia, Brasil
4 E-mail: jmangulot@gmail.com
RESUMEN
El presente estudio tuvo como objetivo redescribir morfo-anatómicamente a Lamanema chavezi en sus tres estadios parasitarios (huevo, larva de tercer estadío, adulto) utilizando la técnica de microscopía óptica y microscopía electrónica de barrido. Se trabajó con alpacas (Vicugna pacos) sacrificadas en el Camal Municipal de la provincia de Melgar, Puno, Perú. Los estadios adultos fueron colectados del intestino delgado aplicando el método de Travassos; los huevos fueron colectados de heces de animales parasitados mediante la técnica de flotación; y parte de los huevos obtenidos fueron incubados para la obtención de larvas mediante proceso mecánico. Los principales hallazgos incluyen la presencia del rudimento de corona foliácea, seis papilas cefálicas, características de crestas del sinlophe, presencia de papilas en la cara dorsal de los lóbulos laterales de la bolsa copulatriz, alas en las espículas, y características de los huevos y larvas L3. Se obtuvo la caracterización fenotípica y se complementa el conocimiento de la morfo-anatomía de L. chavezi con fines de diagnóstico y establecer un ámbito taxonómico.
Palabras clave: Vicugna pacos, Lamanema chavezi, microscopía óptica, microscopía electrónica de barrido
ABSTRACT
This study aimed to morpho-anatomically redescribe Lamanema chavezi in the three parasitic stages (egg, third stage larvae and adult) using optical microscopy and scanning electron microscopy. Samples were collected from alpacas (Vicugna pacos) in the municipal slaughterhouse of Melgar province, Puno, Peru. Adult specimens were collected from the small intestine using the Travassos method; eggs were collected from stool samples in infected animals by the flotation technique; and some of the collected eggs were incubated for obtaining larvae by mechanical process. The main findings include the presence of foliated crown rudiment, six cephalic papillae, synlophe ridges features, presence of papillae on the bursal dorsal side in the lateral lobes, spicules alae characteristics, and eggs and L3 larvae features. The results allowed the phenotypic characterization and complement the knowledge of the morpho-anatomy of L. chavezi for diagnostic purposes and sets a taxonomic level.
Key words: Vicugna pacos, Lamanema chavezi, optical microscopy, scanning electron microscopy
INTRODUCCIÓN
Los camélidos sudamericanos (CSA) representan un grupo de gran importancia social, económica, cultural y científica para el Perú y algunos países de la región andina (Wheeler, 1995; Fernández Baca, 2005; Raggi, 2005). El 51 y 34% de la población de CSA se encuentra en Perú y Bolivia, respectivamente (Jiménez et al., 2010); además, el Perú ocupa el primer lugar a nivel mundial en la tenencia de alpacas y vicuñas, mientras que Bolivia lo es en llamas (FAO, 2005).
En las últimas décadas se ha observado un interés creciente por las llamas (Lama glama) y alpacas (Vicugna pacos) en Amé- rica del Norte, Europa y Oceanía (Brown, 2000; Sharpe et al., 2009), tanto por su papel productivo como de animal de compañía (Jiménez et al., 2010). Sin embargo, su potencial productivo no se expresa a cabalidad por diversos factores incluyendo los de tipo sanitario causados por agentes infecciosos y parasitarios (Ortiz, 1988; Ameghino y DeMartini, 1991; Sumar, 1991; FernándezBaca, 2005), que disminuyen la capacidad productiva del animal (Rojas, 1990; Leguía y Casas, 1999).
El nematodo Lamanema chavezi Becklund 1963, principal componente del complejo de la neumogastroenteritis verminosa de los CSA, es miembro único dentro de su gé- nero (Rickard y Hoberg, 2000). Presenta un ciclo enterohepático, lugar donde se produce la muda de larvas de tercer a cuarto estadio (Chávez et al., 1967; Guerrero et al., 1973), lo que contribuye a la presentación de anemia e hipoproteinemia.
L. chavezi ha sido reportada en cuatro países sudamericanos: Perú (Becklund, 1963), Argentina (Cafrune et al., 2001), Chile (Alcaíno et al., 1991) y Bolivia (Spörndly y Nissen, 2008) en tres especies de CSA (alpacas, llamas y vicuñas) (Cafrune et al., 2009). También ha sido reportada en alpacas y llamas de Nueva Zelanda y EEUU (McKenna, 2006; McKenna et al., 2009; Jarvinen et al., 2014) y en dos roedores silvestres en Argentina (Sutton y DuretteDesset, 1985; Digiani y Durette-Desset, 2007).
Este parásito ha pasado por diversos cambios en su clasificación taxonómica. En su primera descripción, Becklund (1963) lo asignó a la Familia Trichostrongylidae por la presencia de un diente dorsal prominente y dos dientes laterales pequeños en la cavidad bucal, y probablemente en las subfamilias Nematodirinae o Haemonchinae. Sin embargo, no fue clasificado en ninguna subfamilia debido a la presencia de una membrana bursal accesoria. Durette-Desset y Chabaud (1977) elevaron la subfamilia Molineinae Skrjabin y Schultz, 1937, a la condición de familia, y transfirieron la subfamilia Nematodirinae de la familia Trichostrongylidae a la Molineidae, colocando, así, a Lamanema dentro de la subfamilia Nematodirinae.
Posteriormente, el sinlophe de Lamanema fue evaluado por Durette-Desset (1978), quien observó la presencia de crestas con orientación perpendicular, característica compatible con las familias Trichostrongylidae y Molineidae, además de la presencia de una vesícula cefálica y la similitud en el tipo bursal afín con la subfamilia Cooperiinae dentro de Trichostrongylidae, ubicándolo finalmente, dentro de la familia Molineidae basada en el rayo 4 corto y la estructura de la espícula. Luego, se determinó la presencia de un diente esofágico (formación neodonta), por lo que esta especie fue clasificada dentro de la subfamilia Nematodirinae, afirmando que el género representó una transición entre las subfamilias Nematodirinae y Molineinae (Durette-Desset, 1983, 1985).
El estudio de hembras de L. chavezi confirmó la orientación perpendicular del sinlophe junto con la carencia de la corona radiata, siendo esta última una estructura tí- pica de la subfamilia Nematodirinae, lo que apoyó la afirmación de que Lamanema fue el miembro más primitivo de esta subfamilia (Sutton y Durette-Desset, 1985; DuretteDesset, 1978). Posteriormente, Lamanema fue excluido de la familia Trichostrongylidae por la presencia de una espina en la cola de la hembra y el rayo 4 corto en la bolsa copulatríz (Hoberg y Lichtenfels, 1994), reafirmando así su clasificación dentro de la familia Molineidae (Rickard y Hoberg, 2000); además, Lamanema presenta sinapomorfias propias de Molineidae como el sinlophe generalmente presente con crestas orientadas perpendicularmente a la pared del cuerpo, la cápsula bucal ausente, presencia de una vesícula cefálica, didelfa y la espina caudal presente en las hembras (Rickard y Hoberg, 2000).
Por otro lado, Lamanema posee algunos atributos plesiomórficos en relación a la familia Trichostrongylidae (Durette-Desset y Chabaud, 1977, Hoberg y Lichtenfels, 1994), además de presentar solo una de las siete sinapomorfias propias de la subfamilia Nematodirinae, que es la de presentar huevos grandes. En consecuencia, pertenece firmemente a Molineinae debido a que presenta una bolsa tipo 2-1-2 con tendencia al tipo 3-2 propio de la subfamilia, a pesar de presentar autopomorfias como la divergencia de los rayos de la bursa 2 y 3, la estructura de la membrana bursal accesoria y el patrón único de desarrollo enterohepático que lo definieron, consistentemente, fuera de la subfamilia Nematodirinae (Rickard y Hoberg, 2000; Hoberg et al., 2005).
A pesar de la importancia de este pará- sito en CSA, son escasos los estudios sobre su descripción morfo-anatómica, de allí la importancia de validar su clasificación y conocer nuevas estructuras en los estadios de huevo, larva de tercer estadio y adulto. El objetivo del presente estudio fue redescribir las características morfo-anatómicas en tres estadios evolutivos mediante microscopía óptica (MO) y microscopía electrónica de barrido (MEB).
MATERIALES Y MÉTODOS
El muestreo se realizó en marzo de 2013 en un camal de CSA de la provincia de Melgar, departamento de Puno, Perú. Se colectaron ocho segmentos gastrointestinales (duodeno-yeyuno) de alpacas Suri y Huacaya de 5 a 7 años de edad. Además, se recolectaron 20 muestras de heces de alpacas adultas directamente del recto (500 a 600 g por muestra) y conservadas a 4 °C.
Para la obtención de estadios adultos, se efectuó el lavado interno con agua de todo el contenido gastrointestinal de cada animal para someterlo a la técnica de tamizaje (Travassos, 1950), conservado en refrigeración (+4 °C) y trasladado al Laboratorio de Parasitología de Fauna Silvestre y Zoonosis, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Lima. Las muestras fueron procesadas empleando un tamiz circular de 80 hilos por pulgada para recuperar los estadios adultos de los parásitos, luego fueron fijados en glutaraldehído al 4% y analizados mediante MEB (Martínez, 2011). Asimismo, otro grupo de parásitos adultos fueron fijados en alcohol al 70% y evaluados mediante MO. Para la obtención de huevos y larvas de tercer estadio, se utilizaron las muestras conservadas a temperatura de refrigeración (+4 °C) y fueron sometidas a la técnica de flotación. Los huevos fueron observados en el estereoscopio (Leica EZ4 HD), colocados en un beaker de 200 ml con agua destilada, lavados para ser fijados en glutaraldehído al 4%, y finalmente fueron evaluados por MEB. Asimismo, otro grupo de huevos fueron fijados en alcohol al 70% y evaluados por MO, y un tercer grupo fue incubado en agua destilada al medio ambiente para obtener larvas de tercer estadio. Los huevos larvados fueron sometidos a un proceso mecánico, mediante el uso de perlas de vidrio, para la obtención de los estadios larvales L3 para su posterior fijación en glutaraldehído al 4% y alcohol al 70%.
Para la MO, los tres estadios larvarios del parásito, previamente conservados en una solución de alcohol al 70%, fueron clarificados en una mezcla de fenol con alcohol etílico (dos partes de fenol derretido por una de alcohol etílico de 50%) y en lactofenol de Amann. Se realizó el estudio de especímenes machos y hembras de L. chavezi en estadio adulto, analizando las partes anterior, media y posterior, con la finalidad de reconocer las características internas, principalmente a nivel del aparato digestivo y reproductor; además de las características externas propias del parásito.
Algunas estructuras del parásito se resaltaron con el colorante carmín acético de Semichon. Todos los hallazgos fueron fotografiados utilizando un microscopio óptico compuesto (Leica DM750, Alemania), con contraste de fases (ICC50 HD) y cámara incorporada. Además, se tomaron las medidas referenciales. Asimismo, se realizaron cortes transversales para describir algunas estructuras.
Para la MEB, los huevos, larvas y adultos previamente fijados, fueron deshidratados en alcoholes entre 30 al 100%, para luego ser secados por punto crítico (Electron Microscopy Sciences, modelo EMS 850), retirando el agua que contiene el parásito y reemplazado por dióxido de carbono. Posteriormente, se procedió a la metalización con oro mediante un equipo de recubrimiento por pulverizado-metalizador (Sputter Coater SPI, 11430E-AX), para realizar la toma de imágenes, lectura e interpretación (Martínez, 2011), utilizando un microscopio electrónico de barrido con cámara incorporada (Fei Inspect S50).
El presente trabajo fue de carácter descriptivo, en el cual las características morfoanatómicas fueron analizadas mediante estadística descriptiva. El análisis descriptivo se basó en promedios ponderados y rangos de longitud y amplitud expresados en milímetros.
RESULTADOS Y DISCUSIÓN
Re-descripción
-
Especímenes adultos de L. chavezi (n=75), siendo 40 machos y 35 hembras
-
Hospedador: Vicugna pacos
-
Localidad: Melgar, Puno, Perú (14° 29' 1"S, 70° 38' 1" W)
-
Lugar de infección: intestino delgado (duodeno y yeyuno)
-
Los especímenes estaban fuertemente enrollados a nivel de los 2/3 posteriores del cuerpo, a manera de resorte
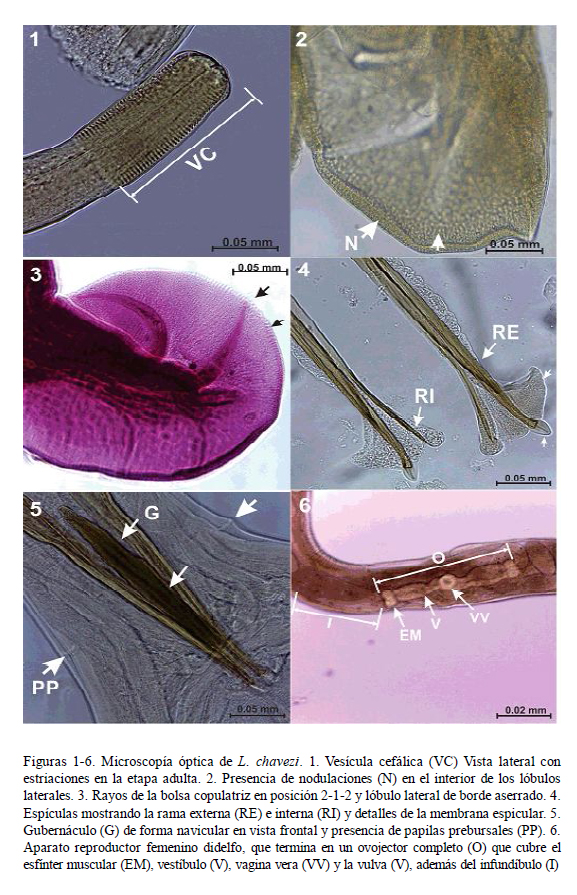
Extremidad cefálica
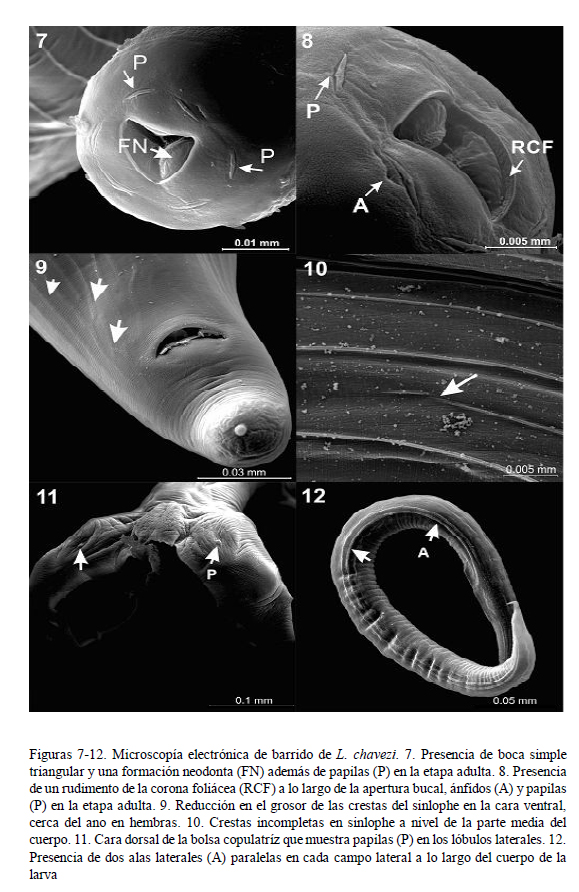
La vesícula cefálica es estrecha, ligeramente ensanchada en la parte anterior (Fig. 1). A la MEB se observa una abertura bucal simple triangular, acompañada de un rudimento de corona foliácea que la rodea, con seis papilas en el círculo interno y dos ánfidos (Figs. 7 y 8). El esófago presenta una formación neodonta a nivel del extremo anterior (Fig. 7), mientras que a nivel posterior es ensanchado y presenta una glándula esofágica desarrollada.
Poro excretor
Es pequeño y se abre en la parte anterior, al nivel o posterior a la unión esofágicointestinal. Los deiridios son muy pequeños y poco visibles. Los machos poseen papilas prebursales grandes (Fig. 5).
Sinlophe
En ambos sexos se inicia a partir de la terminación de la vesícula cefálica. En machos finaliza cerca del inicio de la bolsa copulatriz; y en las hembras sobrepasa la abertura anal, llegando hasta la mitad de la longitud de la cola (Fig. 9). Las crestas se encuentran equidistantes a lo largo de la longitud del parásito. Por medio de cortes transversales, se pudo observar el número de crestas a nivel medio y posterior en machos y hembras (Cuadro 1). Tanto por MO y MEB se observó que algunas crestas del sinlophe están incompletas o interrumpidas a cualquier nivel del cuerpo (Fig. 10) y que aquellas de la cara ventral del cuerpo de la parte anterior al ano disminuyen en grosor (Fig. 9).
La cola en las hembras es truncada y en algunos casos redondeada, con un apéndice, con musculatura radiada a la altura del ano. En las hembras se observan los fásmidos que se localizan a nivel de la parte media de la cola cuyas aberturas tienen forma ovalada.
Bolsa copulatriz
Bien desarrollada; presenta dos papilas en la cara dorsal de los lóbulos laterales, posiblemente de función sensorial. Los lóbulos laterales están bien desarrollados y el dorsal es pequeño (Fig. 11). El borde inferior de los lóbulos laterales se encuentra finamente aserrado (Fig. 3) y en la cara interna llevan pequeñas elevaciones aplanadas ovales (Fig. 2) posiblemente de función sensorial.
Becklund (1963) señala que los rayos 2, 3, 5 y 6 (según la nueva nomenclatura) son estructuras que disminuyen de grosor gradualmente desde la base hasta la punta, alcanzando el margen del lóbulo. Los resultados presentes, en gran parte coincidentes con Becklund (1963), muestran la disposición de rayos de tipo 2-1-2 (Fig. 3). Los rayos 2 están fuertemente curvados en su parte anterior formando un semicírculo; los rayos 3 se curvan en su parte media formando un ángulo obtuso; los rayos 4 son gruesos y rectos, sin llegar al borde de la bolsa copulatríz; los rayos 5 y 6 son delgados y curvados hacia la cara inferior del lóbulo; los rayos 8 son delgados y separados de la dorsal, y sus extremos no llegan al borde de la bolsa. El rayo dorsal es delgado y largo, dividido en forma de «V» invertida a la altura del tercio distal, donde cada rama está subdividida en dos procesos, de los cuales el externo es más grande y en forma de «S» abierta. Según Hoberg y Lichtenfels (1994), la presencia del rayo 4 es muy importante para que Lamanema sea incluido en la familia Molineidae.
Espículas
Se encuentran fuertemente quitinizadas y son huecas. El extremo proximal se asemeja a la cabeza del fémur humano, en donde se insertan los músculos retractores. Asimismo, presentan alas, las cuales se inician en el tercio anterior y son de bordes ondulados (Fig. 4). Cada espícula está formada por dos ramas, la externa que termina rodeada por un proceso membranoso cuticularizado en forma acorazonada, en donde el ala adquiere forma triangular y la rama interna que es delgada y termina en punta, también cubierta por el ala (Fig. 4).
Gubernáculo
Fuertemente quitinizado, de color marrón, y de forma navicular en vista frontal (Fig. 5). En vista lateral se observa que el extremo distal es curvado formando un ángulo obtuso hacia la cara ventral. A la MO, se observa que los machos, en la cara anterior de la cloaca, presentan una membrana bursal accesoria con dos papilas.
Aparato digestivo
El esófago es claviforme. El anillo nervioso se localiza a nivel de la parte media del cuerpo, siendo poco visible.
Aparato genital femenino
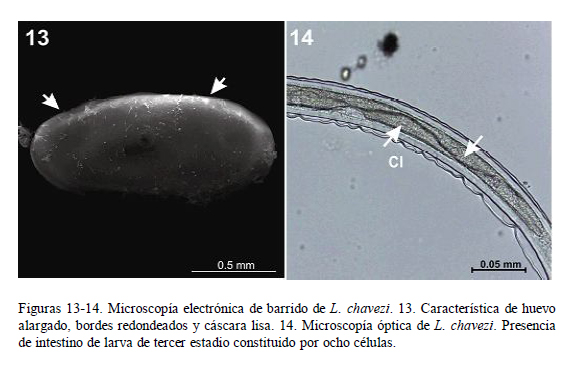
Es didelfo (Fig. 6), presentando dos ramas uterinas con 18 a 24 huevos cada una. El vestíbulo anterior y el posterior tienen diferente tamaño. La vagina vera antecede a la vulva. La vulva presenta labios pequeños y se encuentra a nivel del quinto posterior del cuerpo. Los huevos son alargados, de bordes redondeados y cáscara lisa (Fig. 13), y presentan aproximadamente 17 blastómeros.
Larva
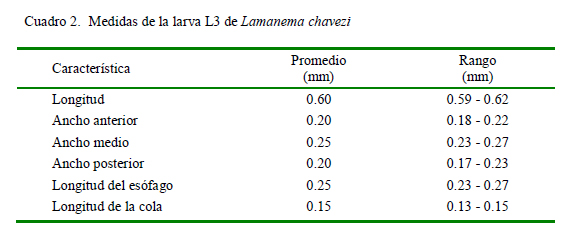
La larva L3 presenta dos alas paralelas en cada campo lateral (Fig. 12) que se extienden a lo largo de la longitud del cuerpo. El intestino está formado por 8 células (Fig. 14).
Descripción Morfológica
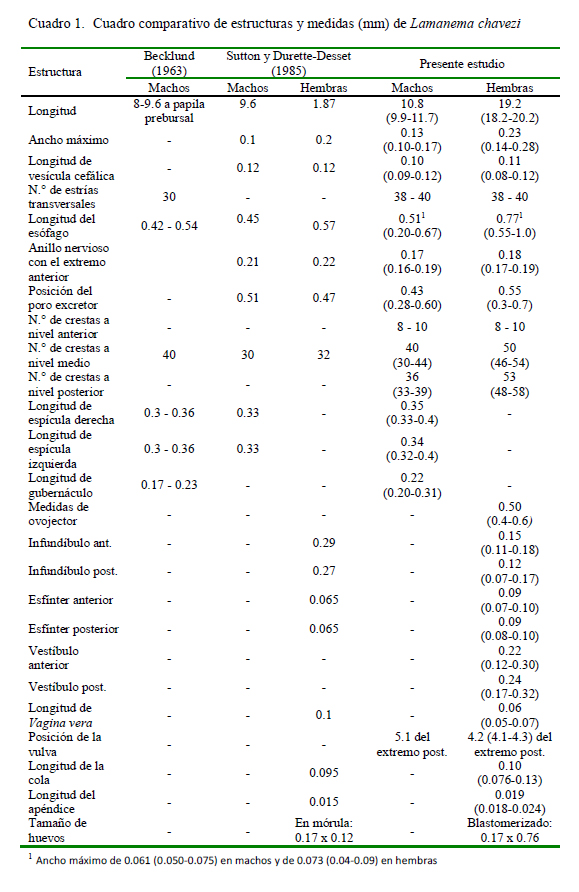
Becklund (1963) estableció medidas de 8 a 9.6 mm de longitud y de 0.15 a 0.18 mm para el diámetro máximo a nivel de la papila prebursal, en base a dos especímenes machos de L. chavezi; en tanto que Sutton y Durette-Desset (1985) anotaron una longitud de 9.6 y 1.9 mm para machos y hembras, respectivamente. En el presente estudio, la longitud promedio fue de 10.8 y 19.2 mm para machos y hembras, respectivamente (Cuadro 1).
Becklund (1963) consideró «cabeza» a la vesícula cefálica con 0.027 a 0.04 mm de ancho, mientras que Sutton y Durette-Desset (1985) calcularon 0.12 x 0.06 mm (largo x ancho) en machos y de 0.12 x 0.05 mm en hembras, siendo esta última medida coincidente con los resultados del presente estudio (Cuadro 1). Asimismo, se encontró más estriaciones transversales de la vesícula cefálica en ambos sexos que las 30 señaladas por Becklund (1963).
La cavidad bucal fue descrita como superficial, con un diente dorsal cónico y dos dientes lateroventrales en la base (Becklund, 1963), en tanto que Sutton y Durette-Desset (1985) la describen como una abertura bucal redondeada con labios y con ausencia de una corona radiada y sin pétalos libres, además de la presencia de un anillo bucal vestigial, dos ánfidos, cuatro papilas labiales externas y cuatro papilas cefálicas. En el presente estudio se observó la presencia de una boca simple triangular, acompañada de un rudimento de corona foliácea que rodea la abertura bucal sin pétalos libres pero sí demarcados y con seis papilas cefálicas en el círculo externo y dos ánfidos como se aprecia en la MEB. Respecto al tamaño del esófago, se encontró una longitud mayor y un ancho máximo diferente a los estudios previos (Cuadro 1), posiblemente debido a las variaciones intraespecíficas. También se observó la presencia de una gran glándula esofágica en el extremo posterior.
La posición del poro excretor coincide con lo señalado por Sutton y Durette-Desset (1985), aún en su posición variable. En cuanto al anillo nervioso, Sutton y Durette-Desset (1985) lo sitúan a 0.21 mm del extremo anterior en machos y a 0.22 mm en hembras, lo cual no coincide con los hallazgos actuales (Cuadro 1), además de ser una estructura poco visible. Los deiridios son descritos por Sutton y Durette-Desset (1985) como estructuras que se sitúan al mismo nivel del anillo nervioso y poro excretor, mientras que el presente estudio fueron estructuras de difícil observación y ubicados 0.2 mm más alejados de lo reportado.
El ancho máximo de L. chavezi coincide con el estudio de Sutton y Durette-Desset (1985) (Cuadro 1). En dicho estudio se describe el sinlophe, indicando que las crestas ventrales son poco más desarrolladas que las dorsales, y aquellas de los campos laterales más pequeñas que nacen en los bordes medianos de la vesícula cefálica y en diferentes niveles a lo largo de los campos laterales, que desaparece por delante de la bolsa caudal en machos y a nivel de la cola en las hembras. En el presente estudio se pudo reconocer el inicio de las crestas así como la interrupción que tienen a diferente altura del cuerpo, por lo que el número de ellas puede variar cuando se observa en cortes transversales.
Becklund (1963) calculó 40 crestas cuticulares en el cuerpo, mientras que Sutton y Durette-Desset (1985) realizando un corte a nivel medio, mencionan un número de 30 crestas en machos y 32 en hembras. En el presente estudio se realizaron cortes en la parte anterior, media y posterior del cuerpo, encontrando un número diferente de crestas en hembras, así como más crestas a nivel medio y posterior, que permite relacionarlo con la interrupción de ellas, y que probablemente estaría relacionada a una especificidad con el hospedador (Digiani y DuretteDesset, 2007).
Las características de la bolsa copulatriz fueron importantes para asignar a este nematodo dentro de la familia Molineidae (Hoberg y Lichtenfels, 1994). Becklund (1963) menciona que presenta dos lóbulos laterales grandes con una superficie finamente estriada y un lóbulo dorsal pequeño, pobremente definido y demarcado por pliegues festoneados u ondulados, lo cual coincide con los resultados aquí presentados. Asimismo, describe a las espículas como estructuras delgadas y amarillentas que disminuyen gradualmente hacia la región distal, bifurcadas hacia el tercio distal con una rama interna afilada de posición interna y otra externa que es larga y gruesa en cuya punta se presenta una expansión membranosa incolora, peque- ña y ovalada, pero no menciona que son aladas. Sutton y Durette-Desset (1985) las describen como estructuras subiguales y aladas que se encuentran subdivididas en la región media en una rama interna, fina y de extremo aguzado y una rama externa, más larga y con una membrana que la rodea a nivel de su extremidad, similar a los hallazgos del presente estudio; sin embargo, se describe, además, que las alas de las espículas son bien desarrolladas y con bordes ondulados que se expanden a manera de paraguas en el extremo distal de la rama más gruesa de la espícula. Las espículas, al igual que el gubernáculo, están fuertemente quitinizadas por lo que se las aprecia de un color marrón amarillento claro. Las medidas señaladas en la literatura son semejantes a las del presente estudio (Cuadro 1).
En relación al aparato genital femenino, las medidas obtenidas coinciden con las del infundíbulo, y vagina vera, cola y apéndice señaladas por Sutton y Durette-Desset (1985); sin embargo, en este trabajo se agregan las medidas del vestíbulo, la descripción de la vagina vera y la vulva, y se resalta la presencia de fásmidos en la cola. Asimismo, se indica por primera vez las medidas del esfínter y del vestíbulo.
Las dimensiones de los huevos de L. chavezi coinciden en la longitud pero difieren en el ancho, aunque dentro de un rango razonable. Los huevos son alargados, de bordes redondeados y cáscara lisa, y si bien tienen medidas semejantes a las de algunas especies de Nematodirus, los de N. spathiger tienen los extremos ligeramente alargados y llevan ocho blastómeros (Leguía y Casas, 1999), en tanto que los de N. lamae tienen los bordes redondeados y la misma cantidad de blastómeros.
El presente estudio es el primero en presentar una descripción detallada de la larva infectiva de L. chavezi (Cuadro 2). Tiene un menor tamaño que la larva de N. spathiger (0.72 a 0.81 mm), presentando, además, una cola bífida, con una estructura terminal en forma de varilla (Anderson 2000). Audebert y Durette-Desset (2007) infectaron a lagomorfos y rumiantes con larvas de varias especies de la superfamilia Molinoidea (Nematodirinae), determinando la presencia de ocho células intestinales en las larvas, coincidiendo con Jarvinen et al. (2014). Esto permite diferenciarlas de larvas de otras superfamilias como Trichostrongyloidea y Heligmosomoidea que presentan 16 y 20 cé- lulas intestinales, respectivamente, lo que apoya firmemente la ubicación de Lamanema dentro de la superfamilia Molinoidea.
Asimismo, estos autores (Audebert y Durette-Desset, 2007; Jarvinen et al., 2014) indicaron que la cola en los estadios L1, L2 y L3 en Nematodirinae son cortas, de punta roma, y forma de látigo, en tanto que la L3 de L. chavezi tiene la cola casi triangular, adelgazándose en forma paulatina. Por otro lado, las características de las alas laterales señaladas por Audebert y Durette-Desset (2007) en el estadio L3 de Molinoidea coinciden con las aquí descritas para L. chavezi.
Es importante mencionar que Becklund (1963) y Sutton y Durette-Desset (1985) estudiaron especímenes de L. chavezi obtenidos de la alpaca y de una vizcacha (Lagidium viscacia boxi) respectivamente, lo que que justificaría las variaciones intraespecíficas con los hallazgos en el presente estudio. Especímenes hembra de L. chavezi en roedores silvestres presentaron una variación sensible en el número de crestas del sinlophe (Digiani y Durette-Desset, 2007), donde los resultados del presente estudio revelan que el número de crestas varía en diferentes partes del cuerpo del nematodo, debido a las interrupciones de las mismas.
El conocimiento del número aproximado de crestas del sinlophe en diferentes partes del cuerpo puede tener una aplicación diagnóstica, porque facilitaría la identificación en cortes histopatológicos. Otro carácter importante a ser considerado en el diagnóstico, es la presencia de la doble ala lateral en el estadio larval L3 (Fig. 12), diferente de las alas en larvas L3 de otras especies (Audebert y Durette-Desset, 2007).
Las papilas ubicadas en la cara dorsal de cada lóbulo lateral de la bolsa copulatríz son estructuras nunca antes observadas en nematodos, las que posiblemente cumplan un papel sensorial a ese nivel. Asimismo, las características de las espículas y de las ramas con su típico borde ondulado facilitarían la identificación de L. chavezi si se contase con estas estructuras. En relación a los rayos de la bolsa copulatríz, Falcón-Ordaz y García-Prieto (2004) señalan que la forma, arreglo y tamaño de los mismos a nivel gené- rico, tienen gran valor taxonómico por las características propias que presentan. Por ejemplo, el rayo 4 corto permite la ubicación de Lamanema dentro de la familia Molineidae y la disposición de los rayos dentro de la subfamilia Molineinae.
CONCLUSIONES
-
Se reportan nuevas estructuras en L. chavezi, y se detallan características de las estructuras previamente descritas.
-
Se presenta información sobre la morfoanatomía del parásito dentro de un ámbito taxonómico.
-
Los hallazgos morfo-anatómicos permiten conocer la relación de este nematodo con otros de su mismo grupo taxonómico, además de su influencia con fines de diagnóstico médico.
LITERATURA CITADA
1. Alcaíno H, Gorman T, Burgos M. 1991. Helmintiasis gastrointestinal en llamas (Lama glama) de la I Región de Chile. Parasitol Día 15: 93-96.
2. Ameghino E, De Martini J. 1991. Mortalidad de crías en alpacas. Lima: IVITA-UNMSM. 128 p.
3. Anderson RC. 2000. Nematode parasites of vertebrates, their development and transmission. 2nd ed. Wallingford: CAB International. 650 p.
4. Audebert F, Durette-Desset MC. 2007. Do lagomorphs play a relay role in the evolution of the Trichostrongylina nematodes? Parasite 14: 183-197. doi: 0.1051/parasite/2007143183
5. Becklund W. 1963. Lamanema chavezi gen. sp. n. and Nematodirus lamae sp. n. (Nematoda: Trichostrongylidae) from the alpaca, Lama pacos, and the vicu- ña, Vicugna vicugna, in Peru. J Parasitol 49: 1023-1027.
6. Brown BW. 2000. A review on reproduction in South American camelids. Anim Reprod Sci 58: 169-195. doi: 10.1016/S0378-4320(99)00081-0
7. Cafrune MM, Aguirre DH, Rickard LG. 2001. First report of Lamanema chavezi (Nematoda: Trichostrongyloidea) in llamas (Lama glama) from Argentina. Vet Parasitol 97: 165-168. doi: 10.1016/S0304-4017(01)00379-X
8. Cafrune MM, Marín R, Rigalt F, Romero S, Aguirre D. 2009. Lamanema chavezi (Nematoda: Molineidae): epidemiological data of the infection in South American camelids of Northwest Argentina. Vet Parasitol 166: 321-325. doi: 10.1016/j.vetpar.2009.09.008
9. Chávez CE, Guerrero CA, Alva J, Guerrero J. 1967. Parasitismo gastrointestinal en alpacas. Rev Fac Med Vet UNMSM 21: 9-19.
10. Digiani MC, Durette-Desset MC. 2007. Trichostrongylina (Nematoda) parasitic in Phyllotis sp. (Rodentia: Sigmodontinae) from Argentina, with description of three new species. Parasitol Int 56: 9-18. doi: 10.1016/ j.parint.2006.10.001
11. Durette-Desset MC, Chabaud AG. 1977. Essai de classification des nematodes Trichostrongyloidea. Ann Parasit Hum Comp 52: 539-558.
12. Durette-Desset MC. 1978. Nouvelles donnees morphologiques sur des nematodes Trichostrongyloides des collections du United States National Museum. B Mus Natl Hist Nat 352: 135-147.
13. Durette-Desset MC. 1983. Commonwealth Institute of Helminthology Keys to the Nematode Parasites of Vertebrates. En: Anderson RC, Chabaud AG (eds). Keys to genera of the superfamily Trichostrongyloidea. UK: Farnham Royal. p 1-86.
14. Durette-Desset MC. 1985. Trichostrongyloid nematodes and their vertebrate hosts: reconstruction of the phylogeny of a parasitic group. Adv Parasitol 24: 239- 306. doi: 10.1016/S0065-308X(08)60564-3
15. Falcón-Ordaz J, García-Prieto L. 2004. Análisis morfológico de algunos Tricostrongilinos (Strongylida) depositados en la Colección Nacional de Helmintos del Instituto de Biología, UNAM, México DF. Rev Biol Trop 52: 377-386.
16. Fernández-Baca S. 2005. Situación actual de los camélidos sudamericanos en Perú. Proyecto de cooperación técnica en apoyo de la crianza y aprovechamiento de los camélidos sudamericanos en la región andina TCP/RLA/2914. Lima: FAO. 62 p.
17. [FAO] Organización de las Naciones Unidas para la Agricultura y la Alimentación. 2005. Situación actual de los camélidos sudamericanos en Chile. Chile: Informe Técnico FAO. 62 p.
18. Guerrero CA, Alva J, Vega I, Hernández J, Rojas M. 1973. Algunos aspectos biológicos y patológicos de Lamanema chavezi en alpacas, Lama pacos. Rev Inv Pec 2: 29-42.
19. Hoberg EP, Lichtenfels JR. 1994. Phylogenetic systematic analysis of the Trichostrongylidae (Nematoda), with an initial assessment of coevolution and biogeography. J Parasitol 80: 976-996.
20. Hoberg EP, Lichtenfels J, Rickard L. 2005. Phylogeny for genera of Nematodirinae (Nematoda: Trichostrongylina). J Parasitol 91: 382-389.
21. Jarvinen JA, Whitley EM, Kreuder AJ, Scheleining JA. 2014. Identification of Lamanema chavezi Becklund 1963 infection in a llama (Lama glama) in the United States. J Vet Diagn Invest 26: 178-183. doi: 10.1177/ 1040638713516626
22. Jiménez P, Evelyn C, Espada M, Vázquez C. 2010. Camélidos sudamericanos: clasificación, origen y características. Rev Complutense Cienc Vet 4: 23-36.
23. Leguía G, Casas E. 1999. Enfermedades parasitarias y atlas parasitológico de camélidos sudamericanos. Lima: Ed del Mar. 190 p.
24. McKenna PB. 2006. Register of new host-parasite records. Surveillance 33(4): 6-7.
25. McKenna PB, Morley C, Koning M, Tahana JS, Taylor MJ. 2009. Confirmation of the occurrence of the nematode parasite Lamanema chavezi Becklund, 1963 in South American camelids in New Zealand. N Z Vet J 57: 395-396. doi: 10.1080/00480169.2009. 64736
26. Ortiz S. 1988. Evaluación de algunos métodos de control de la mortalidad en crías de alpaca (Lama pacos) en explotaciones familiares. Tesis de Médico Veterinario Zootecnista. Lima: Univ Nacional Mayor de San Marcos. 45 p.
27. Raggi LA. 2005. Situación actual de los camélidos sudamericanos en Chile. Proyecto de cooperación técnica en apoyo a la crianza y aprovechamiento de los camélidos sudamericanos en la región andina. TCP/RLA/2914. Santiago: FAO. 72 p.
28. Rickard LG, Hoberg EP. 2000. Reassignment of Lamanema from Nematodirinae to Molineinae (Nematoda: Trichostrongyloidea). J Parasitol 86: 647-650.
29. Rojas CM. 1990. Parasitismo de los rumiantes domésticos, terapia, prevención y modelos para su aprendizaje. Lima: Maijosa 50 p.
30. Sharpe MS, Lord LK, Wittum TE, Anderson DE. 2009. Pre-weaning morbidity and mortality of llamas and alpacas. Aust Vet J 87: 56-60. doi: 10.1111/j.1751-0813.2008.00377.x
31. Spörndly E, Nissen AM. 2008. Prevalence of parasites in llamas in the Andean Bolivia. MSc Thesis. Denmark: University of Copenhagen. 70 p.
32. Sumar J. 1991. Características de las poblaciones de llamas y alpacas en la sierra sur del Perú. Informe de la Mesa Redonda Sobre Camélidos Sudamericanos. FAO: Chile. p 71-78.
33. Sutton CA, Durette-Desset MC. 1985. Contribución al conocimiento de la fauna parasitológica Argentina. XIV. Presencia de Lamanema chavezi Becklund, 1963 (Nematoda, Molineidae, Nematodirinae) parásito de camélidos en Lagidium viscacia boxi. Bull Mus Natn Hist Nat 7: 791-794.
34. Travassos L. 1950. Introdução ao estudo da Helmintologia. Rev Brasil Biol. 173 p.
35. Wheeler JC. 1995. Evolution and present situation of the South American Camelidae. Bio J Lima Soc 54: 271-295. doi: 10.1111/j.1095-8312.1995.tb01037.x
Recibido: 24 de julio de 2014
Aceptado para publicación: 19 de diciembre de 2014