Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.26 no.2 Lima abr. 2015
http://dx.doi.org/10.15381/rivep.v26i2.11093
http://dx.doi.org/10.15381/rivep.v26i2.11093
Expresión de Defensinas en Yeyuno de Crías de Alpacas (Vicugna pacos) con Enteropatías
Expression of defensins in the jejunum of newborn alpacas (Vicugna pacos) with enteropathies
Juan Siuce M.1, Alberto Manchego S.1,4, Nieves Sandoval C.2 , Juan More B.1, Kim-Lam Chiok C.1, Danilo Pezo C.3, Hermelinda Rivera G.1
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Laboratorio de Histología, Embriología y Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
3 Centro de Investigación IVITA, La Raya-Maranganí, Cusco, Perú
4 E-mail: amanchegos@unmsm.edu.pe
RESUMEN
El objetivo del presente estudio fue determinar la expresión de péptidos antimicrobianos (αy β-defensinas) en el epitelio intestinal de crías de alpaca de 1 a 6 semanas de edad y con enteropatías, mediante la cuantificación relativa de ARN mensajeros (ARNm) de las α (defa 8) y β (β def alp) defensinas. Se tomaron dos porciones de yeyuno de 2 cm de longitud de 29 crías de alpacas con signos de diarrea. Una porción se procesó para el análisis histopatológico utilizando la tinción hematoxilina-eosina para determinar el tipo de enteropatía. De la otra porción se obtuvo el ARNm total de los raspados yeyunales, que sirvió de molde para la síntesis de cDNA mediante transcripción reversa (RT), seguido de un PCR en Tiempo Real, para la amplificación y detección de las defensinas. La cuantificación relativa de ARNm se realizó mediante el método 2-ΔΔCt. Las crías enfermas mostraron una expresión de α-defensina (Defa 8) correspondiente a 18.15 veces lo expresado por el animal recién nacido o calibrador. La expresión de la β-defensina (β-def alp) correspondió a 258.29 veces lo expresado por el calibrador, y con diferencia significativa (p<0.05), tanto en Defa 8 y β-def alp, al compararlos con un grupo de crías de alpacas sanas criadas en similares condiciones de un estudio previo. Los resultados demuestran que las αy β-defensinas entéricas son inducidas de manera significativa durante cuadros entéricos en las alpacas.
Palabras clave: alpacas, péptidos antimicrobianos, defensinas, PCR, RT-PCR tiempo real
ABSTRACT
The aim of this study was to determine the expression of antimicrobial peptides (αand β-defensins) in the intestinal epithelium of newborn alpaca (1 to 6 weeks of age) with enteropathies, using the relative quantification of messenger RNA (mRNA) of the α (Defa 8) and β (β def alp) defensins. Two portions of the jejunum (2 cm) were collected from 29 newborn alpaca with signs of diarrhea. One portion was processed for histological analysis using hematoxylin-eosin staining to determine the type of enteropathy. The second portion was used to obtain total mRNA from jejunal scrapings, which served as template for cDNA synthesis by reverse transcription (RT), followed by a Real-Time PCR for the amplification and detection of defensins. The relative quantification of mRNA was performed using 2-ΔΔCt method. The sick newborn showed an expression of α-defensin (Defa 8) corresponding to 18.15 times as expressed by the newborn animal or calibrator and the expression of β-defensin (β-def alp) corresponded to 258.29 times as expressed by the calibrator. Statistical difference was found (p<0.05) in both Defa 8 and β-def alp expression of sick newborn when compared with a group of young healthy alpacas raised in similar conditions in a previous study. The results showed that αand β-enteric defensins are induced significantly during enteric diseases in alpacas.
Key words: alpacas, antimicrobial peptides, defensins, PCR, real-time RT-PCR
INTRODUCCIÓN
Los seres vivos están expuestos a una gran variedad de organismos patógenos a través de la vía digestiva y respiratoria. Las alpacas y llamas presentan altas tasas de morbilidad y mortalidad en los primeros meses de vida, pudiéndose diferenciar la mortalidad perinatal (0-7 días de edad), la mortalidad neonatal (hasta los 30 días de edad) y la mortalidad de crías mayores de un mes hasta el destete (6 a 8 meses de edad); y causada principalmente por bacterias y virus (Ameghino y DeMartini, 1991). La inmunidad innata juega un papel importante en la defensa frente a estos microorganismos, siendo el intestino un importante órgano del sistema inmune de mucosas conformado por una compleja red celular (Yuan y Walker, 2004), con capacidad de reconocer antígenos para desarrollar una respuesta celular reguladora o efectora a través de sus secreciones como son las citoquinas, enzimas y péptidos antimicrobianos (Bailey y Haverson, 2006).
Las defensinas son una gran familia de péptidos antimicrobianos, cuya expresión está extendida en todos los mamíferos (Ganz, 2003). Son polipéptidos de 29 a 50 aminoácidos conformados principalmente por arginina y lisina, y que poseen una acción antimicrobial que incluye a bacterias, hongos, parásitos y virus (Sahl et al., 2005). Sus determinantes estructurales, como la carga, conformación, ángulo polar, amfipaticidad e hidrofobicidad, están directamente relacionadas con la forma de interacción y acción con los diversos microorganismos (Yeaman y Yount, 2003). Asimismo, se ha podido establecer dos principales formas de ejercer su función a través de experimentos que se han enfocado sobre la interacción de péptidos catiónicos con sistemas de modelos de membranas, cuyo efecto es la alteración de la permeabilidad; y péptidos con actividad intracelular, interrumpiendo principales procesos metabólicos (Giuliani et al., 2007; Laverty et al., 2011).
Las alpacas, en especial las crías, son susceptibles a sufrir procesos entéricos de diversos agentes infecciosos que ingresan a nivel de la mucosa intestinal, induciendo una respuesta inmune a este nivel. Estudios recientes han determinado la presencia y expresión de los genes de las αy β-defensinas en muestras de mucosa intestinal y sangre de alpacas. La detección genómica de la αdefensina de alpaca, denominada Defa 8, se hizo a través de un estudio comparativo de genes de α-defensinas en roedores y humanos, mientras que la β-defensina, β-def alp, demostró tener un alto grado de identidad con otras secuencias de defensinas filogenéticamente relacionadas (More et al., 2011).
En el presente estudio se evalúa la respuesta de expresión de estas defensinas frente a enteropatías que sufren las crías de alpacas en las primeras semanas de vida.
MATERIALES Y MÉTODOS
Animales y Muestras
Se seleccionaron crías de alpacas de 1 a 6 semanas de edad de las variedades Suri y Huacaya, de ambos sexos, que presentaban signos clínicos de enteropatías: diarrea, heces sanguinolentas, timpanismo, dolor abdominal, depresión, muerte súbita; y donde se confirmó por histopatología la presencia de la alteración de la estructura normal del yeyuno. Los animales (n=29) eran del distrito de Maranganí, provincia de Canchis, departamento de Cusco, Perú.
Los animales seleccionados habían fallecido horas antes o se encontraban moribundos. Se recolectaron muestras de intestino en la necropsia. Se obtuvieron dos cortes de 2 cm de longitud del yeyuno por cada alpaca. Las secciones fueron lavadas en suero fisiológico estéril al 0.9% para retirar el contenido intestinal. Uno de los cortes se almacenó en nitrógeno líquido a -196 ºC para la evaluación y el segundo corte se conservó en formol al 10% para la evaluación histopatológica.
Evaluación Histopatológica
Los cortes fueron procesados con el método convencional para la coloración de hematoxilina-eosina (H-E). Deshidratados a través de sucesivas inmersiones en alcohol etílico a diferentes concentraciones, aclaradas en xilol, sumergidos en parafina líquida, y colocados en refrigeración hasta lograr su solidificación. Se hicieron los cortes con ayuda de un micrótomo en secciones de 5 µm de espesor y coloreadas con H-E para su lectura (Kiernan, 1999).
Evaluación Molecular
Las muestras de tejido fueron descongeladas desde -196 a -20 ºC, transportándolos del tanque de nitrógeno a una congeladora de -20 °C. Luego de 4 horas se les llevó a 4 ºC. Se hizo un raspado profundo de la mucosa de los segmentos de intestino con hoja de bisturí. El raspado fue diluido en 1 ml de suero fisiológico estéril y centrifugado a 3000 rpm por 5 min. Se eliminó el sobrenadante y se repitió el paso anterior. El pellet fue reconstituido en 500 µl de agua libre de nucleasas.
Expresión de gliceraldehido 3 fosfato deshidrogenasa (GAPDH)
Las muestras se trabajaron mediante la técnica de reacción en cadena de la polimerasa con transcriptasa inversa (RTPCR) utilizando un set de cebadores específicos para el gen constitutivo GAPDH (F: 5’GTGAAGGTCGGAGTGAACG3’; R: 5’GAGATGATGACCCTCTTGGC3’), el cual fue usado como control interno o endógeno de las muestras.
Expresión de αy β-defensinas
En la evaluación de la expresión de αy β-defensinas, los ARN mensajeros totales se obtuvieron con el kit PureLink™ Micro-toMidi Total RNA Purification System (PROMEGA). Estos ARN mensajeros totales fueron empleados como molde para la síntesis de cDNA mediante el kit SuperScript® III First-Strand Synthesis SuperMix (Invitrogen, EEUU). El cDNA obtenido sirvió de molde para la reacción de PCR.
El RT-PCR en tiempo real se hizo en un termociclador equipado con un monitor de detección de fluorescencia (MJ Research – BioRad), usando el agente intercalante «sybr green». Se emplearon los cebadores diseñados por Patil et al. (2004), provenientes de α-defensinas en roedores y humanos, que fueron utilizados por More et al. (2011) para la detección y expresión genómica de la αdefensina, Defa 8, en alpacas (Vicugna pacos):
-
Defa8 FW: GAAGACACTTG TCCTCC TTTCTG
-
Defa8 RV: AATAGACCTGGACGA CAG GACC
Se emplearon oligonucleótidos diseñados por More et al. (2011) mediante el programa Primer3 Output y Primer Blast a partir de secuencias publicadas en el Banco de Genes (GenBank) para bovinos (acceso: AF016539.1), utilizados para la detección y expresión genómica de β-defensina (βdef alp):
-
Beta entérica FW: TCCATAGATGGGACA CAGCA
-
Beta entérica RV: TCCTCTCTTCCTGC CACTGT
Se consideraron como muestras positivas en el RT-PCR tiempo real con el set de cebadores Defa 8 y βdef alp aquellas con una clara curva de amplificación y una curva de disociación única sin ruido de fondo que representen productos inespecíficos.
Cuantificación relativa αy β-defensinas
La cuantificación relativa de αy βdefensinas (Defa 8 y βdef alp) se hizo con el método Delta Delta Ct (ΔΔCt), llamado también método Ct comparativo (Livak y Schmittgen, 2001; Pfaffl, 2001). El método se basa en el análisis comparativo de los Cts de las muestras y comparados con el Ct de un control endógeno, el set de cebadores
GAPDH. Este es el más usado por su poca variabilidad y expresión constante en distintos tipos celulares (Walker et al., 2009). Los resultados son presentados como cantidades en número de veces con respecto a un calibrador (generalmente un individuo de la muestra con cantidades basales de expresión del gen a analizar), considerando como tal, animales de 0 días de edad.
Análisis Estadístico
En la comparación entre grupos de enfermos (enteropatías) con sanos, se utilizó el estudio realizado por More et al. (2011), en el cual se evaluó la expresión relativa de las αy β-defensinas (Defa 8 y βdef alp) en crías de alpacas sanas, por ser animales procedentes de la misma área de crianza, misma época de muestreo y con las mismas condiciones ambientales.
La diferencia de expresión de ambas defensinas entre los grupos sanitarios se analizó mediante la prueba de T de Student. Para evaluar la diferencia de expresión entre los grupos etarios se utilizó el análisis de varianza de un factor y la prueba de comparación múltiple de Tukey para identificar grupos diferentes. Los datos se procesaron mediante el paquete estadístico STATA v. 11.0, estableciendo la significación estadística en 0.05.
RESULTADOS
Histopatología
La lesión histológica más frecuente fue la enteritis necrótica difusa aguda, presente en 27 animales. En ellas se pudo determinar la presencia de agentes infecciosos, tanto bacterias (n=23) como parásitos (n=4), siendo estos Eimeria spp (n=2) y Cryptosporidium spp (n=2). En las otras dos muestras, una resultó con enteritis catarral difusa aguda y la otra con calcificación distrófica.
Expresión de GAPDH
Todas las muestras (29/29) tuvieron un Ct (ciclo umbral) antes de los 40 ciclos de amplificación, donde el rango de valores fue de 27.05 a 32.24.
La temperatura de disociación (Tm) de los productos (único por animal) indicó la presencia de dos tipos de productos específicos en la población muestreada. El primero con una Tm entre 83.0 y 83.9 ºC y el segundo entre 80.9 y 81.5 ºC.
Expresión de Defa 8 (α-defensina)
El análisis mostró curvas de amplificación con un Ct entre 30.28 y 36.33 (Fig. 1) con un promedio de 34.08. El análisis de la curva de disociación mostró un pico único, con un leve ruido de fondo y una temperatura de disociación entre 80.3 y 85.6 ºC.
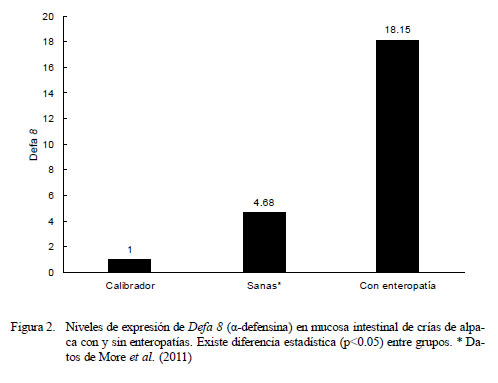
Cuantificación Relativa de Defa 8 (αdefensina)
Los niveles promedio de expresión de Defa 8 fueron mayores en el grupo de crías con enteropatías frente al grupo de crías sanas del estudio de More et al. (2011) en relación a los animales de cero días de edad que no consumieron calostro (calibrador). Las crías enfermas mostraron una expresión promedio de Defa 8 correspondiente a 18.15 veces lo expresado por el calibrador, mientras que las crías sanas expresaron 4.68 veces lo expresado por el calibrador (Fig. 2, p<0.05).
Al contrastar la expresión de Defa 8 del grupo de animales sanos con aquellos con enteropatías se evidenciaron dos cinéticas de expresión hasta la sexta semana. En los animales sanos se observó una tendencia creciente seguida de una caída sostenida, mientras que la cinética en los enfermos no parece seguir una tendencia definida (Cuadro 1). No se encontró diferencia estadística en la expresión de Defa 8 entre los grupos etarios de los animales sanos ni entre los grupos etarios de los enfermos, pero existe diferencia entre el grupo de crías sanas y enfermas en las semanas 4 y 6 de edad (p<0.05).
Expresión de β-def alp (β-defensina)
Los resultados en la expresión de β def Alp mostraron la amplificación de un producto único, específico, el cual se representa como un pico de disociación único y claro en el gráfico de la curva de disociación. Asimismo, las curvas de amplificación tuvieron un rango de 26.43 a 33.88 con un promedio de 29.37 (Fig. 3).
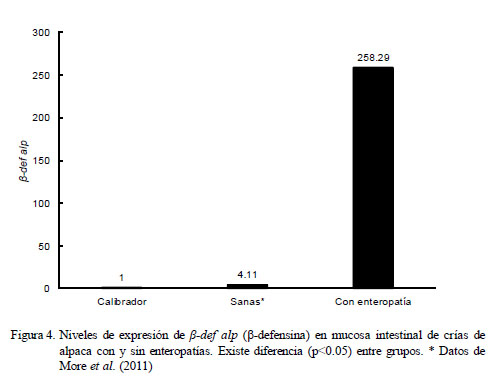
Cuantificación Relativa de β-def alp (βdefensina)
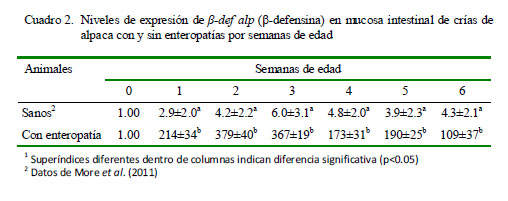
Los resultados de la cuantificación relativa demostraron que los niveles promedio de expresión de β-def alp fueron mayores en el grupo de crías con enteropatías frente al grupo de crías sanas en relación a los animales de cero días de edad que no consumieron calostro (calibrador). Las crías enfermas mostraron una expresión de β-def alp correspondiente a 258.29 veces lo expresado por el calibrador, mientras que las crías sanas expresaron sólo 4.11 veces lo expresado por el calibrador (Fig. 4, p<0.05).
Al contrastar la expresión de β-def alp del grupo de animales sanos con aquellos con enteropatías se evidenciaron dos cinéticas de expresión hasta la sexta semana. En los animales sanos se observó una tendencia creciente seguida de una caída sostenida, mientras que la cinética en los enfermos no parece seguir una tendencia definida (Cuadro 2). Se encontraron diferencias significativas (p<0.05) en la expresión entre grupos según el grupo etario.
DISCUSIÓN
Los productos de GAPDH y las αy βdefensinas (Defa 8 y β-def alp, respectivamente) tienen Tm similares y dentro del rango obtenidos en crías de alpacas sanas (More et al., 2011), demostrando que se detectan los mismos ARNm en ambos estudios.
Existe una mayor cantidad de ARNm de αy β-defensinas (p<0.05) en el grupo con enteropatías en comparación a los animales sanos, indicando un aumento de la expresión de los genes de las defensinas estudiadas en las alpacas. Similarmente, en otros mamíferos se indica que la expresión de los genes de defensinas son inducidos por la estimulación de productos y componentes de los agentes microbianos como virus, hongos, parásitos y, principalmente, bacterias (Bevins, 2005). Se ha demostrado que ambas defensinas (Defa 8 y β-def alp) son expresadas en el epitelio intestinal de las crías de alpacas en distintas edades (More et al., 2011), y aquí se demuestra que su expresión se induce como respuesta a la infección de microorganismos patógenos, sirviendo como protección, y siendo una de las primeras respuestas del sistema inmune innato.
Las células de diversos tejidos celulares poseen los genes de las defensinas y receptores celulares que inician las señales celulares para la expresión de estos genes; sin embargo, no todos los tipos celulares expresan todas las defensinas o determinados tipos de receptores celulares como los TLRs y NOD específicos para cada tipo de microorganismo. Las células epiteliales son altas productoras de β-defensinas (Dürr y Peschel, 2002). Las muestras trabajadas contienen los diversos tipos celulares presentes en la mucosa intestinal de las crías de alpacas, incluyendo las células de Paneth que son las mayores productoras de α-defensinas, debido a que se obtuvieron de un raspado profundo de la mucosa; por lo que las cantidades obtenidas de las defensinas representan el total de todas ellas. Por otro lado, en los tejidos de los animales con enteropatías se encuentran bastantes leucocitos, que han migrado desde los vasos sanguíneos a la mucosa intestinal constituyendo un componente celular de los tejidos inflamados, contribuyendo a la mayor expresión de α-defensinas que se expresan en este tipo de células inflamatorias (Ganz, 2003).
Las enteropatías que se observan en las crías de alpacas fueron mayormente enteritis necrótica difusa aguda, las cuales pueden ser producidas por los agentes infecciosos de mayor prevalencia en la zona, entre ellos, Clostridium perfringes, Escherichia coli, Cryptosporidium sp, Giardia sp y coccidias (Palacios et al., 2005; Martín et al., 2010). Últimamente se ha determinado la presencia de rotavirus y coronavirus como patógenos virales asociados a diarreas en alpacas (Genova et al., 2008). Esta diversidad de patógenos son capaces de estimular la respuesta inmune innata en la mucosa intestinal induciendo la expresión de péptidos antimicrobianos (defensinas) como se ha determinado en otros animales domésticos (Montaño y Vargas, 2002). Asimismo, se ha demostrado una estimulación por la presencia de lipoproteínas o ácidos teicoicos de Gram-positivos, LPS de Gram-negativos, βglucanos de levaduras, ácidos nucleicos virales y otros patrones moleculares asociados a patógenos, a través de la interacción de sus receptores celulares, que inician una cascada de señalización que finaliza con la activación del factor nuclear NF-kB y la consecuente transcripción de los genes que codifican las defensinas (Montaño y Vargas, 2002; Tellez y Castaño, 2010), por lo que existe una asociación directa entre la presencia de patógenos y la inducción de las αy βdefensinas, tal y como se observa en el presente estudio.
Las crías de alpaca enfermas muestran diferentes niveles de expresión relativa por grupo etario, tanto para αcomo para βdefensinas (Defa 8 y β-def alp, respectivamente); sin embargo, no existe diferencia significativa entre grupos, debido posiblemente a que la expresión individual podría ser similar por los siguientes factores: grado de estimulación o carga antigénica, naturaleza del patógeno o microorganismo implicado en la infección, y cantidad de células de Paneth y enterocitos, siendo proporcional la respuesta inmune innata contra patógenos con la interacción específica de patrones moleculares de microorganismos a través de receptores tipo TLRs que desencadena la comunicación celular y la activación de NFkB y la secreción de citoquinas inflamatorias y péptidos antimicrobianos (defensinas). Existe una correlación del incremento de ARNm con la estimulación bacteriana (Palazzo et al., 2007).
Al contrastar la expresión de ambas defensinas en los dos grupos de animales se evidenciaron dos cinéticas de expresión. En la α-defensina (Defa 8) no se encontró diferencia significativa entre crías sanas y enfermas en todos los grupos etarios, a excepción de la cuarta y sexta semana de edad. Si bien, los valores de ARNm de α-defensina (Defa 8) son relativamente mayores, esta diferencia no es tan evidente inicialmente debido a que las α-defensinas son expresadas en bajos niveles durante la etapa fetal y del neonato. Estos niveles de expresión se pueden incrementar gradualmente en condiciones de enfermedad; sin embargo, no alcanzan valores tan altos como aquellos de las β-defensinas, debido a que las α-defensinas en mamíferos son expresadas únicamente por polimorfonucleares y células de Paneth (Bevins, 2005).
A diferencia de la α-defensina (Defa 8), la β-defensina (β-def alp) tuvo niveles de expresión bastante elevados determinando una diferencia significativa en todos los grupos etarios. Las β-defensinas en el intestino no solo son expresadas por células típicas productoras de defensinas, como las células de Paneth y los linfocitos intraepiteliales, sino que su expresión también se realiza por las diversas células epiteliales que forman parte de la mucosa (Montaño y Vargas, 2002; Patil et al., 2004). Además, los péptidos antimicrobianos se sintetizan hasta 100 veces más rápido que una inmunoglobulina y a mucho menor costo metabólico, almacenándose en altas concentraciones y estando disponible para ser liberadas en contacto con microorganismos (Montaño y Vargas, 2002). En las crías ocurren variaciones en la alimentación, donde el consumo de leche disminuye mucho y se inicia la nutrición sustentada en ácidos grasos volátiles, disminuyendo la presencia de elementos nutricionales, pudiendo originarse fallas o anergia inmunológica (Gombart, 2009).
CONCLUSIONES
La expresión relativa de α y β defensinas (Defa 8 y β-def alp, respectivamente) en yeyuno son significativamente mayores en crías de alpaca con enteropatías en comparación a las crías sin esta condición.
Agradecimientos
Los autores agradecen al técnico Vicente Mercado por el apoyo brindado. El trabajo se ejecutó bajo el financiamiento del Proyecto 065FINCyT-PIBAP-2008.
LITERATURA CITADA
1. Ameghino E, DeMartini J. 1991. Mortalidad en crías de alpacas. Bol Div IVITA-UNMSM. Lima. p 71-80.
2. Bailey M, Haverson K. 2006. The postnatal development of the mucosal immune system and mucosal tolerance in domestic animals. Vet Res 37: 443453. doi: 10.1051/vetres:2006013
3. Bevins C. 2005. Events at the hostmicrobial interface of the gastrointestinal tract. V. Paneth cell α-defensins in intestinal host defense. Am J Physiol-Gastr L: G173-G176.
4. Dürr M, Peschel A. 2002. Chemokine meet defensin: the merging concepts of chemoattractants and antimicrobial peptides in host defense. Infect Immun 4: 615-617. doi: 10.1128/IAI.70.12.65156517.2002
5. Ganz T. 2003. The role of antimicrobial peptides in innate immunity. Integr Comp Biol 43: 300-304. doi: 10.1093/icb/43.2.300.
6. Genova S, Streeter R, Simpson KM, Kapil S. 2008. Detection of an antigenic group 2 coronavirus in an adult alpaca with enteritis. Clin Vaccine Immunol 15: 1629-1632. doi: 10.1128/CVI.00232-08
7. Giuliani A, Pirri G, Nicoletto S. 2007. Antimicrobial peptides: an overview of a promising class of therapeutics. Cen Eur J Biol 2(1): 1-33. doi: 10.2478/ s11535-007-0010-5
8. Gombart AF. 2009. The vitamin Dantimicrobial peptide pathway and its role in protection against infection. Future Microbiol 4: 1151-1165. doi: 10.2217/ fmb.09.87
9. Kiernan J.A. 1999. Histological and histochemical methods: theory and practice. 3rd ed. Oxford, UK: Butterworth-Heinemann. 502 p.
10. Laverty G, Gorman S, Gilmore B. 2011. The potential of antimicrobial peptides as biocides. Int J Mol Sci 12: 6566-6596. doi: 10.3390/ijms12106566
11. Livak K, Schmittgen T. 2001. Analysis of relative gene expression data using real time quantitative PCR and the 2(Delta Delta C(T)) method. Methods 25: 402-408. doi: 10.1006/meth.2001.1262
12. Martin C, Pinto C, Cid M. 2010. Camélidos sudamericanos: estado sanitario de sus crías. RCCV 4(1): 37-50.
13. Montaño K, Vargas F. 2002. Péptidos antimicrobianos: un mecanismo de defensa ancestral con mucho futuro. Interciencia 27(1): 21-27.
14. More J, Manchego A, Sandoval N. Ramirez M, Pezo D, Chiok K, Rivera H. 2011. Detección genómica y expresión de péptidos antimicrobianos (αy βdefensinas) en mucosa intestinal de crías de alpaca (Vicugna pacos). Rev Inv Vet Perú 22: 324-335. doi: 10.15381/ rivep.v22i4.332
15. Palacios C, Perales R, Chavera A. 2005. Caracterización anátomo-histopatológica de enteropatías causantes de mortalidad en crías de alpaca. Rev Inv Vet Perú 16: 34-40.
16. Palazzo M, Balsari A, Rossini A, Selleri S, Calcaterra C, Gariboldi S, Zanobbio L, et al. 2007. Activation of enteroendocrine cells via TLRs induces hormone, chemokine, and defensin secretion. J Immunol 178: 4296-4303.
17. Patil A, Hughes A, Zhang G. 2004. Rapid evolution and diversification of mammalian α-defensins as revealed by comparative analysis of rodent and primate genes. Physiol Genomics 20: 1-11. doi: 10.1152/physiolgenomics.00150.2004
18. Pfaffl M. 2001. A new mathematical model for relative quantification in real time RT-PCR. Nucleic Acids Res 29: 2002-2007.
19. Sahl HG, Pag U, Bonness S, Wagner S, Antcheva N, Tossi A. 2005: Mammalian defensins: structures and mechanism of antibiotic activity. J Leukoc Biol. 77: 466-475.
20. Téllez G, Castaño J. 2010. Antimicrobial peptides. Infectio 14(1): 55-67.
21. Walker C, Meier S, Mitchell M, Roche J, Littlejohn M. 2009. Evaluation of real-time PCR endogenous control genes for analysis of gene expression in bovine endometrium. BMC Mol Biol 10: 1186-1198. doi: 10.1186/1471-2199-10-100
Recibido: 6 de marzo de 2014
Aceptado para publicación: 17 de diciembre de 2014