Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.26 no.3 Lima set. 2015
http://dx.doi.org/10.15381/rivep.v26i3.11188
http://dx.doi.org/10.15381/rivep.v26i3.11188
Efecto de Cuatro Métodos de Separación Seminal sobre la Calidad y la Capacidad Fertilizante in vitro de Espermatozoides Equinos Criopreservados
Effect of Four Sperm Separation Methods on Quality and in vitro Fertilizing Capacity of Cryopreserved Stallion Spermatozoa
Elizabeth Varela G.1, Juan Esteban Duque C1, Mónica Ramírez H.1, Daniel Ocampo V. 1, Juan David Montoya P.1, Giovanni Restrepo B. 1,2
1 Grupo de Investigación en Biotecnología Animal, Politécnico Colombiano Jaime Isaza Cadavid,Bello, Antioquia, Colombia
2 E-mail: grestrepo@elpoli.edu.co
Resumen
El objetivo del presente estudio fue evaluar el efecto de cuatro métodos de separación seminal sobre la calidad y la capacidad fertilizante in vitro de espermatozoides equinos criopreservados. Se utilizaron pajillas de semen equino criopreservado para la separación espermática a través de los métodos Androcoll, CushionFluid, EquiPure y Percoll. Mediante un sistema analizador de clase (SCA®) se evaluó la motilidad total, motilidad progresiva, velocidad curvilínea, velocidad lineal y velocidad media, y por microscopía de fluorescencia se determinaron los acrosomas intactos y la vitalidad espermática. La evaluación de la capacidad fertilizante in vitro se realizó mediante la fertilización in vitro de oocitos bovinos con espermatozoides obtenidos en cada método de separación. El clivaje se determinó después de tres días de cultivo in vitro. Los resultados se analizaron mediante modelos lineales generalizados (GLM) y las medias para los diferentes métodos se compararon usando la prueba de Tukey. El CushionFluid fue superior para la mayoría de parámetros de movilidad espermática, así como para acrosomas intactos (p<0.05). Se encontraron medias superiores de vitalidad espermática para EquiPure y Percoll (p<0.05), pero no se encontró diferencia entre las medias de clivaje entre tratamientos. Se concluye que el semen equino criopreservado y seleccionado por el método CushionFluid presenta mejores parámetros de calidad espermática respecto a los otros tres métodos; sin embargo, no se evidencia diferencia entre ellos para la capacidad fertilizante in vitro de los espermatozoides.
Palabras claves: calidad seminal, centrifugación, criopreservación, fertilización in vitro
Abstract
The aim of this study was to evaluate the effect of four separation methods on seminal quality and in vitro fertilizing capacity of equine cryopreserved spermatozoa. Straws of equine cryopreserved semen were used for sperm separation through the Androcoll, CushionFluid, EquiPure and Percoll methods. A Sperm Class Analyzer (SCA®) system was used to determine total motility, progressive motility, curvilinear velocity, linear velocity and average path velocity. Also, intact acrosome and sperm vitality were evaluated by fluorescence microscopy. In vitro fertilizing capacity was assessed by in vitro fertilization of bovine oocytes with spermatozoa obtained by each separation method. Cleavage rates were determined after three days of in vitro culture. The results were analyzed using generalized linear models (GLM) and means of the four methods were compared using the Tukey test. The CushionFluid was superior for most parameters of sperm motility as well as for intact acrosome (p<0.05). Higher means of sperm vitality were obtained with EquiPure and Percoll (p<0.05), but no difference were found on cleavage rates between treatments. It was concluded that cryopreserved stallion semen selected by the CushionFluid method had better sperm quality compared to the other three methods; however no difference was evident between them for in vitro fertilizing capacity of spermatozoa.
Keywords: semen quality, centrifugation, cryopreservation, in vitro fertilization
Introducción
Implementar la biotecnología en los sistemas de producción permite mejorar el rendimiento y la salud animal (Uffo, 2011). Esto cobra importancia para la especie equina, especialmente en los casos de crianza de caballos con fines deportivos y de recreación, dado que tienen una gran trascendencia económica, razón por la cual los investigadores buscan y evalúan nuevas y mejores tecnologías para esta especie (Gordon, 2008).
El semen equino puede ser utilizado en procesos de reproducción asistida con fines de mejoramiento genético (Bailey et al., 2000), pero la baja calidad del semen criopreservado limita su utilización (Ball, 2008). Entre las técnicas utilizadas para aumentar la calidad seminal, se encuentran la separación del plasma seminal (Aurich, 2008), los métodos ‘swim-up’ o ‘swim-down’; la filtración con lana de vidrio o con Sephadex (Neild, 2013) y la centrifugación con gradientes de densidad (DGC) o de una capa (SLC), las cuales aumentan la supervivencia espermática (Morrell et al., 2008).
Se dispone de varios métodos para la mejora de la calidad seminal en el equino (Sieme et al., 2003; Mancil et al., 2010; Morrell, 2011) y lograr una mayor eficiencia en la selección espermática posterior a la criopreservación (Hoogewijs et al., 2011). El objetivo del presente estudio fue evaluar el efecto de los métodos de separación seminal Androcoll, CushionFluid, EquiPure y Percoll sobre la calidad y la capacidad fertilizante in vitro de espermatozoides equinos criopreservados.
MATERIALES Y MÉTODOS
El estudio se realizó entre agosto y noviembre de 2014, en el Laboratorio de Biotecnología Animal del Politécnico Colombiano Jaime Isaza Cadavid (Bello, Antioquia, Colombia). Se utilizaron pajillas de un mismo lote de semen congelado de un caballo de la raza Criollo Colombiano.
Colección y Procesamiento del Semen
Se colectó el semen de un equino (Equus caballus) de la raza Criollo Colombiano, de 7 años de edad, con fertilidad comprobada con crías nacidas vivas y con una condición corporal de 6 (escala 1-9) (Warren, 2009). La colección se realizó empleando una vagina modelo Missouri (Minitube, Tiefenbach, Alemania), lubricada con gel no espermicida y sobre una yegua con la finalidad de aumentar la estimulación sexual. La fracción en gel del eyaculado fue removida por filtración. El eyaculado colectado fue evaluado en condiciones de campo, presentando un volumen de 76 mL, una concentración de 230 x 106 espermatozoides/mL, evaluada por espectrofotometría (Spermacue®, Minitube, Tienbach, Alemania) y una movilidad espermática de 80%, evaluada por microscopia. Posteriormente, el semen fue diluido en proporción 1:1 en diluyente EquiPro® (Minitube, Tiefenbach, Alemania), precalentado a 37 ºC. Luego el semen fue transportado hacia el laboratorio en condiciones de refrigeración a 5 ºC en un dispositivo de transporte Equitainer® (Hamilton Researh Inc.) (Pagl et al., 2006; Vlasiu et al., 2008).
La criopreservación del semen se realizó mediante un protocolo modificado de congelación (Medeiros et al., 2002: Bustamante et al., 2009). El semen fue centrifugado a 1200 g por 15 min y el sobrenadante fue descartado. El precipitado fue suspendido en diluyente EquiPro® suplementado con 4% de yema de huevo y 5% de N,N-dimetil-formamida (Sigma-Aldrich), en cantidad suficiente para una concentración final de 100 x 106 espermatozoides por mL. Posteriormente, el semen fue mantenido en refrigeración a 5 °C por 30 min y empacado en pajillas de 0.5 mL en un sistema de empaque y sellado por ultrasonido MRS1 Dual (IMV, Minnesota, EEUU). Las pajillas fueron sometidas horizontalmente a vapores de nitrógeno líquido (LN2) por 15 min y finalmente almacenadas en un tanque para LN2.
Separación de Espermatozoides
Se realizaron cinco procesos de separación y evaluación seminal. Para cada proceso se descongelaron un total de ocho pajillas (4 mL de semen) en agua a 37 ºC durante 1 min. Posteriormente, se emplearon cuatro métodos de separación de espermatozoides, utilizando 1 mL de semen para cada uno.
Los métodos de separación seminal empleados se realizaron siguiendo las recomendaciones de uso de cada fabricante y fueron los siguientes:
-
CushionFluid. Se depositó 1 mL de semen descongelado en un tubo de centrífuga. Se añadió 1 mL de CushionFluidTM (Minitube, Tienbach, Alemania) en el fondo del tubo, se centrifugó a 1000 g durante 15 min. Posteriormente, se eliminó el sobrenadante y los espermatozoides fueron resuspendidos en medio Fert-Talp.
-
Androcoll. Se colocaron 2 mL de Androcoll-E® (Minitube, Tienbach, Alemania) en el fondo de un tubo de centrífuga y se agregó 1 mL de semen descongelado. Se centrifugó a 300 g durante 20 min. Se eliminó el sobrenadante y el pellet fue resuspendido en Fert-Talp.
-
EquiPure. Se depositó 1 mL de EquiPureTM (Nidacom, Mölndal, Suecia) en un tubo cónico de centrífuga y se agregó 1 mL de semen descongelado. Se centrifugó a 300 g durante 20 min. Se retiró el sobrenadante y el pellet fue resuspendido en Fert-Talp.
-
Percoll. Para el método del gradiente de Percoll® (Percoll®, Sigma, EEUU) discontinuo, el Percoll 45% se preparó según García y Martínez (2013), pero en este caso se emplearon 250 µL de Percoll 90% y 250 µL de Sperm-TALP, que fueron mezclados suavemente. El gradiente se elaboró colocando 500 µL de Percoll 90% y sobre este, 500 µL de Percoll 45%. Se llevó a la incubadora (38.8 °C) para evitar choques térmicos y se depositó 500 µL de semen descongelado sobre las dos capas de Percoll. Se centrifugó a 300 g durante 20 minutos. El Percoll fue eliminado.
Evaluación de la Calidad seminal
Se evaluó la calidad seminal del semen descongelado al final de cada proceso para cada uno de los métodos de separación en estudio. Se determinó la motilidad total (MT), motilidad progresiva (MP), velocidad curvilínea (VCL), velocidad lineal (VSL) y velocidad media (VAP), mediante el sistema Sperm Class Analyzer (SCA®) (Microptic, Barcelona, España), según Hidalgo et al. (2005). La vitalidad espermática (VE) se evaluó de acuerdo a lo descrito por Gamboa et al. (2010), usando el kit Live/Dead sperm viability (Molecular Probes, EEUU) y la integridad acrosómica (IA), como reportaron Liu et al. (2002), mediante el uso del fluorocromo FITC-PNA.
Evaluación de la Capacidad Fertilizante in vitro
Recuperación de oocitos
Se colectaron ovarios bovinos en la planta de beneficio de la Central Ganadera de Antioquia (Medellín, Colombia), se depositaron en solución salina (0.9% NaCl) a 30 °C y se transportaron en termos (30 min) al laboratorio. Allí se colocaron en baño María a 30 °C, se aspiraron los folículos de 2 a 8 mm con una jeringa de 5 mL y una aguja 18g. El líquido folicular se decantó por 15 min a 30 °C en un tubo cónico de 50 mL y el pellet se empleó para seleccionar los oocitos de buena calidad, según la descripción de Gardón (1999) y Vásquez et al. (2009); siendo clasificados en tres categorías (Shioya et al., 1988).
Maduración in vitro de oocitos (MIV)
Los oocitos se lavaron en medio B199, compuesto de TCM 199 y bicarbonato de sodio (25 mM), suplementado con 0.2 mM de piruvato de sodio, 10 µg/mL de sulfato de gentamicina y 10% de suero fetal bovino, y enriquecido con 0.5 µg/mL de FSH, 5.0 µg/mL de LH y 1 µg/mL de estradiol. Fueron transferidos a cajas de Petri, que contenían gotas de 70 µL de medio B199 pH de 7.4. Se colocaron 15 oocitos/gota, se agregaron 3.5 mL de aceite mineral y se incubaron por 24 h a 38.5 °C, 95% humedad relativa y 5% de CO2.
Fertilización in vitro (FIV)
La FIV de los oocitos bovinos se realizó con los espermatozoides equinos seleccionados por los métodos previamente descritos. Para cada método se realizaron entre 2 y 4 repeticiones (según la disponibilidad de oocitos por proceso), donde cada gota con 15 oocitos, sometida a FIV, se tomó como una repetición.
Se preparó el medio Fert-TALP, suplementado con 10 µL/mL de solución antibiótica, 2 U/mL de heparina, 2 mM penicilamina, 1 mM hipotaurina, 250 mM epinefrina, 1 mM piruvato y 6 mg/mL albúmina sérica bovina (BSA). En cajas de Petri se colocaron gotas de 50 µL, donde primeramente se había agregado 35 µL de medio de fertilización, 3.5 mL de aceite mineral y 35 µL de medio. Previo a la coincubación de oocitos con espermatozoides, se evaluó el estadio de maduración de los ovocitos por medio de la visualización de la expansión de las células del cumulus (Restrepo et al., 2009).
Se tomó 5 µL de cada muestra de semen y se diluyó en agua para la evaluación de la concentración. Se ajustó el volumen requerido para obtener una concentración de un millón de espermatozoides/gota con la fórmula C1 V1=C2V2 (Cervantes y Loredo, 2009). Se coincubaron los oocitos y los espermatozoides por 24 h. Para cada proceso se hicieron grupos control de oocitos sin espermatozoides para estimar partenogénesis.
Cultivo de cigotos
Se utilizó el medio de desarrollo CR-1aa compuesto por 114.6 mM NaCl, 3.08 mM KCl, 26.18 mM NaHCO3, 2.52 mM lactato de sodio, 0.55 mM L-lactato, 0.4 mM piruvato de sodio, 1.5 mg mL-1 L glutamina, 3 mg mL-1 BSAFAF, 1% solución de antibiótico antimicótico, 10 μL mL-1 MEM esencial y 20 μL mL-1 BME
aminoácidos no esenciales. Se eliminaron las células del cumulus de los oocitos por pipeteo, los presuntos cigotos se lavaron tres veces y se trasladaron a medio de cultivo (día 1), empleando gotas de 100 μL cubiertas de 3.5 mL de aceite. Luego se colocaron nuevamente en la incubadora, en las mismas condiciones, hasta el día 3, cuando se realizó la evaluación del clivaje, el cual fue ajustado al restar el porcentaje de partenogénesis.
Análisis Estadístico
Se empleó un diseño completamente al azar. Los resultados se analizaron mediante modelos lineales generalizados (GLM) para cada variable dependiente. Las medias entre los métodos se compararon usando la prueba de Tukey (HSD). El modelo general empleado fue: Yijkl = µ + Pi + Mj + Rk + eijkl, donde Yijkl es la variable dependiente: MT, MP, VCL, como covariable en el modelo para la MP y viceversa. En el modelo de CF se incluyeron los efectos fijos de las interacciones entre el método y el proceso (M x P) y entre el proceso y la repetición (P x R).
RESULTADOS Y DISCUSIÓN
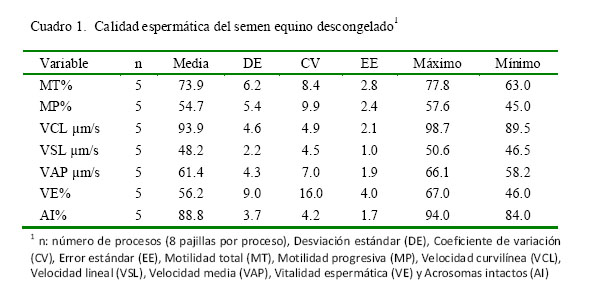
Los resultados de calidad del semen criopreservado se presentan en el Cuadro 1. Los valores encontrados fueron superiores a un estudio previo donde se reporta MT 61.8 ± 13.9, MP 25.5 ± 15.4, VCL 55.2 ± 19.9, VSL 36.5 ± 18.3, VAP 44.6 ± 21.5 (Restrepo et al., 2013).
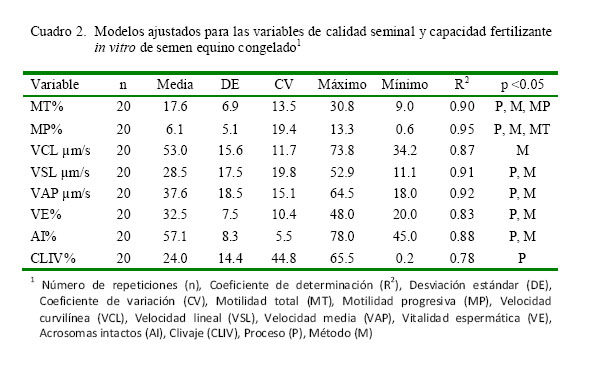
En el Cuadro 2 se presentan los resultados de los modelos ajustados para cada una de las características de calidad seminal y capacidad fertilizante in vitro. A excepción del clivaje, los niveles de variabilidad encontrados fueron bajos (CV<20). Se encontró un alto nivel de ajuste de los modelos, reflejado en altos coeficientes de determinación (R2). Los efectos del proceso (P) y el método de separación (M) explicaron en gran medida la variabilidad encontrada en los modelos (p<0.05).
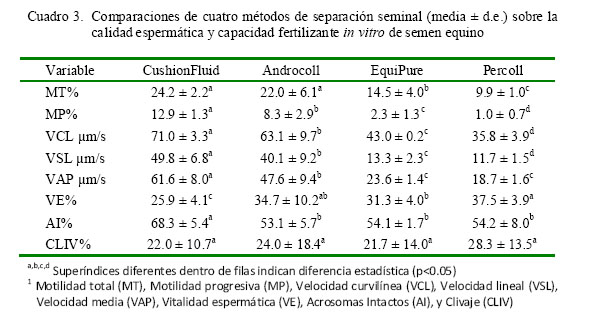
Las técnicas de separación o selección seminal se realizan para aumentar la calidad del esperma, ya que eliminan aquellos espermatozoides con alteraciones o muertos, pues afectan a los demás, reduciendo así su viabilidad (Johannisson et al., 2009). No obstante, esto no se ha evidenciado en los resultados (Cuadro 1 y Cuadro 3). Asimismo, se observó un efecto perjudicial de la centrifugación sobre los parámetros MT, MP, VCL, VSL, VAP, AI y VE, independientemente del método utilizado. Sin embargo, la selección espermática usando CushionFluid fue superior para los parámetros MT, MP, VCL, VSL, VAP y AI.
De acuerdo a lo anterior, se podría inferir que el CushionFluid protege en mayor medida la integridad celular contra las afecciones causadas por la centrifugación, dado que aun siendo el tratamiento con mayor fuerza de centrifugación aplicada, de acuerdo a su modo de uso, mostró mejores resultados (Cuadro 3). Otros resultados confirman las bondades de este método (Aurich, 2008).
Aunque en esta investigación no se evaluó la morfología espermática, Morrell et al. (2008), encontraron que la proporción de espermatozoides con defectos de cabeza y cola se reduce en un 60% usando Androcoll con SLC. Esto es importante, considerando que los defectos de cola y cabeza perjudican la motilidad espermática (Turner et al., 2003; Malo et al., 2006), lo cual explicaría los resultados de motilidad para Androcoll.
Macías et al. (2009) encontraron que el Androcoll es útil para mejorar las subpoblaciones de espermatozoides equinos con altas velocidades, especialmente, la velocidad curvilínea, aunque no fue evidente en el presente estudio. No obstante, los resultados indican que CushionFluid fue el método que más conservó los valores de VSL y VAP, respecto al semen descongelado (Cuadro 3).
Los equinos catalogados como «buenos congeladores» presentan una MP posdescongelación superior a 35% (Hoffmann et al., 2011). En estudios realizados con semen fresco de este tipo de equinos, el CushionFluid tuvo un rendimiento superior al Androcoll, mientras sucedió lo contrario en animales catalogados como «pobres congeladores» (Hoogewijs et al., 2011; Morrell 2011). En el presente estudio, el animal empleado era considerado como «buen congelador» (Cuadro 1), lo cual se refleja, de alguna manera, en los resultados obtenidos (Cuadro 3).
El EquiPure (DGC) ha sido útil para aumentar la calidad del semen fresco de equinos subfértiles antes de su criopreservación, logrando una mejor calidad espermática posdescongelación (Mancil et al., 2010), mas no así en equinos fértiles (Hoogewijs et al., 2011). Además, EquiPure (SLC) beneficia la selección de espermatozoides con cromatina intacta, aumenta la motilidad, morfología normal, potencial de membrana mitocondrial, viabilidad e integridad de la membrana plasmática, pero se obtiene un bajo número de espermatozoides poscentrifugación (Stoll et al., 2010). Aunque en este estudio, la separación seminal se hizo posdescongelación y con semen de un «buen congelador», se podría inferir que este producto no potencializa su efecto benéfico al utilizar un buen material seminal. En otro estudio, al utilizar EquiPure y Swim-Up se obtuvo espermatozoides equinos posdescongelación de mejor calidad con Swim-Up (Cabrera et al., 2014). Además, Stoll et al. (2013) reportan MT de 77.88 ± 2.6 y MP de 67.3 ± 2.8 con EquiPure (SLC) posdescongelación, cifras que son superiores a las presentadas en esta investigación para los métodos SLC (CushionFluid, Androcoll y EquiPure).
Urrego et al. (2008) reportan que, en espermatozoides bovinos, la centrifugación a 700 g por 10, 30 o 45 min con gradiente de Percoll, afecta al ADN y cuando se realiza por 45 min reduce, además, la integridad de la membrana plasmática. Las lesiones en el ADN, debido a las altas concentraciones de especies reactivas de oxígeno (ERO), pueden producir un aumento en la fragmentación del ADN y una disminución drástica de la motilidad (Duru et al., 2000). Teniendo en cuenta la fuerza y el tiempo empleados en este estudio para las centrifugaciones con Percoll y los demás métodos, es posible que se haya ocasionado daños en el ADN.
La evaluación de la vitalidad, como indicador de la integridad de la membrana plasmática, mostró una reducción evidente entre el semen descongelado y el semen seleccionado por los cuatro métodos, siendo el Percoll el que presentó una menor reducción para este parámetro.
Según Magistrini et al. (1997), las ERO están relacionadas con las alteraciones en vitalidad, lo cual podría explicar las diferencias entre los métodos empleados, a pesar de presentar resultados contrarios para otras variables de motilidad, cinética y AI (Cuadro 3). Por otro lado, se ha reportado que, en bovinos, al emplear una columna de Percoll, este selecciona espermatozoides con bajos niveles de AI (Gardón et al., 2001). Los resultados encontrados concuerdan con Sieme et al. (2003), quienes aseguran que el Percoll no mejora la calidad espermática en eyaculados equinos «normales».
No se encontró un efecto benéfico de los métodos de separación sobre la capacidad fertilizante in vitro del semen (Cuadro 3). Estos resultados concuerdan con otros donde no se logró incrementar las tasas de fertilidad luego de procesar el semen con filtración con Sephadex y centrifugación en una capa con Percoll (Nie et al., 2003), ni con material refrigerado (Alvarenga y Leao, 2002) o derivado del epidídimo (Morris et al., 2002). Además, Gardón et al. (2001) mencionan que la capacitación de los espermatozoides se afecta con la preparación espermática.
No obstante estos resultados, Colleoni et al. (2011) lograron mayores valores de clivaje y desarrollo hasta blastocistos al usar espermatozoides de equinos posiblemente subfértiles seleccionados por Androcoll (SLC) respecto a los seleccionados por DGC, empleando el procedimiento ICSI. Asimismo, Campos-Chillón et al. (2007) obtuvieron 42% de clivaje al fertilizar oocitos bovinos (zona pelúcida intacta) con espermatozoides equinos, de los cuales, el 24% desarrolló hasta ocho células, aunque en ese caso no se hizo la evaluación por partenogénesis. En el presente estudio, las medias para las tasas de clivaje antes de ser ajustadas por la partenogénesis fueron de 61.1 ± 15.5, 56.3 ± 14.8, 54.0 ± 11.9 y 53.4 ± 13.3 para Percoll, Androcoll, CushionFluid y EquiPure, respectivamente, siendo el promedio de partenogénesis para este estudio de 30.2% y el porcentaje de desarrollo promedio hasta ocho células de 35.4%.
CONCLUSIONES
-
El semen equino criopreservado, seleccionado por el método CushionFluid, presenta mejores parámetros de calidad espermática, respecto a los métodos Androcoll, EquiPure y Percoll.
-
No se evidencia diferencia en la capacidad fertilizante in vitro de espermatozoides equinos criopreservados seleccionados por estos métodos.
LITERATURA CITADA
1. Aurich C. 2008. Recent advances in cooled-semen technology. Anim Reprod Sci 107: 268-275. doi: 10.1016/j.anireprosci.2008.04.015
2. Alvarenga MA,Leão, KM. 2002. Hysteroscopic insemination of mares with low number of frozen thawed spermatozoa selected by percoll gradient. Theriogenology 58: 651-653. doi 10.1016/S0093-691X(02)00897-X [ Links ]
3. Bailey J, Bilodeau J, Cormier N.2000. Semen cryopreservation in domestic animals: a damaging and capacitating phenomenon. J Androl 21: 1-7. doi: 10.1002/j.1939-4640.2000.tb03268.xLinks ]0pt;mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif"; mso-fareast-font-family:"Times New Roman";color:maroon'>
4. Ball BA. 2008. Oxidative stress, osmotic stress and apoptosis: Impacts on sperm function and preservation in the horse. Anim Reprod Sci 107: 257-267. doi: 10.1016/j.anireprosci.2008.04.014
5. Bustamante I, Pederzolli C, Sgaravatti A, Gregory R, Dutra C, Jobim M, Mattos RC. 2009. Skim milk-egg yolk based semen extender compensates for non-enzymatic antioxidant activity loss during equine semen cryopreservation. Anim Reprod 6: 392-399. [ Links ]
6. Cabrera P, Sánchez R, Risopatrón, J. 2014. Selección espermática en semen congelado/descongelado de equino: evaluación de las membranas plasmática, acrosomal y potencial de membrana mitocondrial. Int J Morphol 32: 725-731. doi: 10.4067/S0717-95022014000200057Links ]0pt;mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif"; mso-fareast-font-family:"Times New Roman";color:maroon'>
7. Campos-Chillón LF, Barcelo-Fimbres M, Carnevale EM, Seidel Jr GE. 2007. Use of bovine oocytes to evaluate in vitro fertilizing capacity of equine sperm. Theriogenology 68: 515-516. doi: 10.1016/j.theriogenology.2007.05.036Links ]0pt; mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family: "Times New Roman";color:maroon'>
8. Cervantes Nemer BV, Loredo Enríquez, J. 2009. Manual pedagógico de prácticas de química general en microescala. 3ª ed. México: Universidad Iberoamericana. 39 p. [ Links ]
9. Colleoni S, Lagutina I, Lazzari G, Rodríguez-Martínez H, Galli C, Morrel JM. 2011. New methods for selecting stallion spermatozoa for assisted reproduction. J Equine Vet Sci 31: 536541. doi: 10.1016/j.jevs.2011.03.009Links ]0pt;mso-bidi-font-size: 10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family:"Times New Roman"; color:maroon'>
10. Duru N, Morshedi M, Oehninger S. 2000. Effects of hydrogen peroxide on DNA and plasma membrane integrity of human spermatozoa. Fertil Steril 74: 1200-1207. [ Links ]
11. Gamboa S, Rodrigues AS, Henriques L, Batista C, Ramalho-Santos J. 2010. Seasonal functional relevance of sperm characteristics in equine spermatozoa. Theriogenology 73: 950-958. doi:10.1016/j.theriogenology.2009.11.023
12. García J, Martínez JL. 2013. Implementación de un protocolo de fertilización in vitro en bovinos en el laboratorio de reproducción animal de Zamorano. Tesis de Ingeniero Agrónomo. Tegucigalpa: Escuela Agrícola Panamericana. 27 p. [ Links ]
13. Gardón JC. 1999. Utilización de antisuero H-Y para sexar embriones bovinos en diferentes estadios del desarrollo embrionario, obtenidos por fertilización in vitro. Tesis de Doctorado. Córdoba: Univ de Córdoba. 135 p. [ Links ]
14. Gardón JC, Matás C, Gadea J. 2001. Efecto del protocolo de preparación de espermatozoides bovinos sobre el patrón de reacción acrosómica. An Vet (Murcia) 17: 19-26. [ Links ]
15. Hidalgo M., Rodríguez I, Dorado J, Sanz J, Soler C. 2005. Effect of sample size and staining methods on stallion sperm morphometry by the Sperm Class Analyzer. Vet Med-Czech 50: 24-32. [ Links ]
16. Hoogewijs M, Morrell J, Van Soom A, Govaere J, Johannisson A, Piepers S, De Schauwer C, et al. 2011. Sperm selection using single layer centrifugation prior to cryopreservation can increase thawed sperm quality in stallions. Equine Vet J 43(Suppl 40): 35-41. doi: 10.1111/j.2042-3306.2011.00489.x
17. Johannisson A, Morrell JM, Thorén J, Jönsson M, Dalin A-M, RodríguezMartínez H. 2009. Colloidal centrifugation with Androcoll-E™ prolongs stallion sperm motility, viability and chromatin integrity. Anim Reprod Sci 116: 119-128. doi: 10.1016/j.anireprosci.2009.01.008Links ]0pt;mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif"; mso-fareast-font-family:"Times New Roman";color:maroon'>
18. Liu DY, Martic M, Clarke GN, Grkovic I, Garret C, Dunlop ME, Baker HW. 2002. An anti-actin monoclonal antibody inhibits the zona pellucida-induced acrosome reaction and hyperactivated motility of human sperm. Mol Human Reprod 8: 37-47. doi: 10.1093/molehr/8.1.37Links ]0pt;mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family: "Times New Roman";color:maroon'>
19. Hoffmann N, Oldenhof H, Morandini C, Rohn K, Sieme H. 2011. Optimal concentration of crioprotective agents for semen from stallions that are classified«good» or «poor» for freezing. Anim Reprod Sci 125: 112-118. doi: 10.1016/j.anireprosci.2011.03.001Links ]0pt; mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family: "Times New Roman";color:maroon'>
20. Macías García B, GonzálezFernández L, Morrell JM, Ortega Ferrusola C, Tapia JA, Rodríguez Martínez H, Peña FJ. 2009. Singlelayer centrifugation through colloid positively modifies the sperm subpopulation structure of frozen-thawed stallion spermatozoa. Reprod Domest Anim 44: 523-526. doi: 10.1111/j.1439-0531.2008.01276.xLinks ]0pt; mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family: "Times New Roman";color:maroon'>
21. Magistrini M, Guitton E, Levern Y, Nicolle JC, Vidament M, Kerboeuf D, Palmer E. 1997. New staining methods for sperm evaluation estimated by microscopy and flow cytometry. Theriogenology 48: 1229-1235. [ Links ]
22. Malo AF, Gomendio M, Garde J, Lang-Lenton B, Soler AJ, Rolda ER. 2006. Sperm design and sperm function. Biol Lett 2: 246-249. doi: 10.1098/rsbl.2006.0449Links ]0pt;mso-bidi-font-size:10.0pt; font-family:"Arial","sans-serif";mso-fareast-font-family:"Times New Roman"; color:maroon'>
23. Mancill SS, Love CC, Brinsko SP, Edmond AJ, Foster ML, Teague SR, Waite JA, et al. Effect of density gradient centrifugation on cryopreservation of equine spermatozoa. Anim Reprod Sci 121: 208-209. [ Links ]
24. Medeiros A, Gomes G, Carmo M, Papa F, Alvarenga M. 2002. Cryopreservation of stallion sperm using different amides. Theriogenology 58: 273-276. doi: 10.1016/S0093-691X(02)00898-1Links ]0pt;mso-bidi-font-size: 10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family:"Times New Roman"; color:maroon'>
25. Morrell JM, Dalin AM, RodríguezMartínez H. 2008. Prolongation of stallion sperm survival by centrifugation through coated silica colloids: a preliminary study. Anim Reprod 5: 121126. [ Links ]
26. Morrell JM. 2011. Biomimetics in action: practical applications of single layer centrifugation for equine breeding. J Vet Sci Technol 2: 107. doi:10.4172/ 2157-7579.1000107Links ]0pt;mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family: "Times New Roman";color:maroon'>
27. Morris L, Tiplady C, Allen WR. 2002. The in vivo fertility of cauda epididymal spermatozoa in the horse. Theriogenology 58: 643-646. doi: 10.1016/S0093-691X(02)00742-2Links ]0pt;mso-bidi-font-size: 10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family:"Times New Roman"; color:maroon'>
28. Neild D. 2013. Métodos de análisis de semen y su relación con la fertilidad equina. Spermova 3: 122-124. [ Links ]
29. Nie GJ, Johnson KE, Wenzel JGW. 2003. Pregnancy outcome in mares following insemination deep in the uterine horn with low numbers of sperm selected by glass wool/Sephadex filtration, percoll separation or absolute number. Anim Reprod Sci 79: 103-109. doi: 10.1016/S0378-4320(03)00086-1Links ]0pt;mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif"; mso-fareast-font-family:"Times New Roman";color:maroon'>
30. Pagl R, Aurich J, Müller-Schlösser F, Kankofer M, Aurich A. 2006. Comparison of an extender containing deûned milk protein fractions with a skim milk-based extender for storage of equine semen at 5 °C. Theriogenology 66: 1115-1122. doi: 10.1016/j.theriogenology.
31. Restrepo Betancur G, Gómez Oquendo J, Vásquez Araque N, Giraldo Giraldo JJ. 2009. Evaluación de la maduración in vitro de oocitos equinos madurados en presencia de suero fetal bovino y fluido folicular equino. En: Encuentro Internacional de Investigación, Tecnología y Medio Ambiente. Medellín: Politécnico Colombiano Jaime Isaza Cadavid. [ Links ]
32. Restrepo G, Ocampo D, Velásquez A. 2013. Evaluación de la movilidad del semen criopreservado de caballos criollo colombiano por un sistema analizador de clase. Rev UDCAAct Div Cient 16: 445450. [ Links ]
33. Shioya Y, Kuwayama M., Fukushima M, Iwasaki S, Hanada, A. 1988. In vitro fertilization and cleavage capability of bovine follicular oocytes classified by cumulus cells and matured in vitro. Theriogenology 30: 489-496. [ Links ]
34. Sieme H, Martinsson G, Rauterberg H, Walter K, Aurich C, Petzoldt R, Klug E. 2003. Application of techniques for sperm selection in fresh and frozenthawed stallion semen. Reprod Dom Anim 38: 134-140. doi: 10.1046/j.1439-0531.2003.00416.xLinks ]0pt; mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family: "Times New Roman";color:maroon'>
35. Stoll A, Love CC, Ball BA. 2010. Use a single-layer density centrifugation to reduce the number of DNA-damaged sperm and enhance sperm quality in cryopreserved-thawed stallion semen. Anim Reprod Sci 121S: S163-S164. [ Links ]
36. Stoll A, Love CC, Ball BA. 2013. Use of a single-layer density centrifugation method enhances sperm quality in cryopreserved-thawed equine spermatozoa. J Equine Vet Sci 33: 547-551. doi: 10.1016/j.jevs.2012.08.009Links ]0pt;mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif"; mso-fareast-font-family:"Times New Roman";color:maroon'>
37. Turner RM. 2003. Tales from the tail: what do we really know about sperm motility? J Androl 24: 790-803. doi: 10.1002/j.1939-4640.2003.tb03123.xLinks ]0pt; mso-bidi-font-size:10.0pt;font-family:"Arial","sans-serif";mso-fareast-font-family: "Times New Roman";color:maroon'>
38. Uffo O. 2011. Producción animal y biotecnologías pecuarias: nuevos retos. Rev Salud Anim 33: 8-14. [ Links ]
39. Urrego R, Ríos A, Olivera M, Camargo O. 2008. Efecto de la centrifugación sobre la membrana plasmática y el ADN de espermatozoides bovinos. Rev Colomb Cienc Pec 21: 19-26. [ Links ]
40. Vásquez Araque N, Gómez Oquendo J, Álvarez Balvin JC, Chavarría NA. 2009. Comparación de dos métodos de incubación sobre la maduración in vitro de oocitos bovinos. Rev Politécnica 5: 26-32. [ Links ]
41. Vlasiu T, Groza I, Morar I, Cãtanã R. 2008. The effect of different freezing procedures on sperm head morphometry in stallions. Bulletin UASVM, Veterinary Medicine 65: 146-151. [ Links ]
42.Warren L. 2009. Feeding the stallion. Alberta Agriculture and Rural Development, USA. AGRI-FACTS. [Internet]. Available in: http://www1.agric.gov.ab.ca/$department/deptdocs.nsf/all/agdex9622/$FILE/feeding-the-stallion.pdf [ Links ]
Recibido: 5 de enero de 2015
Aceptado para publicación: 20 de abril de 2015