Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.26 no.3 Lima set. 2015
http://dx.doi.org/10.15381/rivep.v26i3.11175
http://dx.doi.org/10.15381/rivep.v26i3.11175
Factores de Riesgo Asociados a la Seroprevalencia de Toxoplasma gondii en Mamíferos del Orden Carnívora y Primates Mantenidos en Cautiverio
Risk Factors Associated to the Seroprevalence of Toxoplasma gondii in Captive Mammals from Carnivora and Primate Order
Dennis Navarro M.1, Amanda Chávez V.1,3, Rosa Pinedo V.1, Karina Muñoz D.1
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Uni- versidad Nacional Mayor de San Marcos, Lima, Perú
2 Patronato del Parque de las Leyendas (PATPAL), Lima, Perú
3 E-mail: achavezvg@gmail.com
Resumen
El objetivo del presente estudio fue determinar la seroprevalencia de T. gondii en mamíferos de los órdenes Carnivora y Primates criados en cautiverio e identificar las variables epidemiológicas que intervienen en su presentación. El trabajo se desarrolló en el zoológico del Patronato del Parque de las Leyendas, Lima, Perú. Se colectaron mues- tras de sangre a 101 animales silvestres (Carnivora, n=49; Primates, n=52) y de 87 roedo- res y 18 felinos domésticos capturados en el zoológico. Se realizaron encuestas para identificar los potenciales factores de riesgo para cada Orden, así como de cada especie de roedor (parámetros morfométricos, edad estimada, sexo y peso) y felino doméstico (edad, sexo). Se utilizó la técnica de hemaglutinación indirecta para el diagnóstico de T. gondii, preparándose diluciones de 1:16 a 1:2048, considerándose como positivos títulos mayores de 1/16. Se determinó anticuerpos IgM mediante el uso del 2-Mercaptoetanol para determinar una infección aguda. La asociación entre la seroprevalencia a T. gondii y las variables sexo, origen, tiempo en la institución y tipo de alimentación fue analizada mediante la razón de posibilidades (odds ratio - OR) La seroprevalencia de T. gondii en los animales del Orden Carnivora y Primates fue de 87.8 y 80.8%, respectivamente. Solo se encontró asociación significativa (p<0.05) entre la seroprevalencia de T. gondii en primates y el tipo de alimentación, donde el ser omnívoro constituyó un factor de riesgo (OR: 40.9) para la presentación de la infección. La frecuencia de anticuerpos anti-T. gondii en roedores (Rattus sp) y gatos fue de 25.3 y 77.8%, respectivamente.
Palabras claves: factor de riesgo, Toxoplasma gondi, seroprevalencia, Carnivora, Primates
Abstract
The objective of this study was to determine the seroprevalence of T. gondii in captive wild animals of the Carnivora and Primates orders and identify the epidemiologic variables involved in its presentation. The study was conducted at the Patronato del Parque de las Leyendas Zoo, Lima, Peru. Blood samples were collected (Carnivora, n=49; Primates, n=52). In addition, samples were collected from 87 urban rodents and 18 domestic cats captured in the zoo. Surveys were done to identify potencial risk factors for each Order. Furthermore, morphometric parameters, estimated age, sex and body weight from rats and age and sex from cats were recorded. Indirect hemaglutination test was used for the diagnosis of T .gondii. Dilutions were prepared from 1:16 to 1:2048, considering positive a titre over 1/16. IgM antibodies were measured by using 2-Mercaptoethanol to determinate acute infections. The associations between the seroprevalence to T. gondii and the variables sex, origin, time in the institution and type of feeding were analyzed by the odds ratio (OR). The seroprevalence of T. gondii in captive mammals of the Carnivora and Primates orders was 87.8 and 80.8% respectively. Significant association (p<0.05) was only found between seroprevalence of T. gondii in primates and the type of feeds, where the omnivore diet had a significant risk factor (OR: 40.9) for the presentation of the infection. The frequency of anti-T. gondii antibodies in rodents (Rattus sp) and cats was 25.3 and 77.8% respectively.
Keywords: risk factor, Toxoplasma gondii, seroprevalence, Carnivora, Primate
Introducción
La toxoplasmosis es una zoonosis de distribución mundial producida por el protozoo Toxoplasma gondii, cuya presencia se ha demostrado tanto en poblaciones humanas como en más de 300 especies de mamíferos domésticos y silvestres, y en cerca de 30 especies de aves de corral y vida libre (Dubey, 2010). La infección se encuentra ampliamente distribuida en América Latina, principalmente en países tropicales de clima caliente y húmedo, ocurriendo también en regiones frías del Ártico y Alaska (Elmore et al., 2012).
Los felinos (domésticos y silvestres) son los hospederos definitivos que eliminan ooquistes no esporulados al medio ambiente que, en condiciones favorables de tempera- tura y humedad, esporulan y constituyen la forma infectiva para otras especies animales y hasta para el mismo felino (Cordero del Campillo et al., 1999). Dichos ooquistes presentan una alta resistencia, constatada en diferentes experiencias, de soportar condiciones extremas como sequías y heladas favoreciendo la diseminación del parásito, el cual ha demostrado ser viable hasta por 18 meses (Frenkel, 1978). Otra forma de infección es a partir de quistes tisulares presentes, mayoritariamente, en la carne de ratones, aves y herbívoros que previamente han ingerido ooquistes esporulados (Dubey, 2010).
La prevalencia de la toxoplasmosis está relacionada a factores sociales, económicos, culturales, geográficos y climáticos. El riesgo de infección por toxoplasmosis es mayor en la población rural, debido a sus hábitos y al contacto frecuente con las fuentes de infección (García et al., 1999). Asimismo, los parques zoológicos representan un ecosistema con presencia de todos los factores epidemiológicos que favorecen y contribuyen a la trasmisión y diseminación del parasito (de Camps et al., 2008).
Estudios serológicos han demostrado una alta prevalencia de anticuerpos anti- Toxoplasma gondii en animales silvestres en cautiverio, lo cual indica una difusión importante de este agente en ese entorno. Asimismo, ciertas especies de mamíferos silvestres (marsupiales australianos, primates del nuevo mundo, lémures, etc.) presentan ma- yor susceptibilidad y pueden morir de toxoplasmosis aguda. Por esto, la infección por T. gondii en animales de zoológico es de particular interés dado que muchas de estas especies cursan con una infección asintomática (de Camps et al., 2008). Por otro lado, una alta prevalencia de T. gondii en los zoológicos representa un riesgo po- tencial de exposición para el personal y los visitantes que acuden a dichos centros de es- parcimiento.
Por todo lo señalado, el objetivo del presente estudio fue determinar la seroprevalencia de T. gondii en mamíferos de los órdenes Carnivora y Primates mantenidos en cautiverio, así como identificar las variables epidemiológicas que intervienen en su presentación.
MATERIALES Y MÉTODOS
Ubicación del Estudio
El presente estudio se realizó en el zoológico del Patronato del Parque de las Leyendas, ubicado en el distrito de San Miguel (12° 05' 11" S, 77° 05' 05" W y a una altitud de 50 msnm, durante los meses de enero de 2013 y marzo de 2014. El procesamiento de la muestras se llevó a cabo en el Laboratorio de Microbiología y Parasitología de la Facultad de Medicina Veterinaria (FMV), Universidad Nacional Mayor de San Marcos (UNMSM), Lima.
El procesamiento de las muestras se realizó en el laboratorio de la Estación Experimental IVITA-Iquitos y en el Laboratorio de Parasitología de la Facultad de Medicina Veterinaria, Lima, ambos de la Universidad Nacional Mayor de San Marcos, así como en el Laboratorio de Ixodides, Departamento de Entomología, Instituto Oswaldo Cruz- Fiocruz, Brasil, donde se confirmó la especie de la garrapata.
Animales del Zoológico y Muestras
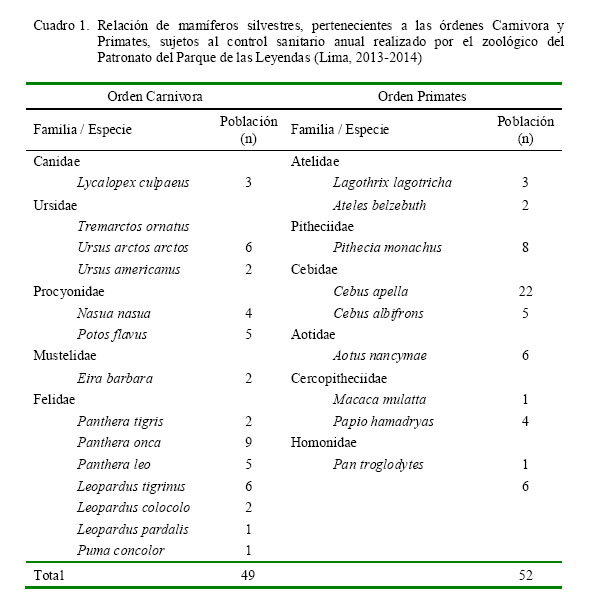
El Cuadro 1 presenta la población de animales silvestres pertenecientes al zoológico que fueron muestreados. Los animales fueron sujetados mediante el uso de redes (Fig. 1a) y sedación (xilacina y ketamina) de ser necesario. Las muestras de sangre fueron obtenidas por punción de la vena braquial, yugular o femoral, usando Vacutainers® es- tériles (Fig. 1b,c), y trasladadas al laboratorio con refrigerantes.
Roedores y Gatos
Además de los animales del zoológico, se trabajó con ratas y gatos domésticos que deambulan en libertad por las áreas del parque zoológico (87 ratas y 18 gatos). En este caso no se estableció un tamaño muestral mínimo debido a la dificultad para su captura y la información resultante fue considerada como suplementaria al estudio.
Los roedores y gatos fueron capturados con el uso de trampas tipo Tomahawk de captura viva, colocadas en lugares estratégicos, acondicionadas con un GPS y revisadas al día siguiente de su colocación, actividad que se realizó por tres meses. Los roedores fueron anestesiados mediante la inhalación de cloroformo seguido de ketamina (100 mg/ kg). La sangre se obtuvo mediante punción intracardiaca y posteriormente sacrificados mediante sobredosis de pentobarbital sódico vía intraperitoneal. Durante la manipulación de los roedores se siguió los estándares de bioseguridad y normas de procesamiento según los protocolos del Centro de Enfermedades Infecciosas y Prevención de Atlanta (Mills et al., 1998).
Los gatos capturados fueron tranquilizados y anestesiados. Las muestras de sangre se obtuvieron mediante punción de la vena cefálica. Los animales fueron tratados bajo normas y principios de guía internacional basada en principios para la investigación biomédica que involucra animales (Bankowski y Howard-Jones, 1986).
Análisis Serológico
Para la determinación de anticuerpos contra T. gond ii se utilizó la prueba de Hemaglutinación Indirecta (HAI), la cual posee un sensibilidad de 81.6% y una especi- ficidad de 97.1%, demostrada en porcinos (Jones et al., 1986). La prueba se basa en la propiedad que tienen los anticuerpos anti-T. gondii de producir aglutinación en presencia de glóbulos rojos sensibilizados con antígenos citoplasmáticos y de membrana del parásito (Wiener Lab, 2000). Se prepararon diluciones de la muestra sérica de 1:16 a 1:2048, considerándose como positivo los títulos mayores de 1/16. A su vez, se determinó anticuerpos IgM mediante el uso del 2 Mercaptoetanol para determinar si el tipo de infección era aguda en los animales seropositivos. En este caso, si el patrón de aglutinación cae al menos dos títulos es indi- cativo de la presencia de anticuerpos de fase aguda (Mereiles, 2001).
Encuesta Epidemiológica
Se registró información concerniente a la especie, sexo, origen (nacido en la institución, externo), tiempo en la institución (1-5, 6-10, >10 años), tipo de alimentación (carnívoro: consumo de carne cruda fresca o congelada, o con actividad depredadora-roedores; omnívoro: consumo de carne y verduras), convivencia con felinos domésticos, cohabitación con roedores. En el caso de los roedores se registraron parámetros morfométricos, edad estimada, sexo y peso, y en los felinos domésticos se anotó la edad estimada y el sexo.
Análisis Estadístico
Los datos fueron analizados mediante las pruebas estadísticas de Prevalencia (P), Odds Ratio (OR) y Chi cuadrado.
Consideraciones Éticas
Se contemplaron las normas éticas para la investigación señaladas por el Comité de Ética para Uso de Animales de Experimentación de la FMV-UNMSM.
RESULTADOS
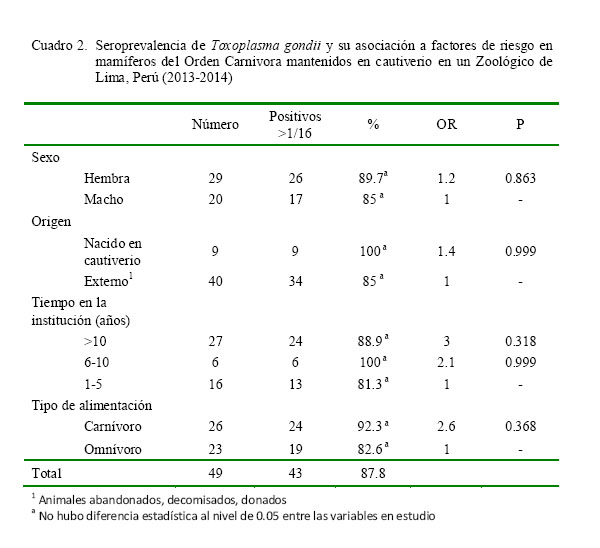
La seroprevalencia de T. gondii, mediante la prueba de hemaglutinación indirec- ta (HAI) en mamíferos silvestres de los órdenes Carnivora y Primates mantenidos en
cautiverio fue de 87.8% (43/49) y 80.8% (42/52) al 95% de confianza, respectivamente (cuadros 2 y 3). Asimismo, al interrelacionar las variables independientes (sexo, origen, etc.) como posibles factores de riesgo con la variable dependiente (seroprevalencia de T. gondii), solo se observó diferencia estadística (p<0.05) por el tipo de alimentación en el Orden Primates (Cuadro 3); donde los omnívoros tienen mayor riesgo (OR: 40.9) de adquirir la infección por T. gondii que los frugívoros.
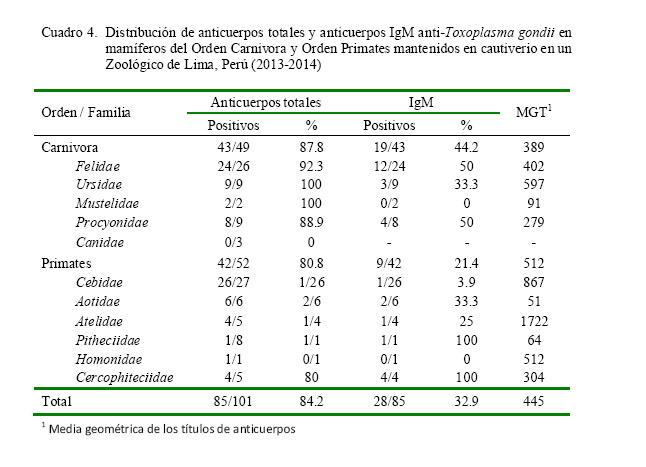
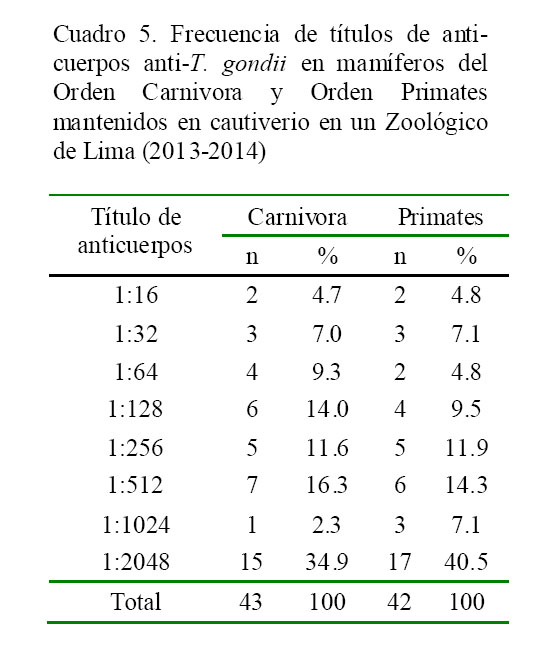
En el Cuadro 4 se observa la distribución de anticuerpos totales y anticuerpos IgM anti-T. gondii de los animales en estudio. El porcentaje de positividad para anticuerpos fue de 87.8% (43/49) en el Orden Carnivora y de 80.8% (42/52) en el Orden Primates, donde todos los animales de las familias Ursidae, Mustelidae, Aotidae y Homonidae fueron positivos. En tanto, para los anticuerpos de tipo IgM fue de 44.2% (19/43) y 21.4% (9/42) para Carnivoros y Primates, respectivamente, donde todos los animales de las familias Pitheciidae y Cercophiteciidae fueron positi- vos. La media geométrica del título (MGT) fue de 445, siendo de similar distribución para ambas órdenes, pero más elevada en la familia Atelidae. La frecuencia de títulos de anticuerpos totales para cada Orden se detalla en el Cuadro 5.
Por otro lado, el 25.3% (22/87) de los roedores (Rattus rattus y Rattus novergicus) capturados fueron positivos a T. gondii mediante la prueba de HAI. Igualmente el 77.8% (14/18) de felinos domésticos mostraron anticuerpos anti-T. gondii.
DISCUSIÓN
La toxoplasmosis es una de las enfermedades parasitarias más comunes en animales silvestres mantenidos en cautiverio. Diversos estudios serológicos han demostrado altas prevalencias de anticuerpos anti-T. gondii en zoológicos. Asimismo, ciertas es- pecies de mamíferos silvestres (marsupiales australianos, primates del nuevo mundo, lémures, etc.) presentan mayor susceptibilidad y pueden cursar con una toxoplasmosis aguda fatal (Dubey, 2010).
El 87.8% de seroprevalencia de T. gondii en mamíferos del Orden Carnivora fue similar a lo observado por Zhang et al. (2000), Silva et al. (2001), Sedlák y Bártová (2006) y Sobrino et al. (2007) en los zoológicos de Shanghai (69.4%), Brasil (54.6%), República Checa y Eslovaquia (89.7%) y España (67.4%), respectivamente. En el pre- sente estudio se encontraron frecuencias de 100% en animales clínicamente sanos de las familias Mustelidae y Ursidae (Cuadro 4).
Dentro de los factores que condicionan la alta seroprevalencia se encuentra el tipo de alimentación, la cual si bien es controlada en el zoológico en estudio y está constituida a base de carne (Felidae) o mixta (carne, frutas, huevo y vegetales) (Ursidae, Mustelidae, Procyonidae, Canidae), existe la posibilidad de que la carne se encuentre infectada con quistes tisulares, que son las formas más frecuentes de contagio en cautiverio (Dubey, 2010). Además, los felinos del parque zoológico son alimentados con carne fresca de animales del mismo centro (patos, huanganas, sajinos, etc.), como método de enriquecimiento alimenticio. Además, existe la posibilidad que muchos de estos mamíferos ingieran los roedores que merodean su hábitat.
Los resultados en el orden Carnivora indican que la variable sexo no es un factor de riesgo de importancia (Cuadro 2), estando tanto machos como las hembras igualmente expuestos a la infección. Sin embargo, Miller et al. (2002) señalaron que mamíferos machos, en vida libre, son más propensos a la infección debido a que recorren largas distancias para establecer y defender su territorio, contrario a lo que sucedería en animales mantenidos en cautiverio.
Asimismo, los carnívoros muestreados no mostraron diferencias en el riesgo de infección a T. gondii en relación a su lugar de procedencia (nacidos en el zoológico o traídos por abandono, donación o decomiso) o al tiempo de exposición, similar a lo descrito por Silva et al. (2007), quienes evaluaron 865 felinos neotropicales de 75 zoológicos y 15 centros de crianza de Brasil. Es posible que este factor haya quedado enmascarado ante la gran cantidad de roedores y gatos presentes en el zoológico, los cuales constituyen un factor importante de contagio, ya sea por la posible infección con ooquistes o por la depredación de roedores (Webster, 1994; Dubey 2010).
El 80.8% de seroprevalencia de T. gondii en mamíferos del Orden Primates fue superior a lo observado por Zhang et al. (2000), Sedlák y Bartová (2006) y Minervino et al. (2010) en los zoológicos de Shanghai (25%), República Checa y Eslovaquia (45.5%) y Brasil (57.7), respectivamente; sin embargo, es similar a la seroprevalencia reportada por Muñoz et al. (2005) en un estu- dio previo en este zoológico en primates Cebus apella (92.3%). Esta alta seroprevalencia podría deberse al hábito de ciertos primates no humanos de ingerir insectos como cucarachas, escarabajos y tenebrios, que pueden actuar como hospederos de transporte de los ooquistes de T. gondii (Dubey y Lindsay, 2004).
No se encontraron asociaciones significativas entre la seroprevalencia de T. gondii y los factores sexo, origen y tiempo en el zoológico en los animales del Orden Primates. Muñoz et al. (2005) tampoco halló una asociación con el sexo de primates de la familia Cebidae; García et al. (2005) tampoco hallaron una asociación significativa con el tiempo de permanencia de primates de la familia Cebidae en un zoológico de Brasil.
Los primates provenientes de abandono, donación y decomiso pueden haberse infectado mediante contacto con gatos en zonas urbanas o con humanos tanto en zonas rurales como urbanas (Tenter et al., 2000). En forma similar, los primates del zoológico, tanto los nacidos como los ‘externos’ pudieron contagiarse a través de los gatos que deambulan por el zoológico.
El mayor riesgo de infección por T. gondii en los primates omnívoros en relación a los frugívoros puede deberse al hábito que tienen los monos de ingerir insectos que pueden actuar como hospederos paraténicos de los ooquistes (Dubey y Lindsay, 2004). Asimismo, a los individuos de varias especies de primates se les ofrece carne como parte de su alimentación, la cual es servida en bandejas, y esto permite el contacto directo del alimento con el suelo, donde los ooquistes de T. gondii pueden sobrevivir hasta 18 meses en condiciones favorables de temperatura y humedad (Frenkel, 1978).
La frecuencia de anticuerpos totales fue más del 80% en las familias en estudio con excepción de las familias Pitheciidae (12.5%) y Canidae (0%). En el caso del mono huapo negro (Pithecia monachus), la baja prevalencia puede deberse a sus hábitos arbóreos (Defler, 2003), pues no acostumbra andar por el suelo y por lo tanto evita el contacto con posibles ooquistes esporulados presentes en el suelo. Además, se encuentran en un am- biente cerrado, rodeado por paneles de vi- drio, por lo que el ingreso de gatos y roedores es menor. En el caso de la familia Canidae no tiene una explicación clara, salvo que haya sido producto del azar ante la baja población muestreada. Fuchs et al. (2005) encontraron una seroprevalencia de 28% en zorros (Pseudalopex gymnocercus) en un zoológico de Argentina.
La presencia de anticuerpos IgM es un indicador de una probable infección reciente o activa, o de una alta frecuencia de reinfección. El consumo de carne infectada con quistes tisulares desencadena la presentación de anticuerpos IgM a partir de la primera semana llegando a un pico entre el día 12 y 22 de la infección (Bouer, 1999; Carvalho, 1998), manteniéndose hasta por 16 semanas (Lappin et al., 1989). Así mismo, la media geométrica de títulos de anticuerpos (445, Cuadro 4), indica que la infección por T. gondii es endémica y atribuible a una fuer- te contaminación ambiental de ooquistes y presencia de reserovorios de quistes tisulares; por ejemplo, las ratas (Webster, 1994). Tam- bién podría atribuirse a la diseminación involuntaria de ooquistes a través del material de limpieza o de la vestimenta de los tra- bajadores del zoológico (Dah-Sheng et al., 2009).
El agua de bebida podría ser otro factor de contaminación. El agua procede de un pozo artesanal propio del parque. Se dispone de un reporte en Panamá donde soldados estadounidenses se contaminaron por consumir agua en una zona selvática, en cuyas proximidades habitaban gatos y felinos silvestres (Aramini et al., 1999). Igualmente, en British Columbia (Canadá) se registraron 110 casos de toxoplasmosis asociada al consumo de agua, debido a que estas aguas solo eran so- metidas a desinfección (Solarte et al., 2006), siendo las técnicas de tratamiento primaria y secundaria incapaces de eliminar los ooquistes o esporocistos presentes en el agua (Payment et al., 2001).
La alta población de gatos y ratas con seroprevalencias a T. gondii de 25.3 y 77.8% respectivamente, predispone la contaminación del alimento (forraje, vegetales y frutas) y el agua de bebida con ooquistes; además, en el caso de las ratas, de ser depredadas por los carnívoros (Dah-Sheng et al., 2009).
CONCLUSIONES
-
La seroprevalencia de Toxoplasma gondii en mamíferos del Orden Carnivora y Orden Primates criados en cautiverio en el Parque Zoológico del Patronato del Parque de las Leyendas fue de 87.8 y 80.8%, respectivamente.
-
Se identificó el tipo de alimentación como un factor de riesgo (OR: 40.9) para la presentación de la toxoplasmosis en primates omnívoros.
LITERATURA CITADA
1. Aramini JJ, Stephen C, Dubey JP, Engelstoft C, Schwantje H, Ribble CS. 1999. Potencial contamination of drinking water with Toxoplasma gondii oocysts. Epidemiol Infect 122: 305-315. [ Links ]
2. Bankowski Z, Howard-Jones N. 1986. International guiding principles for biomedical research involving animals. Geneva: WHO. 26 p. [ Links ]
3. Bouer A, Werther K, Catão-Dias JL, Nunes ALV. 1999. Outbreak of toxoplasmosis in Lagothrix lagotricha. Folia Primatol 70 (5): 282-285. doi: 10.1159/000021709 [ Links ]
4. Carvalho CS. 1998. Padronização do ELISA teste para a detecção de anticorpos das classes IGM e IGC em soros de gatos experimentalmente infec- tados com taquizoítos de Toxoplasma gondii. Tesis de Magíster. Jaboticabal, Brasil : Univ Estadual Paulista. 76 p. [ Links ]
5. Cordero del Campillo M, Rojo- Vásquez F, Martínez A, Sánchez M. 1999. Parasitología veterinaria. Madrid: McGraw-Hill Interamericana. 968 p. [ Links ]
6. Dah-Sheng LN, Nien-Chieh S, Chang-Young AF. 2009. Prevalences of antibodies to Toxoplasma gondii in Taipei Zoo Animals. Taiwan Vet J 35(1): 43-48. [ Links ]
7. De Camps S, Dubey JP, Saville WJ. 2008. Seroepidemiology of Toxoplasma gondii in zoo animals in selected zoos in the Midwestern United States. J Parasitol 94: 648-653. doi: 10.1645/GE-1453.1 [ Links ]
8. Defler TR. 2003. Primates de Colom- bia Conservation International de Colom- bia. Bogotá: Serie de guías tropicales de campo 4. 547 p. [ Links ]
9. Dubey JP. 2010. Toxoplasmosis of animals and humans. 2a ed. Maryland: CRC Press. 336 p. [ Links ]
10. Dubey JP, Lindsay DS. 2004.Biology of Toxoplasma gondii in cats and other animals. En: Lindsay DS, Weiss LM (eds). World Class Parasites Vol 9. Opportunistic infections: Toxoplasma, Sarcocystis, and Microsporidia. United States: Springer. p 1-19. [ Links ]
11. Elmore SA, Jenkins EJ, Huyvaert KP, Polley L, Root JJ, Moore CG. 2012. Toxoplasma gondii in circumpolar people and wildlife. Vector Borne Zoonotic Dis 12: 1-9. doi: 10.1089/ vbz.2011.0705 [ Links ]
12. Frenkel JK. 1978. Toxoplasmosis in cats: diagnosis, treatment and prevention. Comp Immunol Microb 1(1): 15-20. [ Links ]
13. Fuchs L, Baldone V, Rojas M, Fort M, Bedotti D, Venturini C, Salado IEC. 2005. Prevalencia serológica a toxoplasmosis y neosporosis en el zorro gris pampeano (Pseudalopex gymno- cercus) en la provincia de la pampa (Argentina). Bol Divulgación Téc EEA Anguil 90: 122-128. [ Links ]
14. Madsen T, Ujvari B, Olsson M. 2005. Old pythons stay fit; effects of haematozoan infections on life history traits of a large tropical predator. Oecologia 142: 407-412. doi: 10.1007/ s00442-004-1742-9 [ Links ]
15. Garcia JL, Navarro IT, Ogawa L, Oliveira RC, Kobilka E. 1999. Soroprevalência, epidemiologia e avaliaço ocular da toxoplasmose huma- na na zona rural de Jaguapita (Paraná), Brasil. Rev Pan Salud Pública 6(3): 157- 163. [ Links ]
16. Garcia JL, Svoboda WK, Chryssafidis AL, Malanski L, Shiozawa MM, Aguiar L, Monteiro G, et al. 2005. Sero-epidemiological survey for toxoplasmosis in wild New World monkeys (Cebus spp.; Alouatta caraya) at the Paraná river basin, ParanáState, Brazil. Vet Parasitol 133: 307-311.DOI: 10.1016/j.vetpar.2005.06.004 [ Links ]
17. Minervino AH, Soares HS, Barrêto- Júnior RA, Neves KA, Pena HF, Ortolani EL, Dubey JP, Gennari SM. 2010. Seroprevalence of Toxoplasma gondii antibodies in captive wild mammals and birds in Brazil. J Zoo Wildl Med 41: 572-574. doi: 10.1638/2010-0046.1 [ Links ]
18. Jones TC, Bienz KW, Erb P. 1986. In vitro cultivation of Toxoplasma gondii cysts in astrocystes in the presence of gamma interferon. Infect Inmmun 51:147-156. [ Links ]
19. Lappin MR, Greene CE, Prestwood AK, Dawe DL, Tarleton RL. 1989. Enzyme-linked immunosorbent assay for the detection of circulating antigens of Toxoplasma gondii in the serum of cats. Am J Vet Res 50: 1586-1590. [ Links ]
20. Miller MA, Gardner IA, Kreuder C, Paradies DM, Worcester KR, Jessup DA, Dodd E, et al. 2002. Coastal freshwater runoff is a risk factor for Toxoplasma gondii infection of southern sea otters (Enhydra lutris nereis). Int J Parasitol 32: 997-1006. doi: 10.1016/ S0020-7519(02)00069-3 [ Links ]
21. Mills J, Childs J, Ksiazek T, Peters CJ, Velleca WM. 1998. Métodos para trampeo y muestreo de pequeños mamí- feros para estudio virológico. Organiza- ción Panamericana de la Salud, Washing- ton, EEUU. 64 p. [Internet]. Disponible en: http://www.zoonosis.ac.uk:8080/ downloa d/ a tt a chments / 22 0 20 1 25 /Trapping+manual+Espanol.pdf [ Links ]
22. Mereiles L. 2001. Estudo das fontes de Infecção da toxoplasmose humana em diferentes localidaovaldes do Estado de São Paulo. Tesis de Mestre. São Paulo: Univ de São Paulo. 171 p. [ Links ]
23. Muñoz E, Chávez A, Casas E, Suárez F, Gavidia C, Muñoz K, Gutiérrez F. 2005. Frecuencia de anticuerpos con- tra Toxoplasma gondii en monos Cebus apella criados en cautiverio. Rev Inv Vet Perú 16: 163-168. doi: 10.15381/rivep.v16i2.1565 [ Links ]
24. Payment P, Plante R, Cejka P. 2001. Removal of indicator bacteria, human enteric viruses, Giardia cysts, and Cryptosporidium oocysts at a large wastewater primary treatment facility. Can J Microbiol 47:188-193. [ Links ]
25. Sedlák K, Bártová E. 2006. Seroprevalences of antibodies to Neospora caninum and Toxoplasma gondii in zoo animals. Vet Parasitol 136: 223-231. doi:10.1016/j.vetpar. 2005.11.021 [ Links ]
26. Silva JCR, Ogassawara S, Marvulo MFV, Ferreira-Neto JS, Dubey JP. 2001. Toxoplasma gondii antibodies in exotic wild felids from Brazilian zoos. J Zoo Wildl Med 32: 349-351. [ Links ]
27. Silva JC, Vianna MF, Dias RA, Ferreira F, Amaku M, Adania CH, Ferreira Neto JS. 2007. Risk factors associated with sero-positivity to Toxoplasma gondii in captive neotropical felids from Brazil. Prev Vet Med 78: 286-295. [ Links ]
28. Silva JCR, Ogassawara S, Marvulo MFV, Ferreira-Neto JS, Dubey JP. 2001. Toxoplasma gondii antibodies in exotic wild felids from Brazilian zoos. J Zoo Wildl Med 32: 349-351. [ Links ]
29. Sobrino R, Cabezón O, Millán J, Pabón M, Arnal MC, Luco DF, Gortázar C, et al. 2007. Seroprevalence of Toxoplasma gondii antibodies in wild carnivores from Spain. Vet Parasitol 148: 187-192. doi: 10.1016/j.vetpar.2007.06.038 [ Links ] 30. Solarte Y, Peña M, Madera C. 2006. Transmisión de protozoarios patógenos a través del agua para consumo huma- no. Colombia Médica 73: 74-82. [ Links ] 31. Tenter AM, Heckeroth AR, Weiss LM. 2000. Toxoplasma gondii: From animal to humans. Int J Parasitol 30: 1217-1258. [ Links ] 32. Webster JP. 1994. Prevalence and transmission of Toxoplasma gondii in wild brown rats, Rattus norvegicus. J Parasitol 108: 407-411. [ Links ] 33. Wiener Lab. 2000. Prueba de hemaglutinación indirecta (HAI), para la detección de anticuerpos contra Toxoplasma gondii. Argentina [Internet]. Disponible en: http:// www.wiener-lab.com.ar/wiener/catalogo/archivos/6395toxotesthaisp.pdf [ Links ] 34. Zhang SY, Wei MX, Zhou ZY, Yu JY, Shi XQ. 2000. Prevalence of antibodies to Toxoplasma gondii in the sera of rare wildlife in the Shanghai Zoological Garden, People’s Republic of China. Parasitol Int 49: 171-174. Recibido: 26 de octubre de 2014 Aceptado para publicación: 28 de febrero de 2015