Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.26 no.4 Lima dic. 2015
http://dx.doi.org/10.15381/rivep.v26i4.11214
http://dx.doi.org/10.15381/rivep.v26i4.11214
ARTÍCULOS PRIMARIOS
Seroprevalencia del virus de la artritis-encefalitis en caprinos del departamento de Lima, Perú
Seroprevalence of caprine artritis-encephalitis virus in goats of Lima region, Peru
Angel Gomes M.1, Hermelinda Rivera G.1,3, Mercy Ramírez V.1, Imelda Cardozo Z.2, A. Manchego S.1
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Uni- versidad Nacional Mayor de San Marcos, Lima, Perú
2 Servicio Nacional de Sanidad Animal (SENASA), Lima, Perú
3 E-mail: hriverag2014@yahoo.es
Resumen
El objetivo del presente estudio fue determinar la seroprevalencia del virus de la artritis-encefalitis viral caprina (AEVC) en cabras de cuatro provincias del departamento de Lima, Perú. Se recolectaron 381 muestras de sangre de cabras mayores de 12 meses de edad (325 hembras y 56 machos) de 89 rebaños criados en forma intensiva (n=3), semiextensiva (n=40) y transhumante (n=46). La detección de anticuerpos en suero con- tra el AEVC se realizó mediante la prueba de ELISA de competición. El 0.26 ± 0.09% (1/381) de las cabras tuvieron anticuerpos contra el AEVC. El animal seropositivo perteneció a un rebaño de crianza semiextensiva del distrito de Huaral. Al evaluar todos los animales mayores de 12 meses (n=103) de ese rebaño, se encontraron otros nueve animales seropositivos. Las 10 cabras seropositivas fueron hembras de 2 a 5 años de edad, clínicamente normales, representando 9.7% (10/103) de seropositividad al AEVC dentro del rebaño. Todos los machos resultaron negativos. Se concluye que la CAEV está presente en baja prevalencia en rebaños caprinos del departamento de Lima.
Palabras claves: cabra, crianza semiextensiva, artritis-encefalitis viral caprina, anticuerpos, ELISA de competición
Abstract
The seroprevalence of caprine artritis-encephalitis virus (CAEV) in four provinces of Lima Region, Peru was determined in 381 goat serum samples (325 females and 56 males) older than 12 months from 89 flocks reared under intensive (n=3), semiextensive (n=49) and transhumant (n=46) production systems. The detection of antibodies against CAEV was done by a competitive-inhibition ELISA test. The overall seroprevalence of CAEV was 0.26 ± 0.09% (1/381). The seropositive goat belonged to one flock from Huaral district. The serology of all animals older than 12 months in this flock resulted in other nine seropositive goats. The 10 animals were clinically normal and represented 9.7% (10/of seroprevalence of CAEV in the flock. All bucks were negative. The results indicate that CAEV has a low seroprevalence in goats in Lima.
Keywords: goats, semi-extensive condition, caprine arthritis-ecephalitis virus, antibodies, competitive-inhibition ELISA test
Introducción
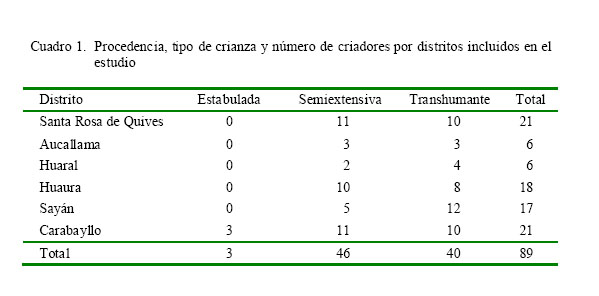
La población caprina en el Perú ha ido disminuyendo a partir de la década del 2000 llegando a 1 950 000 animales distribuidos en la sierra (68%) y costa (31%), y con una mayor concentración en los departamentos de Piura, Lima, Ayacucho, Ica y Ancash (Arroyo, 2007; INEI, 2012). El ganado caprino es criado bajo las modalidades semiextensiva o transhumante y, en menor proporción, en forma estabulada. En las dos primeras modalidades, los animales son desplazados entre la costa y la sierra para ser alimentados con pasturas naturales, rastrojos y subproductos de la agricultura, siendo la asistencia técnica escasa o nula. La crianza de tipo intensiva o estabulada es exclusiva para las cabras de razas lecheras o planteles de reproductores y poseen un mejor sistema de manejo y control sanitario (Arroyo, 2007).
La crianza caprina es una actividad sostenida por aproximadamente 200 000 familias de escasos recursos económicos, para quienes esta especie representa una fuente de ingresos por la venta de leche, queso y cabritos (Arroyo, 2007). La crianza de caprinos en el Perú enfrenta muchas limitantes para su desarrollo, tales como la falta de programas de mejoramiento genético y de control sanitario, y una deficiente asistencia técnica; sin embargo, en los últimos años, diversas ONG vienen brindando asistencia técnica a los criadores para la producción de leche y derivados (Arroyo, 2007).
Los caprinos, como todos los animales, son afectados por enfermedades infecciosas y parasitarias como la artritis-encefalitis viral caprina, brucelosis caprina, paratuberculosis (Kruze et al., 2006) y clamidiosis (GuangHui et al., 2012), que afectano los sistemas reproductivo, respiratorio, nervioso y gastroentérico del animal.
La artritis-encefalitis viral caprina es una enfermedad de distribución mundial que afecta a las cabras de todas las razas y edades. El agente causal es el virus de la artritis-encefalitis viral caprina (AEVC), perteneciente al género Lentivirus, familia Retroviridae (Peterhans et al., 2004; Leitner et al., 2010). El principal modo de transmisión de la AEVC es por ingestión del calostro o leche de la madre infectada, aunque también se ha descrito la transmisión aerógena y por el semen (Le Jan et al., 2005). El periodo entre la infección viral, la detección de anticuerpos y la aparición de los signos clínicos pueden variar desde meses a años (Rowe y East, 1997). Como todos los lentivirus, causa una infección persistente de por vida, caracterizada por una inflamación crónica y progresiva que ocasiona sinovitis articular, neumonía, mastitis y encefalitis aguda en animales jóvenes (Peterhans et al., 2004).
Estudios realizados en el país en la década del 80 mostraron que la AEVC estuvo presente, principalmente, en las granjas de cabras estabuladas en el valle de Lima, con una seroprevalencia promedio de 45%. Estudios epidemiológicos indicaron que el agente viral habría sido introducido al valle de Lima con animales importados con fines de mejoramiento genético (Adams et al., 1984; Madewell et al., 1987) y distribuido posteriormente a Piura, Ica y Ayacucho a través de animales reproductores con fines de mejoramiento, provenientes de granjas infectadas de Lima (Madewell et al., 1987; Ameghino et al., 1993).
Un estudio serológico posterior en caprinos transhumantes en Yauyos, Lima, no detectó animales seropositivos a AECV (Callapiña y Rivera, 2002). Desde entonces, no se han realizado estudios epidemiológicos sobre esta enfermedad en otras zonas de crianza caprina. Es así que el objetivo del presente estudio fue determinar la seroprevalencia del virus de la AEVC en poblaciones caprinas de cuatro provincias del departamento de Lima.
MATERIALES Y MÉTODOS
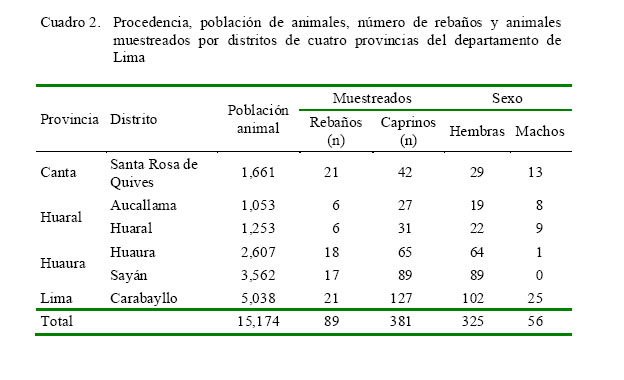
Los caprinos pertenecieron a 89 criadores de la modalidad trashumante (n=40 rebaños), semi-extensiva (n=46 rebaños) y estabulada (n=3 rebaños), con predominancia de cabras criollas sobre las razas Saanen, Alpina, Anglo-Nubian y sus cruces (Cuadro 1). La población caprina estuvo distribuida en seis distritos de cuatro provincias del departamento de Lima: Huaura (n=2607) y Sayán (n=3562) en la provincia de Huaura, Aucallama (n=1053) y Huaral (n=1253) en la provincia de Huaral, Santa Rosa de Quives (n=1661) en la provincia de Canta y San Pedro de Carabayllo (n=5038) en la provincia de Lima (Cuadro 2).
Se obtuvieron 381 muestras de sangre de cabras mayores de 12 meses, incluyendo todos los machos de los 89 rebaños (Cuadro 2). Las muestras de sangre fueron obtenidas por punción de la vena yugular. El suero fue obtenido en el lugar de muestreo por coagulación y transvasado a viales estériles, que fueron transportados al Laboratorio de Virología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima, y mantenidos en congelación a -20 ºC hasta su procesamiento.
El tamaño de muestra fue determinado utilizando la fórmula para estratificación de proporciones, considerando un 45% de prevalencia (Madewell et al., 1987) y un nivel de confianza del 95% (Ahlbom y Norell, 1990), resultando un tamaño de 381 muestras. En caso de encontrar animales seropositivos en algún rebaño, todos los animales de dicho rebaño serían muestreados para determinar el porcentaje de seropositividad de la AEVC dentro del rebaño.
Los anticuerpos fueron detectados mediante un kit de ELISA de competición de procedencia comercial (VMRD, EEUU), siguiendo el procedimiento indicado en el manual del kit. La seroprevalencia fue expresada en porcentaje con un intervalo de confianza (IC) del 95%.
Una muestra fue considerada positiva a anticuerpos contra el virus de la AEVC cuando el porcentaje de inhibición fue igual o mayor de 35%, y fue considerada negativa a anticuerpos cuando el porcentaje de inhibición fue menor de 35%.
RESULTADOS
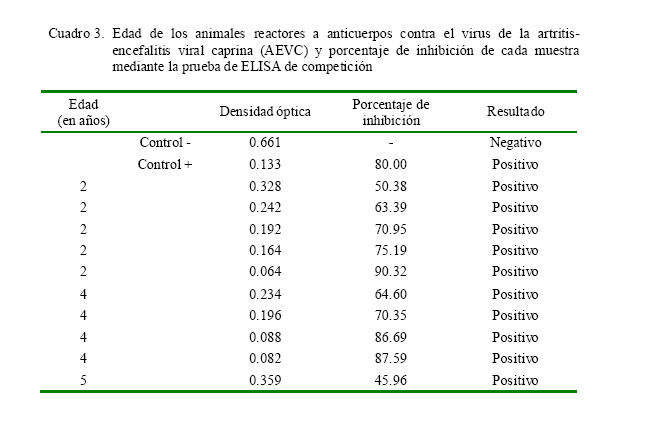
La seroprevalencia del virus de la AEVC fue de 0.26 ± 0.09% (1/381). El animal seropositivo perteneció a un rebaño de crianza semiextensiva de la provincia de Huaral. Al muestrear el total de los animales de ese rebaño (n=103), se encontraron otros nueve con anticuerpos contra la AEVC. Los 10 animales seropositivos fueron hembras representando 9.7% (10/103) de seropositividad a la AEVC dentro del rebaño. Los resultados de la prueba de ELISA de competición y las edades de los animales seropositvos se presentan en el Cuadro 3.
DISCUSIÓN
La seroprevalencia de 0.26 ± 0.09% (1/381) de la AEVC significa que la infección por este virus está presente en la población caprina con una prevalencia baja. Los animales del rebaño afectado, incluyendo las 10 cabras seropositivas, no mostraron signos clínicos de artritis, neumonía o signos nerviosos en los cabritos. Así mismo, el dueño del rebaño manifestó que no había observado animales con artritis o neumonías en el rebaño. Se sabe que en rebaños pequeños y cuando la seroprevalencia es baja (alrededor de 1%), no se observan, usualmente, signos clínicos de la enfermedad (Peterhans et al., 2004; Leitner et al., 2010).
En estudios realizados a fines de la décadas del 80 e inicios del 90, en dos rebaños de cabras de crianza estabulada del valle de Lima, se reportaron seroprevalencias mayores de 45%, observándose signos de artritis y mastitis, mientras que en rebaños de crianza semiextensiva en lugares con alta población de caprinos como Piura, Lambayeque e Ica, las seroprevalencias fluctuaron entre 2 y 8% (Madewell et al., 1987). Posteriormente Ameghino et al. (1993) detectaron 51% de seroprevalencia de AEVC en nueve rebaños de cabras mejoradas de siete departamentos del país y solo 5% en 13 rebaños de cabras criollas de crianza semiextensiva de los mismos departamentos. La alta seroprevalencia de la AEVC en cabras de razas mejoradas pudieron deberse a deficientes medidas de prevención, mayor oportunidad de transmisión a los cabritos por consumo de calostro y leche de cabras infectadas y transmisión vía aerógena por la concentración de los animales en crianza estabulada (Rowe y East, 1997).
La baja prevalencia del virus de la AEVC en las cabras en estudio podría deberse al actual mejoramiento de las condiciones sanitarias de las cabras estabuladas, la eliminación de los animales con lesiones articulares en caso de los rebaños de crianza semiextensiva o trashumante debido a la dificultad para caminar, y a la importación de animales seronegativos, ya que actualmente el virus AECV es restrictivo para la importación de cabras.
Estudios similares realizados en cabras en Rio Grande del Norte y en el noreste de Brasil reportaron seroprevalencias de AECV de 10.9% (Silva et al., 2005) y 8.2% (Bandeira et al., 2009), respectivamente, en tanto que en el Sultanato de Omán fue de 1 a 5%, mayormente en cabras de 3 a 4 años de edad (Tageldin et al., 2012) y en cabras nativas de Corea fue de 2.7% (Oem et al., 2012). En el Perú, Callapiña y Rivera (2002) no encontraron animales seropositivos en rebaños de crianzas principalmente trashumantes. Estos estudios sugieren que la introducción del virus a un rebaño, región o país es por la importación de cabras de raza o reproductores con fines de mejoramiento genético.
Según informaciones proporcionadas por el dueño del rebaño seropositivo a la AEVC, no hubo introducción de otros animales al rebaño en los últimos cinco años sugiriendo que la infección podría estar en proceso de autolimitación, dado el bajo nivel de transmisión debido al tipo de crianza.
En el presente estudio, los 56 machos evaluados y los nueve machos del rebaño resultaron negativos a anticuerpos contra la AEVC. Sobre esto, los dueños de los rebaños manifestaron que los reproductores machos no fueron importados sino que nacieron en los rebaños. Al respecto, el virus de AEVC ha sido reportado en semen (Travassos et al., 1999; Blacklaws et al., 2004); asimismo, hay reportes que señalan mayor prevalencia en machos (Bandeira et al., 2009); pero, al parecer, el semen no sería una ruta común de transmisión del virus (H. Rivera, Lima, comunicación personal).
CONCLUSIONES
-
El virus de la artritis encefalitis viral caprina (AEVC) no está difundido en rebaños de caprinos criados en forma semiextensiva y trashumante en cuatro provincias del departamento de Lima.
-
Los animales positivos a anticuerpos contra la AEVC estuvieron presentes en un solo rebaño de caprinos de la provincia de Huaral criado en forma semiextensiva.
Agradecimiento
Los autores agradecen al Dr. Mario García Podestá por sus valiosos aportes al manuscrito.
LITERATURA CITADA
1. Adams DS, Oliver RE, Ameghino E, De Martini JC, Verwoerd DW, Houwers DJ, Waghela S, et al. 1984. Global survey of serological evidence of caprine arthritis-encephalitis virus infection. Vet Rec 115: 493-495. doi: 10.1136/vr.115.19.493 [ Links ]
2. Ahlbom A, Norell S. 1990. Introduction to modern epidemiology. 2nd ed. USA: Epidemiology Resources. 102 p. [ Links ]
3. Ameghino E, Rivera H, Rosadio R, Demartini J. 1993. La artritis encefalitis caprina viral (AECV) en el Perú: estudio clínico, serológico, histopatológico y aislamiento. Latamer Peq Rumin 1(1): 63-75. [ Links ]
4. Arroyo O. 2007. Situación actual y proyecciones de la crianza de caprinos en el Perú. Arch Latinoam Prod Anim 15(Supl 1): 290-293. [ Links ]
5. Bandeira DA, de Castro RS, Azevedo EO, de Souza SeixasMelo L, de Melo CB. 2009. Seroprevalence of caprine arthritis-encephalitis virus in goats in the Cariri region, Paraiba state, Brazil. Vet J 180: 399-401. doi: 10.1016/j.tvjl2008.02.007 [ Links ]
6. Blacklaws BA, Berriatua E, Torsteinsdottir S, Watt NJ, de Andres D, Klein D, Harkiss GD. 2004. Transmission of small ruminant lentiviruses. Vet Microbiol 101: 199-208. doi: 10.1016/j.vetmic.2004.04.006 [ Links ]
7. Callapiña E, Rivera H. 2002. Seroprevalencia de artritis encefalitis viral caprina en el noroeste de la provincial de Yauyos, Lima. Rev Inv Vet Perú 13: 87-90. doi: 10.15381/rivep.v13i1.1713 [ Links ]
8. Guang-Hui Z, Chuan-Chuan S, YanQing Z, Man G, Guo-Ying F, et al. 2012. Seroprevalence of chlamydial infection in a dairy goats in Shaanxi Province, Northwestern China. Afr J Biotech 11: 1796-1799. doi: 10.5897/ AJB11.2308 [ Links ]
9. [INEI] Instituto Nacional de Estadística e Informática. 2012. IV Censo nacional agropecuario 2012. 62 p. [Internet]. Disponible en: https:// www.inei.gob.pe/estadisticas/censos/ [ Links ]
10. Kruze J, Salgado M, Paredes E, Mella A, Collins MT. 2006. Goat paratuberculosis in Chile: first isolation and confirmation of Mycobacterium avium subspecies paratuberculosis infection in a dairy goat. J Vet Diagn Invest 18: 476479. [ Links ]
11. Le Jan C, Bellaton C, Greenland T, Mornex JF. 2005. Mammary transmission of caprine arthritis encephalitis virus: a 3D model for in vitro study. Reprod Nutr Dev 45: 513-523. doi: 10.1051/ rnd:2005035 [ Links ]
12. Leitner G, Krifucks O, Weisblit L, Lavi Y, Bernstein S, Merin U. 2010. The effect of caprine arthritis encephalitis virus infection on production in goats. Vet J 183: 328-331. doi:10.1016/j.tvjl.2008.12.001 [ Links ]
13. Madewell BR, Amenghino E, Rivera H, Inope L, De Martini J. 1987. Seroreactivity of Peruvian sheep and goats to small ruminant lentivirus-ovine progressive pneumonia virus. Am J Vet Res 48: 372-374. [ Links ]
14. Oem JK, Chung JY, Byun JW, Kim HY, Kwak D, Jung BY. 2012. Largescale serological survey of caprine arthritis-encephalitis virus (CAEV) in Korean Black Goats (Capra hircus aegagrus). J Vet Med Sci 74: 16571659. doi: 10.1292/jvms.12-0103 [ Links ]
15. Peterhans E, Greenland T, Badiola J, Harkiss G, Bertoni G, Amorena B, Eliaszewicz M, et al. 2004. Routes of transmission and consequences of small ruminant lentiviruses (SRLVs) infection and eradication schemes. Vet Res 35: 257-274. doi: 10.1051/vetres:2004014 [ Links ]
16. Rowe JD, East NE. 1997. Risk factor for transmission and methods for control of caprine arthritis-encephalitis viral infection. Vet Clin North Am Food Anim Pract 13: 35-53. [ Links ]
17. Silva JS, Castro RS, Melo CB, Feijó FMC. 2005. Infecção pelo vírus da artrite encefalite caprina no Rio Grande do Norte. Arq Bras Med Vet Zootec 57: 726-731. doi: 10.1590/S0102-09352005000600003 [ Links ]
18.Tageldin MH, Johnson EH, AlBusaidi RM, Al-Habsi KR, Al-Habsi SS. 2012. Serological evidence of caprine artritis-encephalitis virus (CAEV) infection in indigenous goats in the Sultanate of Oman. Trop Anim Health Prod 44: 1-3. doi: 10.1007/s11250011-9883-4 [ Links ]
19. Travassos C, Benoit C, Valas S, Da Silva AG, Perrin G. 1999. Caprine arthritis-encephalitis virus in semen of naturally infected bucks. Small Rum Res 32: 101-106. [ Links ]
Recibido: 9 de marzo de 2015
Aceptado para publicación: 29 de junio de 2015