Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.1 Lima ene. 2016
http://dx.doi.org/10.15381/rivep.v27i1.11462
http://dx.doi.org/10.15381/rivep.v27i1.11462
ARTÍCULO DE REVISIÓN
Fotoperiodo y ontogenia inicial de peces migratorios en Brasil con énfasis en sábalo (Prochilodus lineatus)
Photoperiod and initial ontogeny of migratory fish in Brazil with special emphasis on sabalo (Prochilodus lineatus)
Éver Edrey Hernández Cuadrado1,2,3, Luis David Solis Murgas2, Michael de Jesús Buitrago Cardozo1
1 Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima, Altos de Santa Helena, Ibagué, Tolima, Colombia
2 Programa de Posgraduação em Ciências Veterinárias, Laboratório de Fisiología e Farmacología, Universidade Federal de Lavras, Minas Gerais, Brazil
3 E-mail: ecuadra@ut.edu.co
RESUMEN
El estudio de los aspectos reproductivos y de la ontogenia de los peces migradores es de gran importancia en piscicultura, especialmente cuando se trata de especies nativas, resaltándose los patrones de crecimiento y desarrollo. El objetivo delpresentetrabajofuehacer unacompilación delconocimientoactualdelaontogenia de sábalo, Prochilodus lineatus, en las fases de embrión y larva, bajo ambientes fóticos variables y desde la perspectiva de la capacidad adaptativa del fenotipo. Además, se revisaron casos de otras especies bajo cultivo o con potencial productivo. De este modo, la utilización de los cambios en los regímenes de luz y oscuridad han permitidoacelerar oretrasar lareproducción ylastasas decrecimiento,asícomo el desarrollo embrionario y larval en peces. No obstante, los datos se encuentran dispersos y en algunos casos existen vacíos de información sobre estas fases en muchas especies de peces oriundos de Brasil que migran para el desove, entre ellas el sábalo. En esta compilación se resalta la acción moduladora de algunos factores ambientales como el fotoperiodo, que pueden ser manipulados para mejorar la producción de esta especie en las etapas iniciales de su ciclo de vida. Por la naturaleza de estos factores, los esfuerzos deberán ser abordados desde la perspectiva de la adaptación o plasticidad fenotípica del modelo biológico estudiado.
Palabras clave: Prochilodus lineatus, especie nativa, crecimiento, desarrollo, fotoperiodo
ABSTRACT
The study of reproductive aspects and ontogeny of migratory fish is relevant in pisciculture, especially when it is related to native species, emphasizing the patterns of growth and development of these taxa. The present research aimed to make a compilation of current knowledge on the ontogeny of sabalo, Prochilodus lineatus, in embryonic and larval stages, under varying photic environments and the adaptive capacity of the phenotype. Besides, the cases of other species currently cultivated or potentially productive in this stages were reviewed. Thus, the manipulation of light and darkness regimes has allowed to move forward or backwards the onset of reproduction and improve growth rates, as well as the embryonic and larval development in fish. Nevertheless, data is dispersed and in some cases there are information gaps, especially on migratory fish species in Brazil, including the sabalo. In this compilation, the modulating action of some environmental factors such as photoperiod, which can be manipulated to improve the production of sabalo in the early stages of its life cycle is highlighted. By the nature of these factors, efforts should be addressed from the perspective of adaptation or phenotypic plasticity of the studied biological model.
Key words: Prochilodus lineatus, native species, growth, development, photoperiod
Introducción
Por su valor económico y ecológico, el sábalo Prochilodus lineatus (conocido en Brasil como grumatã, curimbatá, curimbá, papa-terra o curimba), es un pez de gran importancia en América del Sur dentro de las especies migratorias de tamaño mediano y grande (Botta et al., 2010). Se distribuye en las cuencas de los ríos Paraná, Paraguay, Paraíba y San Francisco (FAO, 1993), incluyendo los sistemas lénticos asociados. Se reproduce una vez por año, de octubre a marzo, y puede recorrer hasta 600 km en su ruta migratoria, la cual es altamente compleja (Hernández-Cuadrado et al., 2013).
Las especies nativas de peces migratorios son muy sensibles a cambios ambientales en las fases de embrión y larva (Maciel, 2006), de ahí la importancia del estudio de la ontogenia inicial de los taxones de interés comercial y científico como el sábalo. Esta es una especie cuyas poblaciones se encuentran amenazadas en Brasil debido al deterioro de su hábitat, la construcción de hidroeléctricas y la pesca irracional (Pesoa y Schulz, 2010) entre otros factores. Además, por necesitar del estímulo de los factores del ambiente migratorio, su reproducción en cautiverio es problemática y debe ser inducida artificialmente.
En este sentido, se han realizado algunos estudios en el sábalo de las primeras fases de su ontogenia (Botta et al., 2010), en la capacidad fertilizante del semen y la morfología del espermatozoide (Felizardo et al., 2010; Milliorini et al., 2011) y en algunos aspectos biológicos (Pesoa y Schulz, 2010). La fase larvaria es la que ha recibido menor atención, aunque se conocen los efectos de algunos factores ambientales sobre su desarrollo y crecimiento (Hernández-Cuadrado, 2013).
Por su parte, el estudio de la morfología de los organismos a través del tiempo permite la clasificación de las especies a través de sus rasgos ontogénicos y reproductivos (Sato, 1999). En el caso de los peces, sean marinos o de aguas continentales, el desarrollo es un proceso complejo que puede ser manipulado y moldeado en procedimientos biotecnológicos como bioindicador y en experimentos toxicológicos (Botero et al., 2004). No obstante, información existente sobre huevos y larvas de peces de agua dulce en Brasil son escasos en comparación con el conocimiento de la fase adulta, aunque se puede obervar un creciente interés por su estudio (Neumann et al., 2004; Arias-Gallo et al., 2010; Hernández-Cuadrado et al., 2013, 2014a,b).
Primeras Fases de la Ontogenia de los Peces
El análisis del desarrollo embrionario en peces permite la identificación temporal de la morfología en el proceso de formación de un nuevo organismo, lo cual ayuda en el manejo de la incubación y de la producción de larvas (Valbuena et al., 2012). La fase de embrión en peces es considerada como el periodo comprendido entre la fertilización y la eclosión, siendo seguida por las fase de larva, post-larva y alevino (Godinho, 2007).
Las definiciones de los estadios del desarrollo en peces han llegado a generar algunas discrepancias y confusiones. Por esto, algunos autores han propuesto el uso de una nomenclatura más estandarizada. Por ejemplo, Zaniboni-Filho et al. (2002) sugieren que la fase de huevo sea considerada como el periodo entre la fertilización y la eclosión, y la fase de larva entre la eclosión, el consumo del vitelo y el inicio de la alimentación exógena. Asimismo, la fase de poslarva comenzaría con la alimentación externa, aún con algún resto de vitelo, y finalizaría con la aparición de las aletas pectorales y aleta ventral y anal, en tanto que en la fase de alevino hay una metamorfosis completa y el pez es morfológicamente semejante a los ejemplares adultos.
Otra forma más detallada de estudiar el desarrollo embrionario en peces fue indicada por Kimmel et al. (1995), clasificando los periodos del embrión como zigoto, clivaje, blástula, gástrula, segmentación, faríngula y eclosión, para llegar a la fase de larva.
El zigoto presenta diferenciación del polo animal y vegetal, donde los huevos de peces corresponden al tipo telolecito. El clivaje comprende seis divisiones sucesivas del blastodisco (2, 4, 8, 16 y 32 células) hasta alcanzar los 64 blastómeros. El tipo de división es meroblástico y solo ocurre en el blastodisco sin comprometer el vitelo. En el último clivaje, que es el primero de tipo horizontal, se produce la membrana envolvente del blastodisco (EVL).
El periodo de blástula comienza a partir de 128 células hasta el inicio dela gastrulación; es decir, del 8° al 14° ciclo de división. También ocurren hechos importantes como la entrada del embrión en transición de la blástula media (TBM), la formación de la capa sincitial de la yema (YSL) y el comienzo de la epibolia. La TBM es de gran relevancia en el desarrollo embrionario porque es indicativo de la transcipción del RNA (Kimmel et al., 1995; Botta et al., 2010). La YSL es una estructura particular de los peces óseos, conformada por dos partes: la I-YSL, que está debajo del blastodisco y puede tener función nutritiva, y la E-YSL, que es transitoria durante los movimientos de la epibolia. Durante este periodo, el blastodisco, que inicialmente tiene forma de montículo alto, se torna más plano. El avance de la epibolia es definido como el porcentaje de yema que está cubierta por el blastodermo.
En la gastrulación ocurren los movimientos de involución, convergencia y extensión que darán origen a las capas germinativas primarias y al eje embrionario. La involución señala el comienzo de la gastrulación cuando el embrión alcanza el 50% de epibolia y aparece el anillo germinativo en el borde del blastodermo. En la convergencia se da una acumulación de células a lo largo del anillo germinativo. El movimiento morfogenético de extensión hace referencia al alargamiento del eje embrionario primario. En la segmentación se acentúan los movimentos morfogenéticos, aparecen los primeros somitos y el rudimento de los órganos, así como el estiramiento y los movimentos musculares iniciales. La faríngula se alcanza cuando morfológicamente el embrión puede ser comparado con los embriones de otros vertebrados. Después de este periodo sobreviene la eclosión y el inicio de la fase de de larva.
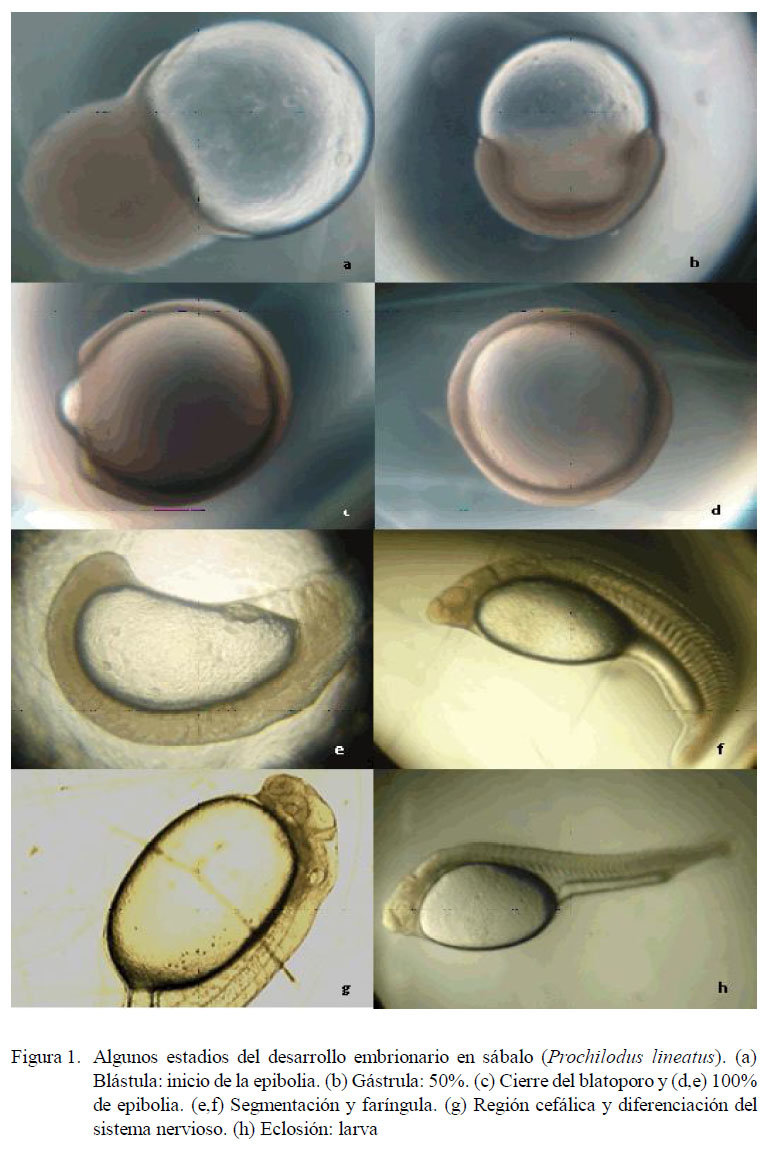
En el presente trabajo se sugiere la conjugación de la terminología de los dos autores citados (véase Kimmel et al., 1995; Botta et al., 2010) para estudios de las primeras fases de desarrollo ontogénico en peces neotropicales. Algunos de los periodos del desarrollo embrionario del sábalo (Prochilodus lineatus) se muestran en la Fig. 1.
El Sábalo y Otros Peces Migratorios de Importancia Económica en Brasil
El medioambiente externo e interno del animal afecta la reproducción estacional de los peces. Estos factores marcan el inicio de una serie compleja de alteraciones neuroendocrinas que ejercen el control general de los procesos de maduración gonadal, desova, desarrollo y crecimiento (Whitehead et al., 1978; Mustapha et al., 2012). Muchos de estos factores están relacionados con la calidad de los huevos, composición de la dieta, métodos de desova, apareamiento, manipulación, ambiente, selección y condiciones de cultivo. Así mismo, la calidad de los huevos comprende las características que determinan su capacidad de sobrevivir (Bromage et al., 2001).
Se han señalado algunos eventos clave en el desarrollo de los peces para la producción de larvas (Santos y Godinho, 1994; Godinho, 2007). Entre ellos, el tamaño de la larva al momento de la eclosión y de la formación del sistema nervioso (Fig. 1), el tiempo de reabsorción del vitelo, la pigmentación de la retina y del cuerpo, apertura de la boca y del tracto digestivo (lumen intestinal), flexión de la notocorda, desarrollo de las aletas y el llenado de la vejiga gaseosa. Por eso, el abordaje de algunos de estos aspectos es crucial en el estudio de la ontogenia de especies como P. lineatus y otros peces, sean estos migratorios o no. Además, el cierre del blastoporo (Fig. 1c,d) se le considera como uno de los eventos más importantes de la embriogénesis en piscicultura, pues indica el momento adecuado para estimar las tasas de fertilización.
Debido a la capacidad adaptativa a diversos ambientes de agua dulce, así como a su precocidad, elevada prolificidad, posibilidad de fertilización artificial, bajo costo de su alimentación y aceptación por parte del consumidor, las especies del género Prochilodus son de gran importancia comercial en varias regiones de Brasil y de América del Sur (Revaldaves et al., 1997; Atencio-García et al., 2003; Zaniboni-Filho et al., 2008; Machado y Foresti, 2012).
Además, las áreas de reproducción y larvicultura fueron destacadas como prioritarias para investigación y desarrollo en Brasil (Godinho, 2007; Hernández-Cuadrado et al., 2014b), debido al escaso conocimiento de las especies de peces continentales brasileras (Guerrero et al., 2009), particularmente en lo referente a las técnicas para el estudio de los gametos (Maria, 2005). Es importante hacer notar que en 2005, la acuicultura aportó más del 25% de la producción total de pescado en Brasil, siendo los principales productores las regiones sur, nordeste y sudeste del país (IBAMA, 2007). Asimismo, un representante del género Prochilodus (sábalo -P. lineatus) es una de las tres especies con mayores índices de producción extractiva en el país.
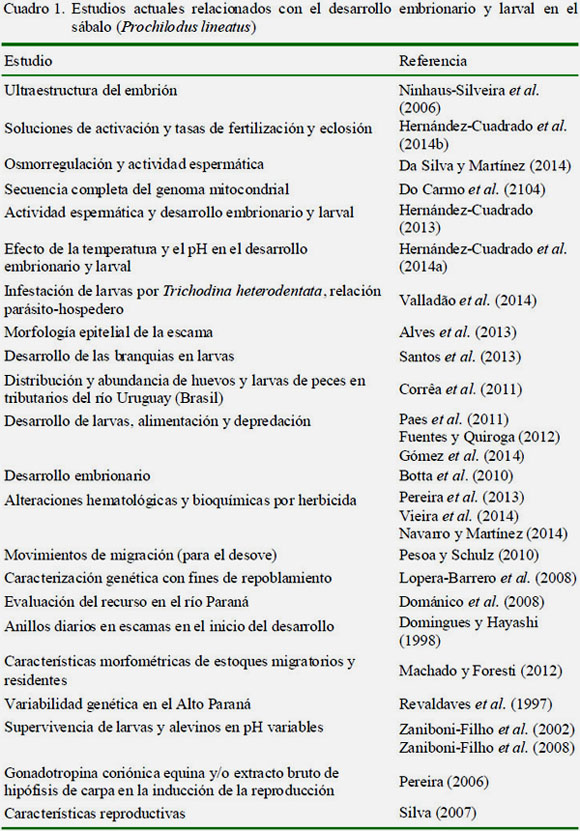
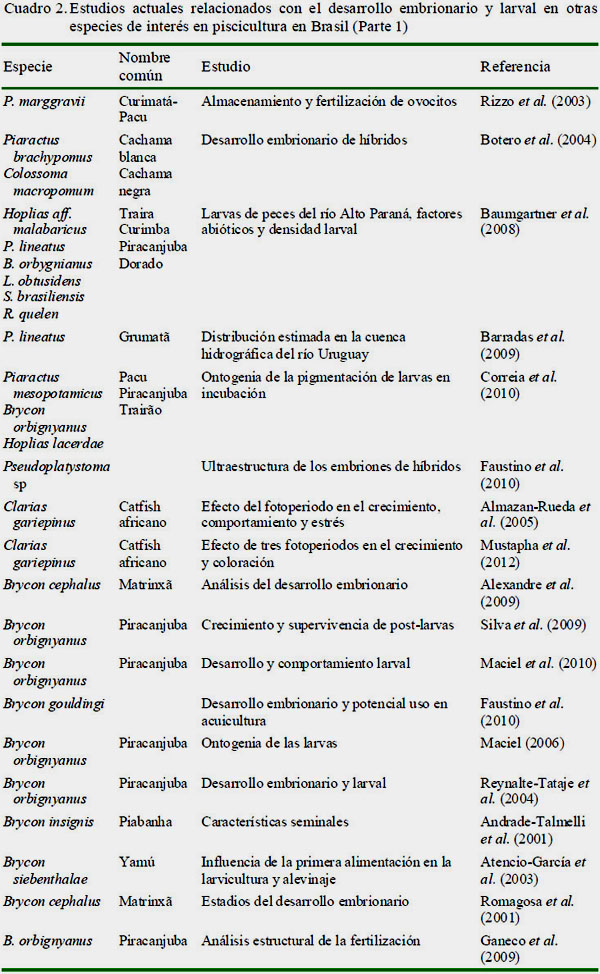
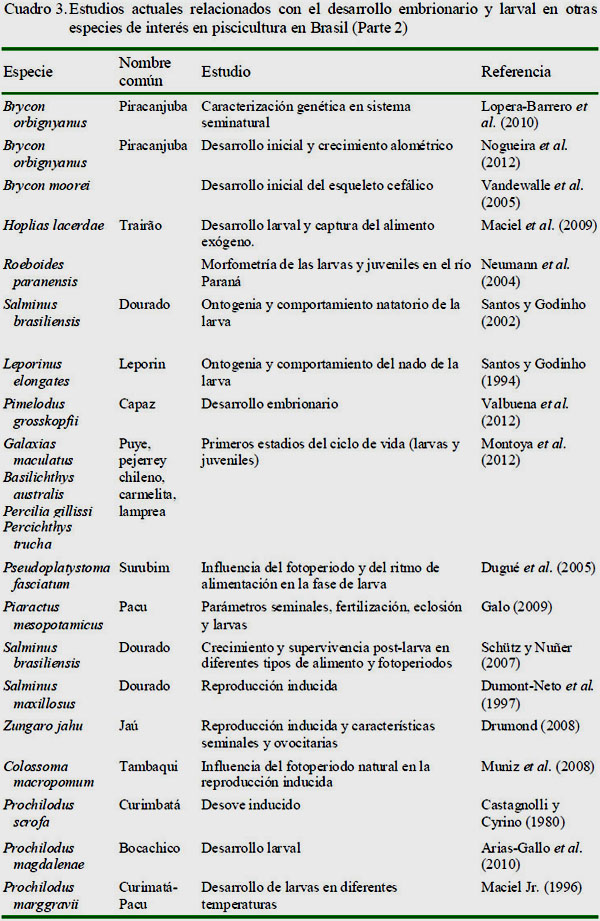
En el Cuadro 1 se muestran los estudios representativos que han sido publicados sobre desarrollo embrionario y larval del sábalo. En los cuadros 2 y 3 se presentan los trabajos llevados a cabo en otras especies de importancia económica o con potencial en la piscicultura brasilera y en América Latina.
Fotoperiodo y Plasticidad Fenotípica en la Ontogenia Inicial de los Peces
Uno de los factores de mayor efecto sobre las funciones fisiológicas en los animales es el fotoperiodo (Aschoff, 1981; Hernández-Cuadrado, 2013). Este factor es de gran relevancia en la reproducción, crecimiento y desarrollo de los teleósteos por ser la señal más importante de la estacionalidad (Martínez-Palacios et al., 2007; Mustapha et al., 2012), especialmente en especies nativas. Las exigencias de los periodos de luzoscuridad (L:O) son especie-específicas y dependen de la etapa de desarrollo del pez (Adewolu et al., 2008; Hernández-Cuadrado et al., 2014b). Así, se ha determinado en la tilapia del Nilo (Oreochromis niloticus) y en Pagrus major un mayor crecimiento en las primeras fases de su ontogenia (Rad et al., 2006; Bezerra et al., 2008) cuando fueron sometidos a fotoperiodos largos, especialmente a 24:00.
No obstante lo anterior, resultados reportados en la literatura son contradictorios, pues en algunos casos se indica un aumento del crecimiento y desarrollo con luz u oscuridad constante (Britz y Pienaar, 1992; Veras, 2011; Mustapha et al., 2012), mientras que otros estudios no encuentran diferencias de importancia (Almazan-Rueda et al., 2005). Debido a estas diferencias, se requiere la realización de investigaciones puntuales para cada especie, pues estas presentan características particulares que deben ser abordadas e interpretadas de manera diferente. La variación del fenotipo por efecto directo del ambiente ha sido encontrada en muchas especies (Loman, 2003). Es decir, la plasticidad fenotípica es considerada un fenómeno general donde los individuos modifican sus fenotipos en respuesta a señales ambientales, generalmente para adaptarse a los ambientes variables (Sadeh et al., 2011).
Según la Unión Internacional de Ciencias Fisiológicas (IUPS, 2003), la plasticidad fenotípica hace referencia a los cambios adaptativos que ocurren en un organismo como respuesta a los cambios inducidos experimentalmente. Particularmente hace referencia a factores climáticos, tales como la temperatura ambiental y la intensidad lumínica en un medio controlado. Así, se trata de cambios que reducen la tensión fisiológica producida por componentes estresantes del ambiente total y que ocurren dentro del periodo de vida de un organismo. Dentro de los factores que pueden afectar la respuesta adaptativa de un animal al ambiente se encuentran las variaciones del fotoperiodo. El término hace referencia a la variabilidad o fluctuaciones anuales en la duración del día solar, las cuales tienen gran incidencia en la reproducción de los peces de zonas templadas y tropicales (Maitra et al., 2006). El fotoperiodo puede afectar la incubación, el crecimiento, el desarrollo y la supervivencia de las larvas de peces (Baumgartner et al., 2008; Hernández- Cuadrado et al., 2014a), de allí que se sugiera que, en la naturaleza, cada especie selecciona los factores abióticos adecuados para su reproducción.
Como se observa, el fenómeno de la plasticidad fenotípica es aplicable enteramente al efecto que pueda tener la variación del fotoperiodo sobre el crecimiento y desarrollo de embriones y larvas de peces migratorios como el sábalo - P. lineatus (Hernández- Cuadrado, 2013), pez migrante de gran importancia ecológica y comercial, que ha sido usado como modelo experimental en muchos estudios en Brasil y América del Sur (Pereira et al., 2013; Hernández-Cuadrado, 2013, 2014a; Da Silva y Martínez, 2014).
Además del efecto del fotoperiodo, se debe estudiar la pigmentación (melanóforos, iridóforos) y sus patrones de aparición en los primeros estadios ontogénicos de P. lineatus, dado que este aspecto en teleósteos es indicativo del tipo de ambiente en el que habita la especie (Bolker y Hill, 2000). Algunas especies eclosionan sin pigmentación (Maciel, 2006; Arias-Gallo et al., 2010), unas tienen pigmentos en menor grado (Nakatani et al., 2001) y en otras están bien definidos, inclusive, desde antes de la eclosión (Kimmel et al., 1995; Romagosa et al., 2001; Montoya et al., 2010).
En P. lineatus existe un vacío de información sobre los patrones de pigmentación relacionados con el fotoperiodo, pero se dispone de algunos estudios sobre el particular en especies próximas (Maciel Jr, 1996; Godinho y Pompeu, 2003; Reynalte-Tataje et al., 2004; Correia et al., 2010). Esta información colateral permitirá aportar datos útiles para el entendimiento de la ecología y el manejo del sábalo en cultivo. Por otra parte, el estudio alométrico de los componentes anteriores del cuerpo (cabeza) de las larvas es importante, pues allí se encuentran los principales órganos relacionados con la coordinación de los movimientos y la percepción del ambiente (Maciel, 2006; Correia et al., 2010), como el sistema nervioso central (Fig. 2f). Recientemente, se ha establecido que el crecimiento alométrico de P. lineatus puede estar bajo la influencia del ambiente fótico (Hernández-Cuadrado et al., 2014b), pues es uno de los factores del desarrollo y crecimiento de los peces.
Se puede concluir que aunque existe un colectivo importante de trabajos sobre la ontogenia inicial de P. lineatus y otras especies, es importante continuar los estudios bajo diferentes condiciones ambientales, particularmente de fotoperiodo, buscando corroborar su acción moduladora sobre el crecimiento y el desarrollo corporal. Los resultados que puedan ser obtenidos serán de gran ayuda en la optimización de paquetes tecnológicos que busquen mejorar los procesos de fertilización y el manejo de embriones, larvas y alevinos del sábalo en piscigranjas.
Agradecimientos
Los autores agradecen al Bioterio de Animales de la Universidade Federal de Lavras, a CAPES/CNPq, Brasil y a Colfuturo, Colombia. Asimismo, a Nancy Gómez por la revisión del artículo y a la Universidad del Tolima, Colombia, por su apoyo al primer autor.
LITERATURA CITADA
1. Adewolu MA, Adeniji CA, Adejobi AB. 2008. Feed utilization, growth and survival of Clarias gariepinus (Burchell 1822) fingerlings cultured under different photoperiods. Aquaculture 283: 64-67. doi: 10.1016/j.aquaculture.2008.07.020 [ Links ]
2. Alexandre JS, Ninhaus-Silveira A, Veríssimo-Silveira R, Buzollo H, Senhorini, JA, Chaguri MP. 2009. Structural analysis of the embryonic development in Brycon cephalus (Günther, 1869). Zygote 18: 173-183. doi: 10.1017/S0967199409990190 [ Links ]
3. Almazán-Rueda P, Van-Helmond ATM, Verreth JAJ, Schrama, JW. 2005. Photoperiod affects growth, behaviour and stress variables in Clarias gariepinus. J Fish Biol 67: 1029-1039. doi: 10.1111/j.0022-1112.2005.00806.x [ Links ]
4. Alves RMS, Pereira BF, Pitol DL, Senhorini JA, Alcântara-Rocha RCG, Caetano FH. 2013. Scale morphology of Prochilodus lineatus with emphasis on the scale epithelium. Braz J Biol 73: 637-644. doi: 10.1590/S1519-69842013- 000300023 [ Links ]
5. Andrade-Talmelli EF, Kavamoto EM, Fenerich-Verani N. 2001. Características seminais da piabanha, Brycon insignis (Steindachner, 1876), após estimulação hormonal. Bol Inst Pesca 27: 149-154. [ Links ]
6. Arias-Gallo M, Jiménez-Segura LF, Dorado MP. 2010. Desarrollo larval de Prochilodus magdalenae (Steindachner, 1879) (Pisces: Prochilodontidae), Río Magdalena, Colombia. Actual Biol 32(93): 199-208. [ Links ]
7. Aschoff J. 1981. Free-running and entrained circadian rhythms. In: Aschoff J (ed). Handbook of behavioral neurobiology. Vol 4. Biological rhythms. New York: Plenum Press. p 81-93. [ Links ]
8. Atencio-García V, Zaniboni-Filho E, Pardo-Carrasco S, Arias-Castellanos A. 2003. Inûuência da primeira alimentação na larvicultura e alevinagem do yamú Brycon siebenthalae. Acta Scientarium Anim Sci 25: 61-72. doi: 10.4025/actascianimsci.v25i1.2092 [ Links ]
9. Barradas JRS, Silva LG, Fountoura NF. 2009. Distribuição presumida do grumatã (Prochilodus lineatus) na bacia hidrográfica do rio Uruguai. In: Salão de iniciação científica. Porto Alegre, PUCRS. p 213-215. [ Links ]
10. Baumgartner G, Nakatani K, Gomes LC, Bialetzki A, Sanches PV, Makrakis, MC. 2008. Fish larvae from the upper Paraná River: do abiotic factors affect larval density? Neotrop Ichthyol 6: 551-558. doi: 10.1590/S1679- 62252008000400002 [ Links ]
11. Bezerra KS, Santos AJG, Leite, MR, Da Silva, AM, De Lima, MR. 2008. Crescimento e sobrevivência da tilápia chitralada submetida a diferentes fotoperíodos. Pesq Agropec Bras 43: 737-743. doi: 10.1590/S0100-204X200 8000600010 [ Links ]
12. Bolker JA, Hill CR. 2000. Pigmentation development in hatcheryreared flatfishes. J Fish Biol 56: 1029- 1052. doi: 10.1111/j.1095-8649.2000. tb02121.x [ Links ]
13. Botero M, Fresnada A, Montoya A, Olivera M. 2004. Descripción del desarrollo embrionario de zigotos híbridos obtenidos por el cruce de machos de cachama blanca (Piaractus brachypomus) y hembras de cachama negra (Colossoma macropomum). Rev Col Cienc Pec 17(Supl): 38-45. [ Links ]
14. Botta P, Sciaraa A, Arranz S, Murgas LDS, Pereira GJM, Oberlender G. 2010. Estudio del desarrollo embrionario del sábalo (Prochilodus lineatus). Arch Med Vet 42: 109-114. doi: 10.4067/ S0301-732X2010000200014 [ Links ]
15. Britz PJ, Pienaar AG. 1992. Laboratory experiments on the effect of light and cover on the behavior and growth of African catfish, Clarias gariepinus (Pisces: Clariidae). J Zool (London) 227: 43-62. doi: 10.1111/j.1469- 7998.1992.tb04343.x [ Links ]
16. Bromage N, Porter M, Randall C. 2001. The environmental regulation of maturation in farmed finfish with special reference to the role of photoperiod and melatonin. Aquaculture 197: 63-98. doi: 10.1016/S0044-8486(01)00583-X [ Links ]
17. Castagnolli N, Cyrino JEP. 1980. Desova induzida do curimbatá Prochilodus scrofa Steindachner, 1881 (Pisces, Prochilodontidae). Ciência e Cultura 32: 1245-1253. [ Links ]
18. Corrêa RN, Hermes-Silva S, Reynalte-Tataje D, Zaniboni-Filho E. 2011. Distribution and abundance of fish eggs and larvae in three tributaries of the Upper Uruguay River (Brazil). 91: 51- 61. doi: 10.1007/s10641-010-9759-x
19. Correia MA, Maciel CMRR, Nascimento LDS, Maciel Jr A. 2010. Ontogenia da pigmentação das três espécies de characiformes, criadas em incubatório. Enciclopédia Biosfera 6(11): 1-14. [ Links ]
20. Da Silva AFO, Martinez CBR. 2014. Acute effects of cadmium on osmoregulation of the freshwater teleost Prochilodus lineatus: enzymes activity and plasma ions. Aquat Toxicol 156: 161- 168. doi: 10.1016/j.aquatox.2014.08.009 [ Links ]
21. Do Carmo AO, Dias PFRD, Martins APV, Bedore AG, Kalapothakis E. 2014. Complete mitochondrial genome sequence of Prochilodus lineatus (Characiformes, Prochilodontidae). Mitochondrial DNA. [Internet]. Disponible en: http://informahealthcare.com/ doi/full/10.3109/19401736.2014.971300. doi: 10.3109/19401736.2014.971300 [ Links ]
22. Dománico A, Ros AS, Demonte LD. 2008. Proyecto evaluación del recurso sábalo (Prochilodus lineatus) en el Paraná: Informe de los resultados de la segunda etapa 2006-2007. Buenos Aires: Secretaría de Agricultura, Ganadería, Pesca y Alimentos Subsecretaría de Pesca y Acuicultural. 25 p. [ Links ]
23. Domingues WM, Hayashi C. 1998. Estudo experimental sobre anéis diários em escamas nas fases iniciais do desenvolvimento do curimba, Prochilodus lineatus (Valenciennes, 1836) (Characiformes, Prochilodontidae). Rev Bras Biol 58: 609-617. doi: 10.1590/S0034-71081998000400008 [ Links ]
24. Drumond MM. 2008. Reprodução induzida de jaú, Zungaro jahu: análise das características seminais e ovocitárias. MSc Thesis. Lavras, Brazil: Universidade Federal de Lavras. 102 p. [ Links ]
25. Dugué R, Corcuy N, Duponchelle F, Renno JF, Legendre M, Nuñez J. 2005. Influencia del fotoperiodo y del ritmo de alimentación sobre la sobrevivencia larval del surubí (Pseudoplatystoma fasciatum). En: Comunicaciones del Coloquio Internacional «Biología de las poblaciones de peces de la Amazonía y pscicultura». Iquitos, Perú. p 199-204. [ Links ]
26. Dumont-Neto E, Pelli A, Freitas RO, Costa CL Freitas RO, Barbosa NDC. 1997. Reprodução induzida do dourado (Salminus maxillosus, Valenciennes, 1849) na Estação de Pesquisa e Desenvolvimento Ambiental de Volta Grande-CEMIG/EPDA/VG. Rev Unimar 19: 439-445. [ Links ]
27. [FAO] Organización de las Naciones Unidas para la Alimentación y la Agricultura. 1993. Sinopsis sobre los datos biológico y pesqueros del sábalo Prochilodus lineatus (Valenciennes, 1847). Roma: FAO. Sinopsis sobre la pesca. No. 54. 64 p. [ Links ]
28. Faustino F, Nakaghi LS, Neumann E. 2010. Brycon gouldingi (Teleostei, Characidae): aspects of the embryonic development in a new fish species with aquaculture potential. Zygote 19: 351- 363. doi: 10.1017/S0967199410000535 [ Links ]
29. Felizardo VO, Mello RA, Murgas LD, Andrade ES, Drumond MM, Rosa PV. 2010. Effect of cryopreservant combinations on the motility and morphology of curimba (Prochilodus lineatus) sperm. Anim Reprod Sci 122: 259-263. doi: 10.1016/j.anireprosci.- 2010.08.020 [ Links ]
30. Fuentes CM, Quiroga F. 2012. Net feeding in ichthyoplankton samples from the Paraná River. J Plankton Res 34: 967-975. doi: 10.1093/plankt/fbs055 [ Links ]
31. Galo JM. 2009. Avaliação dos parâmetros seminais de pacu (Piaractus mesopotamicus) e sua correlação com as taxas de fertilização, eclosão e morfologia das larvas. MSc Thesis. Maringá, Brazil: Universidade Estadual de Maringá. 67 p. [ Links ]
32. Ganeco LN, Franceschini-Vicentini IB, Nakaghi LSO. 2009. Structural analysis of fertilization in the ûsh Brycon orbignyanus. Zygote 17: 93-99. doi: 10.1017/S0967199408005030 [ Links ]
33. Godinho H. 2007. Estratégias reprodutivas de peixes aplicadas à aqüicultura: bases para o desenvolvimento de tecnologias de produção. Rev Bras Reprod Anim 31: 351-360. [ Links ]
34. Godinho HL, Pompeu PSA. 2003. Importância dos ribeirões para os peixes de piracema. In: Godinho HP, Godinho AL (eds). Águas, peixes e pescadores do São Francisco de Minas Gerais. Belo Horizonte: PUC-Minas. p 361-372. [ Links ]
35. Gómez MI, Sánchez S, Fuentes CM. 2014. Shrinkage of Prochilodus lineatus (Valenciennes, 1847) larvae preserved in either ethyl-alcohol or formalin in relation to their developmental stage and feeding condition. J Appl Ichthyol 30: 140-144. doi: 10.1111/ jai.12308 [ Links ]
36. Guerrero HY, Cardillo E, Poleo G, Marcano D. 2009. Reproductive biology of freshwater fishes from the Venezuelan floodplains. Fish Physiol Biochem 35: 189-196. doi: 10.1007/ s10695-008-9249-7 [ Links ]
37. Hernández-Cuadrado EE, Murgas LDS, Badot PM, DeGiorgi F. 2014a. Sinergia de cambios térmicos y de pH sobre la ontogenia inicial de P. lineatus. Rev Col Cienc Anim 6: 9-18. [ Links ]
38. Hernández-Cuadrado EE, Murgas LDS, Felizardo VO, Ferreira MR, Andrade ES. 2014b. Extension of sperm motility leads to increased rates of fertilization and hatching of curimba, Prochilodus lineatus. J Appl Ichthyol 30: 329-333. doi: 10.1111/jai.12259 [ Links ]
39. Hernández-Cuadrado EE. 2013. Indução da atividade espermática e desenvolvimento embrionário e larval de curimba (Prochilodus lineatus). PhD Thesis. Lavras, Brazil: Universidade Federal de Lavras. 183 p. [ Links ]
40. [IBAMA] Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis. 2007. Estatística da pesca grandes regiões e unidades da federação. Brasília. Disponible en: www.ibama.gov.br/documentos-recursos- pesqueiros/estatistica-pesqueira [ Links ]
41. [IUPS] International Union of Physiological Sciences. 2003. Glossary of terms for thermal biology. J Thermal Biol 28: 75-106. doi: 10.1016/S0306- 4565(02)00055-4 [ Links ]
42. Kimmel CB, Ballard WW, Kimmel SR, Ullmann B, Schilling, TF. 1995. Stages of embryonic development of the zebrafish. Dev Dyn 203: 253-310. [ Links ]
43. Loman J. 2003. Growth and development of larval Rana temporaria: local variation and countergradient selection. J Herpetol 37: 595-602. doi: 10.1670/31-02AN [ Links ]
44. Lopera-Barrero NM, Ribeiro RP, Vargas L, Povh JA, Gomes PC, Mangolin CA, Boso KMO, Gualda T. 2008. Caracterização genética de estoques de curimbatá (Prochilodus lineatus) utilizados em programas de repovoamento. Biosci J 24: 86-93. [ Links ]
45. Lopera-Barrero NM, Vargas L, Sirol RN, Ribeiro RP, Povh JA, Mangolin CA. 2010. Caracterização genética de Brycon orbignyanus utilizando o sistema seminatural. Arq Bras Med Vet Zootec 62: 184-191. [ Links ]
46. Machado MRF, Foresti F. 2012. Morphometric characteristics of Prochilodus lineatus (Valenciennes 1847), of the migratory and resident stocks of the river Mogí-Guaçu, São Paulo State, Brazil. Acta Scientiarum Anim Sci 34: 341-346. doi: 10.4025/ actascianimsci.v34i4.14445 [ Links ]
47. Maciel CMR, Lanna EATL, Junior AM, Donzele JL, Neves CA, Menin E. 2010. Morphological and behavioral development of the piracanjuba larvae. Rev Bras Zootec 39: 961-970. doi: 10.1590/S1516-35982010000500004 [ Links ]
48. Maciel CMR, Maciel Jr A, Donzele JL, Lanna EAT, Menin E. 2009. Desenvolvimento morfológico das larvas de Hoplias lacerdae Miranda Ribeiro, 1908 (Characiformes, Erythrinidae), da eclosão até a metamorfose, relacionado com a capacidade de capturar alimento exógeno. Biotemas 22: 103-111. doi: 10.5007/2175-7925.2009v22n3p103 [ Links ]
49. Maciel CMR. 2006. Ontogenia das larvas de piracanjuba, Brycon orbignyanus Valenciennes (1849) (Characiformes, Characidae, Bryconinae). PhD Thesis. Viçosa, MG: Universidade Federal de Viçosa. 229 p. [ Links ]
50. Maciel Jr A. 1996. Desenvolvimento inicial de larvas de Curimatá-Pacu (Prochilodus marggravii Walbaum, 1792) (Characiformes, Prochilodontidae) submetidas a diferentes temperaturas de incubação. MSc Thesis. Viçosa, MG: Universidade Federal de Viçosa. 59 p. [ Links ]
51. Maitra SK, Seth M, Chattoraj A. 2006. Photoperiod, pineal photoreceptors and melatonin as the signal of photoperiod in the regulation of reproduction in fish. J Endocrinol Reprod 10: 73-87. [ Links ]
52. Maria AN. 2005. Diluidores e crioprotetores no resfriamento e congelamento do sêmen de piracanjuba (Brycon orbignyanus). 2005. MSc Thesis. Lavras, Brazil. Universidade Federal de Lavras. 71 p. [ Links ]
53. Martínez-Palacios CA, Chávez-Sosa JC, Santoyo-Guzmán VO, Campos- Mendoza A, Martinez-Chavez CC, Ross G. 2007. The effect of photoperiod on the reproduction of Chirostoma estor estor Jordan 1879 from Lago de Paátzcuaro, Mexico. J Appl Ichthyol 23: 621-623. [ Links ]
54. Milliorini AB, Murgas LDS, Rosa PV, Oberlender G, Pereira GJ, Costa DV. 2011. A morphological classiûcation proposal for curimba (Prochilodus lineatus) sperm damages after cryopreservation. Aquaculture Res 42: 177-187. doi: 10.1111/j.1365-2109.2010.- 02575.x [ Links ]
55. Montoya A, Arias M, Olivera-Angel M. 2010. Embryonic development of Bryconamericus caucanus (Characidae: Tetragonpterinae) under laboratory conditions. Int J Morphol 28: 869-872. doi: 10.4067/S0717-95022010000300032 [ Links ]
56. Montoya G, Jara A, Solis-Lufi K, Colin N, Habit E. 2012. Primeros estadios del ciclo de vida de peces nativos del Río San Pedro (Cuenca del Río Valdivia, Chile). Gayana (Concepc) 76(Supl 1): 86-100. doi: 10.4067/S0717-653820120- 00100008 [ Links ]
57. Muniz JASM, Catanho MTJ, Santos AJG. 2008. Influência do fotoperiodo natural na reprodução induzida do tambaqui, Colossoma macropomum (CUVIER, 1818). B Inst Pesca, Sao Paulo 34: 205-211. [ Links ]
58. Mustapha MK, Okafor BU, Olaoti KS, Oyelakin OK. 2012. Effects of three different photoperiods on the growth and body coloration of juvenile African catfish, Clarias gariepinus (Burchell). Arch Pol Fish 20(1): 55-59. doi: 10.2478/ v10086-012-0007-1 [ Links ]
59. Nakatani K, Agostinho AA, Baumgartner G, Bialetzki A, Sanches PV, Makrakis MC, Pavanelli CS. 2001. Ovos e larvas de peixes de água doce: desenvolvimento e manual de identificação. EDUEM. Maringá. 378 p. [ Links ]
60. Navarro CD, Martinez CB. 2014. Effects of the surfactant polyoxyethylene amine (POEA) on genotoxic, biochemical and physiological parameters of the freshwater teleost Prochilodus lineatus. Comp Biochem Physiol C Toxicol Pharmacol 165: 83-90. doi: 10.1016/j.cbpc.2014.06.003 [ Links ]
61. Neumann E, Nakatani K, Sanches PV, Baumgartner G. 2004. Morphometry of larvae and juveniles of Roeboides paranensis (Osteichthyes) of the Paraná River, Brazil. In: International Congress on the Biology of Fish. Manaus, Brazil. p 107-117. [ Links ]
62. Ninhaus-Silveira A, Foresti F, Azevedo A. 2006. Structural and ultrastructural analysis of embryonic development of Prochilodus lineatus (Valenciennes, 1836) (Characiforme; Prochilodontidae). Zygote 14: 217-229. [ Links ]
63. Nogueira LB, Godinho AL, Godinho HP. 2012. Early development and allometric growth in hatchery-reared characin Brycon orbignyanus. Aquaculture Res 45: 1004-1011. doi: 10.1111/are.12041 [ Links ]
64. Paes TASV, Paes JMV, Rojas NET, Rocha O, Wisniewski MJDS. 2011. Effects of liming and development of curimbatá (Prochilodus lineatus) larvae on the abundance of zooplankton in fish ponds. Acta Limnol Bras 23: 386-393. doi: 10.1590/S2179-975X2012005000017 [ Links ]
65. Pereira GJM. 2006. Utilização de gonadotropina coriônica equina e/ou extrato bruto de hipófise de carpa na indução da reprodução de curimba (Prochilodus lineatus). MS Thesis. Lavras, MG: Universidade Federal de Lavras. 61 p. [ Links ]
66. Pereira L, Fernandes MN, Martinez C. 2013. Hematological and biochemical alterations in the fish Prochilodus lineatus caused by the herbicide clomazone. Environ Toxicol Pharmacol 36: 1-8. doi: 10.1016/j.etap.2013.02.019 [ Links ]
67. Pesoa N, Schulz UH. 2010. Diel and seasonal movements of grumatã Prochilodus lineatus (Valenciennes 1836) (Characiformes: Prochilodontidae) in the Sinos River, Southern Brazil. Braz J Biol 70: 1169-1177. doi: 10.1590/S1519- 69842010000600006 [ Links ]
68. Rad F, Bozaoglu S, Gozukara S, Karahan A, Kurt G. 2006. Effects of different long-day photoperiods on somatic growth and gonadal development in Nile tilapia (Oreochromis niloticus L.). Aquaculture 255: 292-300. doi: 10.1016/j.aquaculture.2005.11.028 [ Links ]
69. Revaldaves E, Renesto E, Machado MFPS. 1997. Genetic variability of Prochilodus lienatus (Characiformes, Prochilodontidae) in the upper Paraná river. Braz J Genet 20: 381-388. doi: 10.1590/S0100-84551997000300005 [ Links ]
70. Reynalte-Tataje DA, Zaniboni-Filho E, Esquivel JR. 2004. Embryonic and larvae development of piracanjuba, Brycon orbignyanus Valenciennes, 1849 (Pisces, Characidae). Acta Scientiarum Biol Sci 26: 67-71. [ Links ]
71. Rizzo E, Godinho HP, Sato Y. 2003. Short-term storage of oocytes from the neotropical teleost fish Prochilodus marggravii. Theriogenology 60: 1059- 1070. doi: 10.1016/S0093-691X(03)- 00108-0 [ Links ]
72. Romagosa E, Narahara MY, Fenerich-Verani N. 2001. Stages of embryonic development of the matrinxã, Brycon cephalus (Pisces, Characidae). Bol Inst Pesca 27: 27-32. [ Links ]
73. Sadeh A, Truskanov N, Mangel M, Blaustein L. 2011. Compensatory development and costs of plasticity: larval responses to desiccated conspecifics. PLoS One 6(1). e15602. doi: 10.1371/ journal.pone.0015602 [ Links ]
74. Santos JE, Godinho HP. 1994. Larval ontogeny and swimming behaviour of the leporin fish Leporinus elongates (Valenciennes, 1874) under experimental conditions. Arq Bras Med Vet Zootec 48: 109-116. [ Links ]
75. Santos JE, Godinho HP. 2002. Ontogenic events and swimming behavior of larvae of the characid fish Salminus brasiliensis (Cuvier) (Characiformes, Characidae) under laboratory conditions. Rev Bras Zool 19: 163-171. [ Links ]
76. Santos PN, Maciel CMRR, Junior AM, Do Nascimento RG. 2013. Ontogenia das brânquias de Prochilodus lineatus. Enciclopédia Biosfera 9: 3799-3806. [ Links ]
77. Sato Y. 1999. Reproduction of São Francisco river basin fishes: induction and characterization of patterns. PhD Thesis. Brazil: Universidade Federal de São Carlos. 98 p. [ Links ]
78. Schütz JH, Nuñer APO. 2007. Growth and survival of dorado Salminus brasiliensis (Pisces, Characidae) postlarvae cultivated with different types of food and photoperiods. Braz Arch Biol Technol 50: 435-444. doi: 0.1590/S1516- 89132007000300010 [ Links ]
79. Silva JMA. 2007. Caracteristicas reprodutivas de curimba (Prochilodus lineatus), pacu (Piaractus mesopotamicus) e piracajuba (Brycon orbignyanus). MSc Thesis. Lavras, MG: Universidade Federal de Lavras. 75 p. [ Links ]
80. Silva MO, Logato PVR, Murgas LDS, Ribeiro PAP, Maria AN. 2009. Crecimiento y supervivencia de postlarvas de piracanjuba (Brycon orbignyanus). Arch Zootec 58: 285-288. [ Links ]
81. Valbuena-Villarreal RD, Zapata- Berruecos BE, Ruales CR, Cruz- Casallas, PE. 2012. Desarrollo embrionario del capaz Pimelodus grosskopfii (Steindachner, 1879). Int J Morphol 30: 150-156. doi: 10.4067/S0717-950220120- 00100027 [ Links ]
82. Valladão GMR., Gallani SU, De Pádua SB, Martins ML, Pilarski F. 2014. Trichodina heterodentata (Ciliophora) infestation on Prochilodus lineatus larvae: a host-parasite relationship study. Parasitology 141: 662- 669. doi: 10.1017/S0031182013001480 [ Links ]
83. Vandewalle G, Germeau P. Besancenet E, Parmentier E, Baras PE. 2005. Early development of the head skeleton in Brycon moorei (Pisces, Ostariophysi, Characidae). J Fish Biol 66: 996-1024. doi: 10.1111/j.0022-1112.2005.00656.x [ Links ]
84. Veras GC. 2011. Fotoperíodos no comportamento locomotor e desenvolvimento de alevinos de tilápia do Nilo (Oreochromis niloticus). PhD Thesis. Lavras, MG: Universidade Federal de Lavras. 97 p. [ Links ]
85. Vieira CED, Almeida MS, Galindo BA, Pereira L, Martinez CBR. 2014. Integrated biomarker response index using a neotropical fish to assess the water quality in agricultural áreas. Neotrop Ichthyol 12: 153-164. doi: 10.1590/S1679-62252014000100017 [ Links ]
86. Whitehead C, Bromage NR, Forster JR, Matty AJ, Ralph J, Taylor S. 1978. The effects of alterations in photoperiod on ovarian development and spawning time in the rainbow trout (Salmo gairdneri). Ann Biol Anim Bioch Biophys 18: 1035-1043. [ Links ]
87. Zaniboni-Filho E, Meurer S, Golombieski JI, Silva L V F, Baldisserotto B. 2002. Survival of Prochilodus lineatus (Valenciennes) fingerlings exposed to acute pH changes. Acta Scientiarum 24: 917-920. [ Links ]
88. Zaniboni-Filho E, Nuñer PO, Reynalte-Tataje DA, Serafini RL. 2008. Water pH and Prochilodus lineatus larvae survival. Fish Physiol Biochem 35: 151-155. doi: 10.1007/ s10695-008-9235-0 [ Links ]
Recibido: 8 de mayo de 2015
Aceptado para publicación: 22 de septiembre de 2015