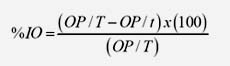Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.1 Lima ene. 2016
http://dx.doi.org/10.15381/rivep.v27i1.11467
http://dx.doi.org/10.15381/rivep.v27i1.11467
Evaluación in vitro de Cordyceps bassiana (Ascomycota: Sordariomycetes) en el Control Biológico de Rhipicephalus microplus
In vitro evaluation of Cordyceps bassiana (Ascomycota: Sordariomycetes) in the biogical control of Rhipicephalus microplus
Diego José García-Corredor1,3, Roger Iván Rodríguez-Vivas2, Martín Orlando Pulido-Medellín1, Adriana María Díaz-Anaya1, Roy José Andrade-Becerra1
1 Grupo de Investigación GIDIMEVETZ, Programa de Medicina Veterinaria y Zootecnia, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Boyacá, Colombia
2 Facultad de Medicina Veterinaria, Universidad Autónoma de Yucatán, México
3 E-mail: pibegarcia@yahoo.es
RESUMEN
En el presente estudio se evaluó la eficacia in vitro de Cordyceps bassiana en el control biológico de la fase adulta de Rhipicephalus microplus. Se aplicó la técnica de inmersión de garrapatas adultas en una solución con la cepa BbF2011 de C. bassiana en concentraciones de 1x104 , 1x106 y 1x108 conidias/ml (30 garrapatas por tratamiento). Las garrapatas tratadas a una concentración de 1x108 conidias/ml alcanzaron el 100% de mortalidad al día 15 postratamiento (PT), mientras que las concentraciones 1x106 y 1x104 conidias/ml lo obtuvieron en los días 18 y 21 PT, respectivamente (p<0.05). La mortalidad fue directamente proporcional a la concentración de C. bassiana. Asimismo, las garrapatas en la concentración de 1x108 conidias/ml presentaron una menor postura de huevos y porcentaje de eclosión de larvas que los tratamientos con 1x106 y 1x104 conidias/ml (p<0.05). La efectividad presentada por C. bassiana sobre R. microplus abre la opción a un nuevo método de control biológico.
Palabras clave: control biológico, Rhipicephalus microplus, Cordyceps bassiana, hongos entomopatógenos
ABSTRACT
The aim of the present study was to evaluate the in vitro efficacy of Cordyceps bassiana for the control of the adult stage of Rhipicephalus microplus. The adult immersion test in a solution containing the BbF2011 strain of C. bassiana at the concentrations of 1x104 , 1x106 and 1x108 conidia/ml (30 ticks per treatment) was evaluated. Treated ticks at a concentration of 1x108 conidia/ml reached 100% mortality at 15 days post-treatment (PT), while ticks at concentrations of 1x106 y 1x104 conidia/ml reached it at 18 and 21 days PT, respectively. Tick mortality was directly related to the fungi concentration. Moreover, ticks at the concentration 1x108 conidia/ml showed the lowest oviposition and larva hatching as compared to 1x106 and 1x104 conidia/ml concentrations (p<0.05). The effectiveness shown by C. bassiana on R. microplus opens the option to a new biological control method.
Key words: biological control, Rhipicephalus microplus, Cordyceps bassiana, entomopathogenic fungi
INTRODUCCIÓN
Las garrapatas, en regiones tropicales y subtropicales, son consideradas como potenciales transmisores de agentes patógenos (protozoos, rickettsias, espiroquetas y virus) a humanos y animales (Jongejan y Uilenberg 2004). Rhipicephalus microplus (Canestrini, 1887) (Acari: Ixodidae) es una garrapata de un hospedero que se encuentra distribuida en estas regiones (Murrel y Barker, 2003).
La infestación de bovinos con R. microplus representa un impacto económico significativo a los ganaderos, debido a la reducción en la ganancia de peso y en la producción de leche. Además, la garrapata es potencial transmisora de agentes patógenos causantes de enfermedades como anaplasmosis y babesiosis, además de algunas antropozoonosis, amenazando seriamente no solo la producción ganadera, sino también la salud del hombre (Sun et al., 2013).
El control biológico de las infestaciones de garrapatas ha sido difícil porque estas cuentan con pocos enemigos naturales y, por lo tanto, los métodos de control se basan en la aplicación regular de acaricidas químicos. Sin embargo, el uso continuo de acaricidas tiene efectos adversos, incluidos la presencia de residuos de medicamentos en productos como la leche y la carne (Sun et al., 2010), la aparición de cepas de garrapatas resistentes a los productos químicos y la contaminación ambiental (Cova et al., 2009). Estos efectos motivaron la búsqueda de métodos alternativos de control, destacándose la elaboración de vacunas contra las garrapatas, el desarrollo de razas de bovinos resistentes y el control biológico (Rodríguez-Vivas et al., 2005).
Los hongos entomopatógenos son considerados como enemigos naturales de gran importancia en el control de artrópodos, por lo que podrían ser utilizados como control biológico de garrapatas. Recientemente, los esfuerzos se han enfocado en la evaluación del potencial de los hongos como agentes de control biológico contra artrópodos (Fernandes y Bittencourt, 2008). Cordyceps bassiana se perfila como una alternativa eficaz para el control de R. microplus, buscando dar solución a un problema que aqueja a las poblaciones bovinas tropicales y subtropicales (Paião et al., 2001; Yao y Huang, 2004; Sun et al., 2013).
Diversos estudios han destacado la importancia de C. bassiana como método de control de agentes patógenos en el área agrí- cola y pecuaria (Sagüés et al., 2011; Okamoto y Amarasekare, 2012); sin embargo su empleo como método de control de R. microplus es limitado debido al desconocimiento de su acción sobre este ectoparásito (Fernández et al., 2010). El presente estudio tuvo como objetivo determinar la funcionalidad in vitro de C. bassiana como control biológico de R. microplus, brindando así una alternativa eficaz en la disminución de los daños ocasionados por esta garrapata en las explotaciones bovinas.
MATERIALES Y MÉTODOS
El estudio se realizó en el Laboratorio de Parasitología Veterinaria de la Universidad Pedagógica y Tecnológica de Colombia, ubicada en la ciudad de Tunja, Boyacá, Colombia. La temperatura promedio anual es de 13 ºC y presenta una altitud de 2690 msnm y una precipitación pluvial anual de 645 mm (Rojas et al., 2010).
Se utilizó la cepa BbF2011 del hongo entomopatógeno Cordyceps bassiana originario de la Sabana de Bogotá, Colombia. El crecimiento y reproducción del hongo se realizó en agar Sabouraud dextrosa (Moorhouse et al., 1993), enriquecido con 1% de extracto de levaduras y 500 ppm de cloranfenicol. Se incubó a 25 ºC y 70% de humedad durante tres semanas. La cosecha de conidias se realizó por raspado y se suspendió en agua destilada estéril con 0.1%/vv (Fernández et al., 2010). La concentración de conidias (1x104 , 1x106 y 1x108 ) se determinó de forma directa utilizando el hematocitómetro de Neubauer.
Para la evaluación in vitro del efecto de C. bassiana sobre R. microplus, se recolectaron garrapatas hembras adultas pletóricas (0.20-0.25 g) de bovinos de la provincia de Ricaurte en el departamento de Boyacá (Colombia). Las garrapatas fueron depositadas en tubos de cristal con tapón de algodón y se trasladaron al laboratorio. Las garrapatas fueron desinfectadas con cloro (1%), pesadas y distribuidas en cuatro grupos, donde el grupo I fue tratado con agua destilada (control), mientras que los grupos II, III y IV fueron tratados con C. bassiana en concentraciones de 1x104 , 1x106 y 1x108 conidias/ml.
Para evaluar el efecto de C. bassiana sobre la inhibición de la ovoposición (IO) y porcentaje de eclosión de huevos de R. microplus se empleó la técnica de inmersión de hembras repletas (Drummond y Whetstone, 1970). Se utilizaron 30 garrapatas hembras por tratamiento. El rango de peso de los ácaros fue de 0.20 a 0.25 g. Las garrapatas fueron inmersas en el biopreparado durante 60 segundos, donde las garrapatas fueron colocadas en placas de cultivo de 24 pozos con 1.5 ml del biopreparado. Luego, las garrapatas fueron secadas e incubadas durante 21 días en cámaras húmedas para cada tratamiento (90% de humedad relativa, HR) a 25 °C. Se realizaron observaciones diarias con el microestereoscopio para comprobar la mortalidad y el desarrollo de micosis mediante la observación del tubo germinativo del hongo sobre el exoesqueleto de las garrapatas.
Para determinar el efecto sobre la ovoposición (OP), los huevos se retiraron a los 14 días de incubación, se pesaron e incubaron bajo condiciones controladas de humedad y temperatura (28 °C y 85% HR). El porcentaje de ovoposición se obtuvo determinando la relación porcentual del peso de huevos depositados por hembra (g) multiplicado por 20 000 (constante equivalente al número de huevos en 1 g) sobre el peso de las hembras por tratamiento (g). Una vez obtenido este parámetro, tanto para individuos tratados como para los del grupo testigo, se aplicó la siguiente fórmula para determinar la IO, donde OP/T es la reproducción estimada del grupo testigo y OP/t es la reproducción estimada del grupo tratado (Fernández et al., 2010).
En el cálculo de la eclosión de larvas se tomaron cinco alícuotas de una muestra homogenizada de 1 g de huevos incubada a 28 °C y 85% HR por 35 días. Se realizó el conteo de 100 huevos, diferenciando cascarones rotos y enteros y se determinó el promedio de eclosión por tratamiento (Fernández et al., 2010).
Se utilizó un diseño experimental completamente al azar con cuatro tratamientos y tres repeticiones, donde cada repetición constó de 10 garrapatas por tratamiento. Para determinar la significancia estadística de las mortalidades y el porcentaje de inhibición de la ovoposición entre los tratamientos, se utilizó un análisis de varianza de una vía y la prueba de Tukey, usando el software SPSS para Windows v. 19.
RESULTADOS Y DISCUSIÓN
Efecto de C. bassiana en el Control de R. microplus
Todas las garrapatas de los tratamientos con C. bassiana llegaron a morir durante el periodo del estudio (Cuadro 1), observándose una acción más rápida en la concentración más alta (1x108 ) de conidias (Grupo IV). En el grupo control se observó la muerte del 90% (27/30) de las garrapatas en el transcurso de los 21 días del trabajo. La muerte de las garrapatas se presentó a partir del día 4 en todos los grupos; no obstante, la velocidad de presentación de este proceso fue mayor a medida que aumentó la concentración del hongo.
Estos resultados fueron similares a aquellos observados en trabajos análogos (Qiaoyun et al., 2012; Sônia et al., 2012), donde se encontraron rangos de mortalidad del 44- 100% bajo tratamiento con la misma concentración del hongo en garrapatas adultas de R. microplus. Asimismo, otros estudios demuestran que el efecto patógeno del hongo aumenta en relación a su concentración (Fernández et al., 2010; de Sousa et al., 2011).
El control biológico de C. bassiana sobre R. microplus demuestra, in vitro, que este hongo, en las concentraciones empleadas, podrían emplearse como complemento a los productos químicos para el control de la garrapata (Fernandes et al., 2012; Okamoto y Amarasekare, 2012; Perinotto et al., 2012), y de esa forma, además, se podría disminuir el riesgo de generación de cepas de garrapatas resistentes al tratamiento químico (Abdigoudarzi et al., 2009; Cova et al., 2009; Fernandes et al., 2011).
Efecto de C. bassiana sobre la Ovoposición y Eclosión de Huevos de R. microplus
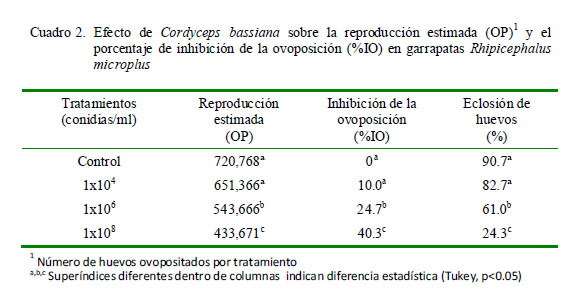
La concentración de 1x108 conidias/ml (Grupo IV) presentó los mejores efectos sobre los parámetros reproductivos de R. microplus, logrando una disminucion del 60.2% de la reproducción estimada y un aumento en la inhibición de la ovoposición de 40.3% en relación al grupo control (Cuadro 2). Los resultados obtenidos mostraron ajuste en cuanto a las respuestas obtenidas por cada uno de los tratamientos en las variables analizadas.
El tratamiento con C. bassiana redujo el porcentaje de eclosión de huevos, lográndose el mayor efecto en el grupo IV (24.3%) respecto a los otros grupos de tratamiento. La emergencia de larvas de garrapatas disminuyó a medida que la concentración de conidias de C. bassiana aumentaba.
Las concentraciones mínimas requeridas para inhibir la capacidad reproductiva de la garrapata en su totalidad estuvieron fuera del alcance de las concentraciones de C. bassiana utilizadas en el presente estudio. Sin embargo, al tratarse de un método de control biológico, los resultados encontrados para controlar el potencial reproductivo fueron aceptables, teniendo en cuenta que la prueba utiliza garrapatas repletas, estadio en que son más tolerantes, por lo menos al control químico (Campos et al., 2005; Sun et al., 2011). Si bien es cierto que para suprimir la ovoposición se requieren concentraciones elevadas de entomopatógenos (Sônia et al., 2012), la eclosión se vio afectada con las concentraciones utilizadas, lo que limitó la emergencia de larvas infestantes.
No obstante que la aplicación de métodos de control no químico es una tendencia actual como parte del manejo integrado de plagas (De Castro, 1997; Castiglioni et al., 2003; Sun et al., 2010; Mendes et al., 2011), se requiere realizar ensayos a nivel de campo que permitan evaluar bajo condiciones multifactoriales, formulaciones no sólo de C. bassiana, sino de otros hongos entomopatógenos que demuestren su viabilidad para el control de garrapatas en condiciones naturales.
CONCLUSIONES
La concentración de 1x108 conidias/ml de Cordyceps bassiana aplicada in vitro sobre Rhipicephalus microplus afectó su supervivencia en un menor tiempo y redujo la ovoposición y eclosión de los huevos en relación a las concentraciones de 1x104 y 1x106 conidias/ml. L
Literatura Citada
1. Abdigoudarzi M, Esmaeilnia K, Shariat N. 2009. Laboratory study on biological control of ticks (Acari: Ixodidae) by entomopathogenic indigenous fungi (Beauveria bassiana). Iran J Arthropod Borne Dis 3(2): 36-43. [ Links ]
2. Campos RA, Arruda W, Boldo JT, da Silva MV, de Barros NM, de Azevedo L, et al. 2005. Boophilus microplus infection by Beauveria amorpha and Beauveria bassiana: SEM analysis and regulation of subtilisin-like proteases and chitinases. Curr Microbiol 50: 257-261. doi: 10.1007/s00284-004-4460-y [ Links ]
3. Castiglioni E, Djair J, Batista S. 2003. Compatibilidad de Beauveria bassiana y Metarhizium anisopliae con Nimkol l® para el combate de Heterotermes tenuis. Manejo Integrado de Plagas y Agroecología 69: 38-44. [ Links ]
4. Cova LJ, Scorza JV, García DE, Cañizales LM, Guedez CC, Avendaño ML, Medina MG. 2009. Efecto de Beauveria Bassiana, Beauveria Brongniartii y la aplicación de Gasoil en el control de moscas caseras en galpones avícolas. Avances Inv Agropec 13(2): 41-53. [ Links ]
5. De Castro J. 1997. Sustainable tick and tickborne disease control in livestock improvement in developing countries. Vet Parasitol 71: 77-97. doi: 10.1016/S0304- 4017(97)00033-2 [ Links ]
6. De Sousa L, Pires H, Soares S, Ferri P, Ribas P. Lima E, Furlong J, et al. 2011. Potential synergistic effect of Melia azedarach fruit extract and Beauveria bassiana in the control of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) in cattle infestations. Vet Parasitol 175: 320-324. doi: 10.1016/ j.vetpar.2010.10.012 [ Links ]
7. Drummond RO, Whetstone TM. 1970. Oviposition of the gulf coast tick. J Economic Entomol 63: 1547-1551. doi: 10.1093/jee/63.5.1547 [ Links ]
8. Fernandes E, Bittencourt V. 2008. Entomopathogenic fungi against South American tick species. Exp Appl Acarol 46: 71-93. doi: 10.1007/s10493-008-9161-y [ Links ]
9. Fernandes EK, Angelo IC, Rangel E, Bahiense TC, Moraes AM, Roberts DW, Bittencourt V. 2011. An intensive search for promising fungal biological control agents of ticks, particularly Rhipicephalus microplus. Vet Parasitol 182: 307-318. doi: 10.1016/j.vetpar. 2011.05.046 [ Links ]
10. Fernandes E, Bittencourt E, Roberts D. 2012. Perspectives on the potential of entomopathogenic fungi in biological control of ticks. Exp Parasitol 130: 300- 305. doi: 10.1016/j.exppara.2011.11.004 [ Links ]
11. Fernández M, Berlanga A, Cruz C, Hernández V. 2010. Evaluación de cepas de Beauveria bassiana y Metarhizium anisopliae sobre la inhibición de oviposición, eclosión y potencial reproductivo en una cepa triple resistente de garrapata Rhipicephalus (Boophilus) microplus (Canestrini) (Acari: Ixodidae). Entomotropica 25: 109-115. [ Links ]
12. Jongejan F, Uilenberg G. 2004. The global importance of ticks. Parasitology 129(Suppl 1): S3-S14. doi: 10.1017/ S0031182004005967 [ Links ]
13. Mendes MC, Lima CK, Nogueira AH, Yoshihara E, Chiebao DP, Gabriel FH, Ueno TE. 2011. Resistance to cypermethrin, deltamethrin and chlorpyriphos in populations of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) from small farms of the State of São Paulo. Vet Parasitol 178: 383-388. doi: 10.1016/j.vetpar.2011.01.006 [ Links ]
14. Sun M, Ren Q, Guan G, Liu Z, Ma M, Gou H, Chen Z, et al. 2011. Virulence of Beauveria bassiana, Metarhizium anisopliae and Paecilomyces lilacinus to the engorged female Hyalomma anatolicum anatolicum tick (Acari: Ixodidae). Vet Parasitol 180: 389-393. doi: 10.1016/j.vetpar.2011.03.027 [ Links ]
15. Sun M, Ren Q, Guan G, Li Y, Han X, Ma C, Yin H, Luo J. 2013. Effectiveness of Beauveria bassiana sensu lato strains for biological control against Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) in China. Parasitol Int 62: 412-415. doi: 10.1016/ j.parint.2013.04.008 [ Links ]
16. Moorhouse ER, Gillespie AT, Charnley AK. 1993. Selection of virulent and persistent Metarhizium anisopliae isolates to control black vine weevil (Otiorynchus sulcatus) larvae on glasshouse begonia. J Invertebrate Pathol 62: 47-52. doi: 10.1006/ jipa.1993.1072 [ Links ]
17. Murrell A, Barker SC. 2003. Synonymy of Boophilus Curtice, 1891 with Rhipicephalus Kock 1844 (Acari: Ixodidae). Syst Parasitol 56: 169-172. [ Links ]
18. Okamoto K, Amarasekare P, 2012. The biological control of disease vectors. J Theor Biol 309: 47–57. doi: 10.1016/ j.jtbi.2012.05.020 [ Links ]
19. Paião JC, Monteiro AC, Kronka SN. 2001. Susceptibility of the cattle tick Boophilus microplus (Acari: Ixodidae) to isolates of the fungus Beauveria bassiana. World J Microbiol Biotechnol 17: 245-251. [ Links ]
20. Perinotto WMS, Angelo IC, Golo PS, Quinelato S, Camargo MG, Sá FA, Bittencourt VR. 2012. Susceptibility of different populations of ticks to entomopathogenic fungi. Exp Parasitol 130: 257-260. doi: 10.1016/j.exppara.2011.12.003 [ Links ]
21. Ren Q, Liu Z, Guan G, Sun M, Ma M, Niu Q, Li Y, et al. 2012. Laboratory evaluation of virulence of Chinese Beauveria bassiana and Metarhizium anisopliae isolates to engorged female Rhipicephalus (Boophilus) microplus ticks. Biol Control 63: 98-101. doi: 10.1016/j.biocontrol.2012.07.002 [ Links ]
22. Rodríguez-Vivas RI, Quiñones AF, Fragoso SH. 2005. Epidemiología y control de la garrapata Boophilus en México. En: Enfermedades de importancia económica en producción animal. México DF: McGraw-Hill-UADY. p 571-592. [ Links ]
23. Rojas E, Arce B, Peña A, Boshell F, Ayarza M. 2010. Cuantificación e interpolación de tendencias locales de temperatura y precipitación en zonas alto andinas de Cundinamarca y Boyacá (Colombia). Rev Corpoica Cienc Tecnol Agropec 11: 173-182. [ Links ]
24. Sagüés MF, Purslow P, Fernández S, Fusé L, Iglesias L, Saumella C. 2011. Hongos nematófagos utilizados para el control biológico de nematodos gastrointestinales en el ganado y sus formas de administración. Rev Iberoamericana Micol 28: 143-147. doi:10.1016/ j.riam.2011.06.009 [ Links ]
25. Sônia MF, Broglio-Micheletti LA, de Souza EN, Valente M, de Araújo JC, da Silva N, Gómez-Torres ML. 2012. Evaluation of entomopathogenic fungi as biological control agents Rhipicephalus (Boophilus) microplus (Canestrini, 1887) (Acari: Ixodidae). IDESIA 30(1): 93-99. [ Links ]
26. Sun M, Guan G, Ren Q, Yin H, Luo J. 2010. Prospect for biological control of ticks [in Chinese]. Acta Parasitol 17: 249- 253. [ Links ]
27. Yao J, Huang DQ. 2004. The study on the correlationship between protease, chitinase and â-N-GlcNAcase production and the virulence of Beauveria bassiana to Dendrolimus punctatus [in Chinese]. J Suzhou Tenchers College 19(4): 102-106. [ Links ]
Recibido: 25 de julio de 2015
Aceptado para publicación: 17 de noviembre de 2015