Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.2 Lima abr./jun. 2016
http://dx.doi.org/10.15381/rivep.v27i2.11640
ARTÍCULOS PRIMARIOS
Prevalencia de paramixovirus en murciélagos en seis zonas de Madre de Dios y Puno, Perú, con dos grados de perturbación antropogénica
Prevalence of paramyxoviruses in bats in six areas of Madre de Dios and Puno, Peru with two levels of anthropogenic disturbance
Karen Segovia H.1,4,5, Gabriela Salmon-Mulanovich1, Bruno M. Ghersi1, Maria Silva1, Lenin Maturrano H.2, Daniel G. Bausch1,3
1 Naval Medical Research Unit-6 Centro Médico Naval, Callao, Perú
2 Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
3 Tulane School of Public Health and Tropical Medicine, New Orleans, Louisiana, United States
4 E-mail: karens_122@outlook.com
5 Este trabajo fue financiado por la unidad de trabajo 847705 82000 25GB B0016. Algunos de los autores de este trabajo son miembros del servicio militar o empleados del gobierno de EEUU (GSM, MS). El trabajo fue preparado como parte de sus funciones oficiales y por ello no está protegido por leyes de derechos de autor ya que constituye contribución del gobierno de los EEUU. Las opiniones y afirmaciones contenidas aquí son propias de los autores y no deben interpretarse como posición oficial o que reflejan la opinión del Departamento de la Marina, el Departamento de Defensa o de alguna otra agencia del Gobierno de los EEUU.
RESUMEN
Los Andes tropicales que comprende la región de Madre de Dios, Perú, es considerada una zona de conservación para la biodiversidad; sin embargo, el reciente desarrollo de la zona a través de la pavimentación de la carretera interoceánica (CIO) ha ocasionado un impacto antropogénico en la región. Este estudio tuvo como objetivo identificar la prevalencia de paramixovirus, patógenos emergentes de importancia para la salud pública y animal, en murciélagos capturados a lo largo de los tramos de la CIO sujetos a diferentes grados de perturbación ecológica. La captura se hizo entre octubre de 2009 a octubre de 2010 en tres zonas altamente perturbadas y tres zonas con un grado de perturbación moderado a ligero; además, en la Reserva Nacional de Tambopata como grupo control. Se analizaron muestras de bazo mediante la técnica de RT-PCR semianidado que detecta las regiones conservadas del gen de la polimerasa. Se capturaron 436 murciélagos de 24 géneros y 35 especies, encontrándose una prevalencia de paramixovirus de 10.3% (IC 95%: 7.6-13.6%). La prevalencia fue de 15.7% en lugares clasificados con alto grado de perturbación ecológica, siendo significativamente mayor (p=0.009)queen lugarescon moderadogradodeperturbación (5.6%) yen la zonacontrol (8.3%). La especie Artibeus planisrostris mostró la más alta frecuencia de infección (37%). Mediante el análisis de secuencia se identificaron tres muestras positivas a paramixovirus agrupadas dentro del género Morbillivirus (no clasificada) en las especies Carollia brevicuda y C. perspicillata; así como miembros del género Rubulavirus (Mapuera virus) en tres muestras de murciélagos adultos de la especie Sturnira lilium colectados en el distrito de Iberia.
Palabras clave: Paramyxovirus, murciélagos, Madre de Dios, perturbación antropogénica, RT-PCR
ABSTRACT
The tropical Andes, comprising the Madre de Dios region, are a hotspot for biodiversity conservation. Recent development of the area through paving of the interoceanic highway (IOH) resulted in anthropogenic impacts in the region. This study aimed to identify the prevalence of emerging pathogens of public and animal health importance such as Paramyxoviruses among bats trapped along areas of IOH with different ecological impacts. Samples from six study sites along the IOH were collected from October 2009 to October 2010: three highly disturbed areas and three areas with low disturbance. A site located at the Tambopata National Reserve was selected as an undisturbed environment for control. Bat spleens were tested for Paramyxoviruses by nested PCR targeting the conserved motifs of the polymerase gene. A total of 436 bats from 24 different genera were captured, of which 45 (10.32%; CI 95%: 7.6-13.6%) were positive for Paramyxoviruses. The prevalence was higher in areas with more disturbance than in mildlydisturbed areas(15.7 vs.5.6%,p=0.009).Theprevalencein thecontrolarea was 8.3%. The species Artibeus planirostris showed the highest infection frequency (37%, 17/45). Three positive bats were adults of the Sturnira lilium species collected from one location in Iberia District. Sequence analysis placed these viruses in the Rubulavirus genera (Mapuera virus). The remaining viruses were related to an unclassified Morbillivirus found in bat samples in Brazil during 2013.
Key words: Paramyxovirus, bats, Madre de Dios, anthropogenic disturbance, RT-PCR
INTRODUCCIÓN
Más del 70% de las enfermedades infecciosas emergentes son zoonóticas y se transmiten entre reservorios animales de vida silvestre o domésticos y los humanos, ya sea mediante vectores o por exposición o contacto con fluidos o tejidos animales. La emergencia de estos patógenos está relacionada al cambio ecológico antropogénico (Blancou, 2005). Los mecanismos de cambio ocurren a través de varias vías, incluyendo la alteración de los hábitats o sitios de reproducción de los vectores o reservorios, la invasión de sus nichos ecológicos, la eliminación de especies predadoras, alteración de la biodiversidad y los cambios en la densidad poblacional de los hospederos (Patz et al., 2005).
Los murciélagos (Orden Chiroptera), además de proveer una serie de servicios ambientales fundamentales para la integridad de los ecosistemas, han sido identificados como una fuente importante de patógenos, incluyendo virus como el Ébola, Marburg, SARS y paramixovirus capaces de infectar humanos y animales domésticos (Dizney y Ruedas, 2004; Kurth et al., 2012). El potencial zoonótico de los paramixovirus ha sido demostrado debido a la capacidad de los virus Hendra y Nipah de infectar un amplio rango de hospederos (Suzan et al., 2008). A pesar de que existen estudios y reportes que señalan a los murciélagos como reservorios de una diversidad de patógenos con potencial zoonótico, los pocos estudios existentes en el medio están enfocados principalmente en el virus de la rabia (Salmón-Mulanovich et al., 2009; Schneider et al., 2009; Streicker et al., 2012).
En el año 2011 se inauguró el tramo sur de la carretera interoceánica (CIO). Este corredor vial atraviesa las regiones amazónicas de Madre de Dios, Cusco y Puno, y comunica los puertos de Ilo y Matarani del Perú con ciudades de Brasil y Bolivia (Fearnside y de Alencastro, 2006). Sin embargo, la influencia de la CIO podría incidir directamente en la pérdida de bosques tropicales, como se ha mostrado en experiencias anteriores (BIC, 2015); además de desencadenar la fragmentación de ecosistemas frágiles, amenazando la subsistencia de tribus indígenas en la región, así como facilitar el acceso a la minería del oro, ocasionando un gran impacto antropogénico en la región (Fernández, 2010; Asner et al., 2013).
Este contexto proporciona una oportunidad para evaluar la presencia de patógenos en poblaciones de murciélagos en la región, a fin de mejorar el entendimiento de la relación entre estos y su entorno. De tal manera, este estudio tuvo como objetivo identificar la prevalencia de paramixovirus en murciélagos capturados a lo largo de los tramos de la CIO sujetos a diferentes grados de perturbación ecológica.
MATERIALES Y MÉTODOS
Lugar de Estudio
La colecta de mamíferos pequeños del Orden Chiroptera se realizó entre octubre de 2009 a octubre de 2010 en los departamentos de Madre de Dios y Puno, Perú. En la identificación del área de muestreo se consideró el grado de perturbación del hábitat a lo largo de la CIO.
Se utilizaron mapas con los que se definieron zonas altamente perturbadas correspondientes a tres comunidades en los distritos de Inambari (Mazuko), Iberia (Iberia) y Laberinto (Florida Baja) y zonas moderadamente perturbadas correspondientes a Tahuamanu (La Novia), Inambari (Alto Libertad) y Ayapata (El Carmen). La determinación del grado de perturbación alta o moderada se definió de acuerdo al área de impacto antrópico alrededor de la zona de estudio. Las zonas moderadamente perturbadas tenían menos del 20% de impacto antrópico con respecto a las consideradas altamente perturbadas. Se consideró, además, la inclusión de una zona control sin perturbación (Malinowski), ubicada dentro de la Reserva Nacional de Tambopata, en el área de trabajo del Centro de Investigación de Tambopata.
Este estudio fue aprobado por el Comité Institucional de Uso y Cuidado Animal del Centro de Investigación de Enfermedades Tropicales de la Marina de los EEUU (NAMRU-6, por sus siglas en inglés). Los permisos de colecta RD No.383-2009-AGDGFFS-DGEFFS, RD No.0425-2010-AGDGFFS-DGEFFS, RJ No.002-2010SERNANP-RNTAMB-J y el contrato de acceso marco a recursos genéticos No. 0052014-MINAGRI-DGFFS/DGEFFS fueron otorgados por la Dirección General Forestal y de Fauna Silvestre y la Reserva Nacional Tambopata, según corresponde.
Colecta de las Muestras
Los murciélagos fueron capturados haciendo uso de redes niebla, las cuales fueron colocadas a 600 metros en dos líneas a ambos lados de la CIO. Las redes fueron colocadas al anochecer (~17:00 h) y se mantuvieron en pie hasta la medianoche, por cinco noches consecutivas en cada lugar de estudio. Los murciélagos capturados fueron removidos de las redes con uso de guantes protectores de cuero, colocados individualmente en bolsas de lona y transportados a la zona de procesamiento donde fueron mantenidos hasta la mañana siguiente. Se realizó la anestesia general con una mezcla de ketamina (100 mg/kg) y xilazina (20 mg/kg) por vía intramuscular o intraperitoneal y se les sacrificó por desangramiento mediante punción cardiaca usando jeringas de tuberculina. Luego se procedió con la identificación de las especies en campo y con la necropsia (Eisenberg y Redford, 1999).
Las muestras de bazo colectadas durante la necropsia fueron colocadas en crioviales y guardadas en nitrógeno líquido y trasladadas a las instalaciones del NAMRU6 en el Callao para los análisis correspondientes. Las carcasas de los individuos fueron etiquetadas y almacenadas en formol para ser transportados al Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos en Lima para la confirmación de la identidad de las especies en gabinete.
Procesamiento de las Muestras
Se extrajo el ARN a partir de las muestras de bazo con el kit de extracción RNAeasy Mini kit (Qiagen). Se realizó el ensayo de transcripción reversa de la reacción en cadena de la polimerasa (RT-PCR) semi-anidado para la amplificación de la región conservada de la polimerasa (gen Pol) utilizado para la detección de grupos de géneros dentro de la familia Paramyxoviridae.
En el primer ensayo de PCR se utilizó el kit SuperScript III One-Step Reverse Transcription-PCR (RT-PCR) (Invitrogen, Carlsbad, CA, EEUU). La mezcla para RTPCR fue incubada a 60 °C por 1 min para la desnaturalización, 50 °C por 30 min (transcripción reversa), 94 °C por 2 min, y luego 35 ciclosa94 °Cpor15 s,48 a50 °Cpor30 s, 72 °C por 30 s, y una extensión final a 72 °C por 7 min. Para la segunda amplificación, se utilizó el kit Platinum Taq (Invitrogen). La mezcla fue inicialmente calentada a 94 °C por 2 min. Las condiciones de ciclaje fueron las mismas descritas líneas arriba. Los dos ensayos de amplificación para la identificación de los grupos virales (RES-MOR-HEN y AVU-RUB) tienen una sensibilidad de detección a partir de 10 copias de ARN (Tong et al., 2008).
Los productos de amplificación fueron separados mediante electroforesis con agarosa al 2.0% en buffer TAE (40 mM Tris-acetato and 1 mM EDTA, pH 8.3), teñidos con bromuro de etidio y visualizados y fotografiados durante trans-iluminación con UV para la determinación de las bandas diagnósticas. El tamaño esperado de bandas diagnósticas para los productos de PCR fue de 227 pb para el grupo de cebadores Avu– Rubulavirus y 491 pb para grupo de cebadores Mor–Resp–Henipavirus. Se utilizó el marcador molecular 1 kb Plus de Invitrogen (Cuadro 1).
Análisis de Datos
Datos referentes al género, especie, fecha, lugar de captura, y edad y sexo de los murciélagos fueron obtenidos. Los resultados del análisis de PCR para la familia Paramyxoviridae y géneros fueron estimados como prevalencias con intervalos de confianza del 95% con una distribución binomial exacta.
Se evaluó su asociación con cada una de las variables en mención (especie, edad, sexo y grado de perturbación) mediante pruebas no paramétricas de Chi cuadrado o la prueba exacta de Fisher, según corresponda, considerando valores de p menores o iguales a 0.05 como significativos. Se realizó un modelo de regresión múltiple para la evaluación de asociación conjunta entre las variables incluidas en el estudio y los resultados de prevalencia de infección por paramixovirus en murciélagos. El análisis de datos se realizó con el paquete estadístico STATA 12.0 (StataCorp LP, College Station, TX).
RESULTADOS
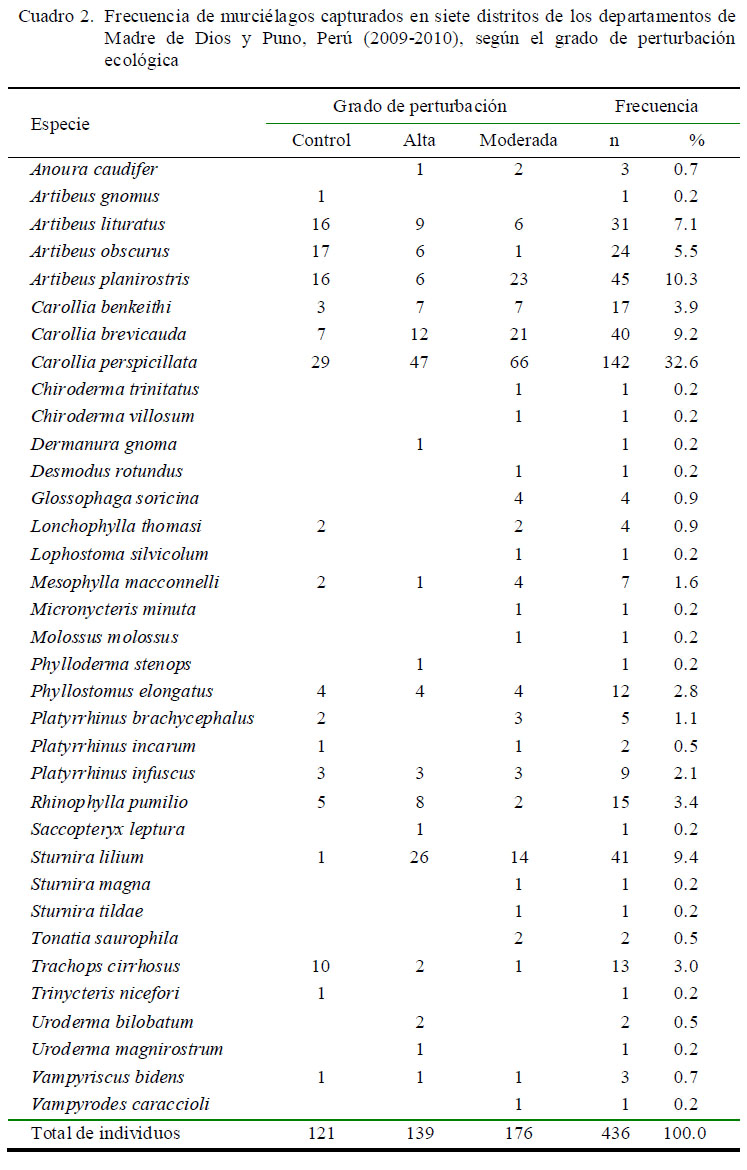
El tiempo de muestreo fue de 35 noches no consecutivas. El esfuerzo de muestreo fue de 345 redes noche (RN): 134 RN en los lugares altamente perturbados, 151 RN en las zonas moderadamente perturbadas y 60 RN en la zona control. El esfuerzo promedio por localidad fue de 49 RN; correspondientes a ~5 noches de evaluación efectiva, con un promedio de 10 redes por noche. Esto permitió la captura de 436 individuos, abarcando 24 géneros y 35 especies de murciélagos (Cuadro 2).
El 87% de los especímenes había alcanzado la madurez sexual, donde 51% fueron machos y 49% fueron hembras. Se colectaron individuos de 19, 28 y 18 especies en las zonas de perturbación alta, moderada y en la zona control, respectivamente. La especie más abundante fue C. perspicillata (32.6%) seguida por A. planirostris (10.3%), S. lilium (9.4%), C. brevicauda (9.2%) y A. lituratus (7.1%) quienes representaron en conjunto el 61.5% del total de animales muestreados (Cuadro 2).
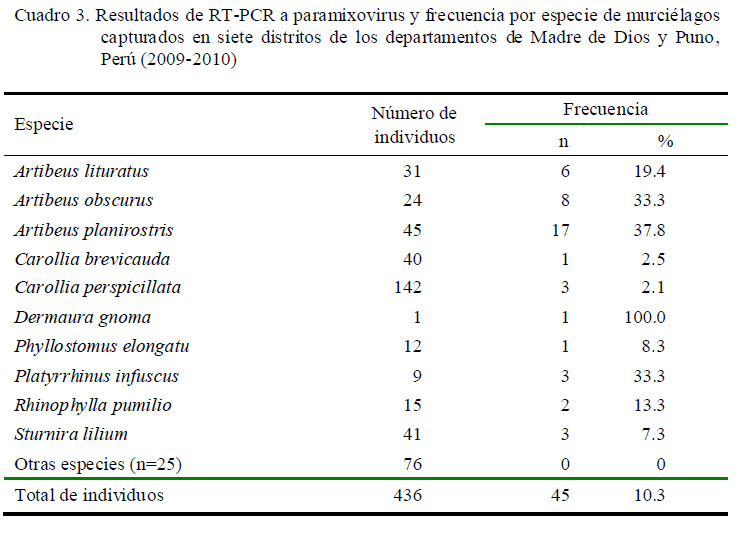
Los resultados del ensayo de RT–PCR indicaron una prevalencia de 10.3% de infección por paramixovirus (IC 95%; 7.613.6%). A nivel de subgrupo se pudo observar una mayor prevalencia (9.6%) de murciélagos positivos a Mor-Resp-Henipavirus (7.0-12.8%), mientras que únicamente tres murciélagos (0.4%) resultaron positivos a Avu-Rubulavirus (0.1-2.0%).
Las frecuencias de infecciones más altas se encontraron en Artibeus planirostris (37.8%), Artibeus obscurus (33.3%) y Platyrrhinus infuscus (33.3%) (Cuadro 3). El análisis de secuencia agrupó a estos virus dentro del género Rubulavirus (virus Mapuera). Los virus restantes se relacionaron con un Morbillivirus aún sin clasificar encontrado en el año 2009 en muestras de murciélagos en Brasil (Drexler, 2012).
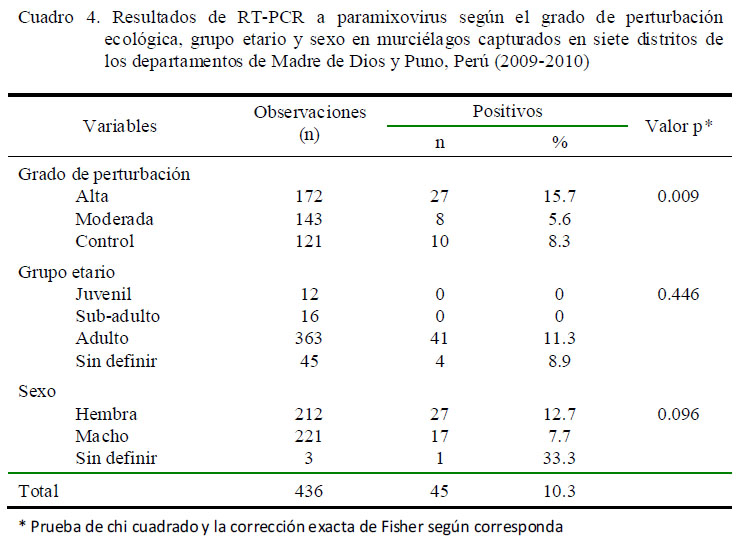
En el Cuadro 4 se observa que la prevalencia estuvo asociada al grado de perturbación del hábitat, siendo significativamente más alta en los lugares altamente perturbados (15.7%) en comparación a los moderadamente perturbados (5.6%) (p=0.009). Asimismo, las áreas con un moderado grado de perturbación presentaron niveles menores de infección que las obtenidas en el área control (8.3%).
El 11.3% de los murciélagos adultos estaban infectados con paramixovirus, en tanto que no se detectó ARN viral en juveniles y sub-adultos. Sin embargo, es importante acotar que no se pudo determinar la edad de una proporción considerable de murciélagos (10.3%), los cuales constituían el 8.9% del total de muestras positivas (4/45). Por otro lado, el sexo no tuvo una relación significativa con la presencia de la infección (Cuadro 4).
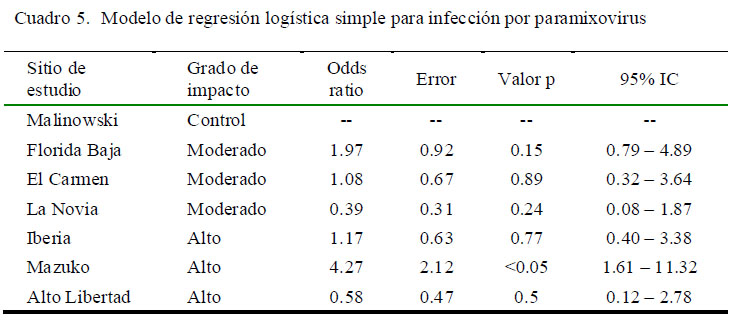
Se realizó un modelo de regresión simple para evaluar la presencia de infección por paramixovirus en los sitios de estudio, utilizando la zona de control como nivel de referencia. Solo se logró identificar una mayor asociación entre la presencia del virus con la localidad de Mazuko (OR=4.27), el cual se encuentra en una zona de de alto grado de perturbación ecológica (Cuadro 5).
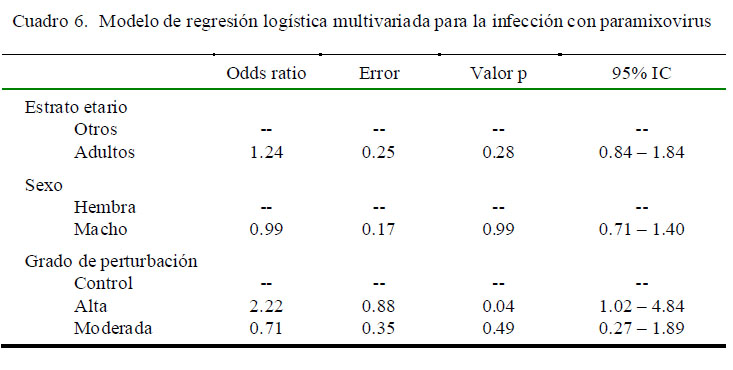
Considerando estos resultados, se agruparon los sitios de estudio por grado de perturbación ecológica y se utilizó una regresión logística múltiple para evaluar el efecto conjunto de las variables en estudio sobre los resultados de infección (Cuadro 6). Los resultados de este modelo presentaron un riesgo 2.2 veces superior de encontrar murciélagos positivos a paramixovirus en zonas altamente perturbadas en comparación al área control. Por otro lado, no se observaron diferencias estadísticas en los valores de OR entre las zonas moderadamente perturbadas y la zona control o en cuanto a la edad y el sexo de los murciélagos.
DISCUSIÓN
El 10.3% de prevalencia general demuestra que los murciélagos frugívoros cumplirían un rol de importancia como reservorio de miembros de la familia Paramyxoviridae en el Perú. Esta evidencia, junto con el incremento de actividades antropogénicas en el hábitat de estas especies silvestres debido a la necesidad de construcción de nuevas vías de comunicación, podrían incrementar el riesgo de transmisión de los patógenos presentes en las poblaciones de murciélagos hacia otras especies de animales y al humano (Dizney y Ruedas, 2004; Gottdenker et al., 2014). A pesar que no se conoce si las especies de virus detectados en este estudio (el virus Mapuera y otro grupo de virus relacionados al género Morbillivirus) son capaces de ocasionar enfermedad en animales o humanos, su relación genética y antigénica cercana con otros Paramixovirus, como Menangle, Tioman, Nipah y Hendra, sugieren la posibilidad de que podrían cruzar la barrera interespecies (Murray y Daszak, 2013).
La gran variedad de especies de murciélagos encontrados en este estudio (n=35), representan el 21% de especies descritas para el Perú (PCMP, 2015), lo cual es un indicativo de la alta diversidad de especies presentes en la región. Los murciélagos del género Artibeus presentaron la mayor frecuencia de infección por paramixovirus (especialmente A. planirostris con 37.8% de infectados). Los murciélagos Artibeus presentan un nicho alimentario diverso y pueden estar presentes en una amplia variedad de climas tropicales (Ballesteros et al., 2007; Novoa et al., 2011), por lo que el monitoreo y vigilancia sanitaria hacia estos murciélagos en zonas de perturbación ambiental es importante.
El nivel de perturbación de hábitats naturales presentó el mayor efecto sobre la prevalencia de paramixovirus. Diversos estudios han demostrado que la pérdida de la biodiversidad puede afectar la transmisión de agentes infecciosos mediante mecanismos diferentes (Dizney y Ruedas, 2004). Uno de ellos señala que la reducción de las especies menos susceptibles o donde su transmisión es mínima, incrementan la posibilidad de contagios debido a que incrementa la densidad de las especies más susceptibles o portadoras (Hutson et al., 2001). Además de ello, la reducción de la población perturba las estructuras sociales pudiendo conducir a una mayor tasa de contactos y una mayor proporción de encuentros agonísticos entre o dentro de grupos. Del mismo modo, un cambio en la susceptibilidad de los grupos individuales también puede ocurrir como consecuencia de la reducción de la población debido al estrés. Ambos efectos aumentan la posibilidad de transmisión de la enfermedad incrementando la probabilidad de infecciones virales debido a contaminación de frutos y otros productos por murciélagos (Kuzmin et al., 2011; Prentice et al., 2014).
Los resultados del modelo de regresión logística múltiple no demostraron un efecto significativo del estrato etario y el sexo de las poblaciones de murciélagos muestreados. Sin embargo, es posible que exista un efecto de dichas variables sobre los niveles de infección en escenarios naturales. Se ha mostrado que los cambios estacionales pueden conllevar a alteraciones en las conductas reproductivas, tanto en hembras como en machos, involucrando alteraciones en los patrones de vuelo, patrones de agregación y cambios en la susceptibilidad del hospedador que corresponden con variaciones en los niveles de incidencia de la enfermedad (Plowright et al., 2011).
CONCLUSIONES
-
Se encontró el 10.3% de prevalencia de paramixovirus (IC 95%: 7.6-13.6%) en murciélagos de 35 especies capturados en la región de Madre de Dios y Puno, Perú, en el periodo octubre de 2009 a octubre de 2010.
-
Mediante el análisis de secuencia se logró identificar tres muestras positivas a paramixovirus agrupadas dentro del género Morbillivirus (no clasificada) en las especies Carollia brevicuda y C. perspicillata; así como miembros del género Rubulavirus (Mapuera virus) en tres muestras de la especie Sturnira lilium.
-
La prevalencia de paramixovirus fue de 15.7% en lugares clasificados con alto grado de perturbación ecológica, siendo significativamente mayor (p<0.05) que en lugares con moderado grado de perturbación (5.6%) y en la zona control (8.3%).
Agradecimiento
Los autores agradecen al Dr. Víctor Pacheco y al Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos por su colaboración en la identificación de las especies de los murciélagos colectados para el estudio.
LITERATURA CITADA
1. Asner GP, Llactayo W, Tupayachi R, Raez-Luna E. 2013. Elevated rates of gold mining in the Amazon revealed through high-resolution monitoring. Proc Natl Acad Sci 110:18454-18459. doi: 10.1073/pnas.1318271110 [ Links ]
2. Ballesteros J, Racero J, Nuñez M. 2007. Diversidad de murciélagos en cuatro localidades de la zona costanera del departamento de Córdoba-Colombia. Rev MVZ Córdoba 12: 1013-1019. [ Links ]
3. [BIC] Bank Information Center. 2015. Inter-Oceanic Highway across Southern Peru. [Internet]. Disponible en: http://www.bankinformationcenter.org/ en/document.101038.pdf [ Links ]
4. Blancou J, Chomel BB. Belotto A, Meslin FX. 2005. Emerging or reemerging bacterial zoonoses: factors of emergence, surveillance and control. Vet Res 36: 507-522. doi: 10.1051/ vetres:2005008 [ Links ]
5. Dizney LJ, Ruedas LA. 2009. Increased host species diversity and decreased prevalence of Sin Nombre virus. Emerg Infect Dis 15: 1012-1018. doi: 10.3201/eid1507.081083 [ Links ]
6. Drexler JF, Corman VM, Müller MA, Maganga GD, Vallo P, Binger T, Vallo P, et al. 2012. Bats host major mammalian paramyxoviruses. Nat Commun 3(796). doi: 10.1038/ ncomms1796. [ Links ]
7. Eisenberg FJ, Redford HK. 1999. Mammals of the neotropics. Vol 3. Ecuador, Bolivia, Brazil. Chicago, USA: University of Chicago Press. 624 p. [ Links ]
8. Fearnside PM, de Alencastro Graca PML. 2006. BR-319: Brazil’s Manaus- Porto Velho highway and the potential impact of linking the arc of deforestation to central amazonia. Environ Manage 38: 705-716. doi: 10.1007/s00267-005-0295-y
9. Fernández L. 2010. Diagnóstico de los impactos integrados de la carretera Interoceánica Sur en la región Madre de Dios. Lima: Wildlife Conservation Society. 75 p. [ Links ]
10. Gottdenker NL, Streicker DG, Faust CL, Carroll CR. 2014. Anthropogenic land use change and infectious diseases: a review of the evidence. Ecohealth 11: 619-632. doi: 10.1007/s10393-014-0941-z [ Links ]
11. Hutson AM, Mickleburgh SP, Racey PA. 2001. Microchiropteran bats: global status survey and conservation action plan. UK: IUCN. 259 p. [ Links ]
12. Kurth A, Kohl C, Brinkmann A, Ebinger A, Harper JA, Wang L-F, et al. 2012. Novel Paramyxoviruses in free-ranging European bats. PLoS ONE 7(6). doi: 10.1371/journal.pone.0038688 [ Links ]
13. Kuzmin IV, Bozick B, Guagliardo SA, Kunkel R, Shak JR, Tong S, Rupprecht, CE. 2011. Bats, emerging infectious diseases, and the rabies paradigm revisited. Emerg Health Threats J 4: 7159. doi: 10.3402/ ehtj.v4i0.7159. [ Links ]
14. Murray KA, Daszak P. 2013. Human ecology in pathogenic landscapes: two hypotheses on how land use change drives viral emergence. Curr Opin Virol 3: 79- 83.doi: 10.1016/j.coviro. 2013. 01.006 [ Links ]
15. Novoa S, Cadenillas R, Pacheco V. 2011. Dispersión de semillas por murciélagos frugívoros en bosques del parque Nacional Cerros de Amotape, Tumbes, Perú. Mastozool Neotrop 18: 81-93. doi: 10.4236/jmp.2014.51001 [ Links ]
16. Patz J, Confalonieri U, Amerasinghe FP, Kaw Bing Chua, Daszak P, Hyatt AD, Molyneux D, et al. 2005. Human health: ecosystem regulation of infectious diseases. In: Hassan R, Scholes R, Ash N (eds). Ecosystems and human wellbeing: current state and trends: findings of the Condition and Trends Working Group. Washington DC, USA: Island Press. p 391-415. [ Links ]
17. Plowright N, Foley P, Field H, Dobson A, Foley J, Eby P, Daszak P. 2011. Urban habituation, ecological connectivity and epidemic dampening: the emergence of Hendra virus from flying foxes (Pteropus spp.) Procs R Soc B 278: 3703-3712. doi: 10.1098/ rspb.2011.0522 [ Links ]
18. Prentice JC, Marion G, White PCL, Davidson RS, Hutchings MR. 2014. Demographic processes drive increases in wildlife disease following population reduction. PLoS ONE 9(5): e86563. doi: 10.1371/journal.pone.0086563 [ Links ]
19. Salmón-Mulanovich G, Vásquez A, Albújar C, Guevara C, Laguna-Torres VA, Salazar M, et al. 2009. Human rabies and rabies in vampire and nonvampire bat species, southeastern Peru, 2007. Emerg Infect Dis 15(8). doi: 10.3201/eid1508.081522 [ Links ]
20. Schneider MC, Romijn PC, Uieda W, Tamayo H, da Silva DF, Belotto A, et al. 2009. Rabies transmitted by vampire bats to humans: an emerging zoonotic disease in Latin America? Rev Panam Salud Publica 25: 260-269. doi: 10.1590/ S1020-49892009000300010 [ Links ]
21. [PCMP] Programa de Conservación de Murciélagos del Perú. 2014. [Internet]. Disponible en: www. conservacionmurcielagosperu.org [ Links ]
22. Streicker DG, Recuenco S, Valderrama W, Gomez Benavides J, Vargas I, Pacheco V, Condori RE, et al. 2012. Ecological and anthropogenic drivers of rabies exposure in vampire bats: implications for transmission and control. Proc Biol Sci 279: 3384-3392. [ Links ]
23. Suzan G, Marce E, Giermakowski JT, Armien B, Pascale J, Mills J, Ceballos G, et al. 2008. The effect of habitat fragmentation and species diversity loss on hantavirus prevalence in Panama. Ann N Y Acad Sci 1149:80-83. doi: 10.1196/annals.1428.063 [ Links ]
24. Tong S, Chern S-WW, Li Y, Pallansch MA, Anderson LJ. 2008. Sensitive and broadly reactive reverse transcription- PCR assays to detect novel Paramyxoviruses. J Clin Microbiol 46: 2652–2658. doi: 10.1128/JCM.00192-08 [ Links ]
Recibido: 8 de enero de 2015
Aceptado para publicación: 15 de enero de 2016