Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.2 Lima abr./jun. 2016
http://dx.doi.org/10.15381/rivep.v27i2.11649
ARTÍCULOS PRIMARIOS
Efecto del medio hipoosmótico sobre la vitalidad espermática en semen canino
Effect of hypoosmotic environment on canine semen sperm viability
Alfonso Sánchez R.1,2,3, Patricia Zamora D.1
1 Facultad de Recursos Naturales y Medicina Veterinaria, Escuela de Medicina Veterinaria, Universidad Santo Tomás, Viña del Mar, Chile
2 Facultad de Medicina Veterinaria y Agronomía, Escuela de Medicina Veterinaria, Universidad de Las Américas, Viña del Mar, Chile
3 E- mail: profesanchez@gmail.com
RESUMEN
La prueba hipoosmótica ha sido utilizada ampliamente en la valoración de la calidad seminal en varias especies animales. El presente estudio tuvo la finalidad de comparar el efecto de la incubación de espermatozoides caninos en dos soluciones hipoosmóticas (0 mOsm/l - HOST-sy150mOsm/l -HOST)sobre la vitalidad espermática (VE). Se obtuvieron 15 eyaculados (2ª fracción) mediante manipulación digital en 10 perros, cuyos espermiogramas fueron considerados normales. De cada eyaculado se tomaron alícuotas de 5 µl para diluirlas en 45 µl de cada solución hipoosmótica, e incubarlas a 37 ºC por 5 y 45 min, respectivamente. La VE se evaluó mediante tinción eosina-nigrosina. En la prueba hipoosmótica se obtuvo 92.1 y90.1% de espermatozoides dilatados para HOST-s yHOST, respectivamente (p<0.05) yen la prueba de VE se obtuvo 66.5y78.3% de espermatozoides vivos para HOST-s y HOST, respectivamente (p<0.01). Se concluye que la menor osmolaridad genera menor VE pos incubación.
Palabras clave: espermatozoide canino, prueba hipoosmótica, vitalidad espermática
ABSTRACT
The hypoosmotic test is widely used for determining sperm quality in several animal species. The present study aimed to compare the effect of incubation of canine sperm into two hypoosmotic solutions (0 mOsm/l - HOST-s and 150 mOsm/l - HOST) on sperm viability. Fifteen ejaculates (2nd fraction) were obtained by digital manipulation from 10 dogs and the spermiograms were considered as normals. A 5 μl aliquots per ejaculate were diluted in 45 μl of each of the two hypoosmotic solutions and incubated at 37 °C for 5 and 45 min respectively. Sperm viability was assessed using eosin-nigrosin staining. Results of the hypoosmotic test were 92.1 and 90.1% of dilated spermatozoa for HOST-s and HOST respectively (p<0.05) and the sperm viability was 66.5 and 78.3% of live spermatozoa for HOST-s and HOST respectively (p<0.01). It was concluded that the lower osmolality generates lower sperm viability post-incubation.
Key words: canine spermatozoa, hypoosmotic test, sperm viability
INTRODUCCIÓN
Los espermatozoides de los mamíferos son expuestos a cambios de presión osmótica (osmolaridad) durante su ciclo de vida, en función de la composición de los fluidos en que se encuentran durante su tránsito por el tracto reproductivo; así, por ejemplo, el medio ambiente en la cola del epidídimo es hiperosmótico y durante la eyaculación, al combinarse con el plasma seminal, pasan a un medio cercano al isoosmótico, al igual que en el tracto genital femenino (Yeung et al., 2000). Para regular estas fluctuaciones de osmolaridad, la membrana celular, bioquímicamente intacta, es capaz de controlar cambios del volumen celular a fin de ajustar las concentraciones iónicas intracelulares (Jeyendran et al., 1984).
La prueba hipoosmótica, reconocida como HOST por su denominación en inglés hypo-osmotic swelling test, es una prueba seminal simple y de bajo costo, que permite evaluar la integridad funcional de la membrana plasmática del espermatozoide (Jeyendran et al., 1984). Esta prueba seminal se fundamenta en que la suspensión de espermatozoides en un medio hipoosmótico ocasiona un desequilibrio entre los medios intracelular y extracelular, situación que la célula trata de compensar difundiendo agua al compartimento intracelular; considerando un aumento del volumen del espermatozoide. Esta situación se evidencia por cambios morfológicos característicos, tales como dilatación y enrollamiento de la cola (Jeyendran et al., 1984).
Se ha postulado que HOST resulta fundamental como herramienta clínica, puesto que uno de los prerrequisitos más importantes para el metabolismo celular es la integridad funcional de la membrana plasmática, dado que ella participa activamente en fenómenos tales como capacitación, reacción acrosómica y fecundación (Rota et al., 2010).
En el semen canino fresco se han utilizado, principalmente, soluciones hipoosmóticas que fluctúan entre 50 y 150 mOsm/l, siendo la fructosa y el ácido cítrico los principales solutos empleados, con periodos de incubación a 37 °C que varían entre 45 a 60 minutos. Estos estudios concluyen y concuerdan en que la prueba hipoosmótica es apropiada para evaluar integridad de membrana espermática y que podría ser incorporada en los análisis andrológicos de rutina en perros (England y Plummer, 1993; Kumi-Diaka, 1993; Rodríguez-Gil et al., 1994; Goericke-Pesch y Failing, 2013).
Con el propósito de simplificar la técnica tradicional y tomando como modelo los espermatozoides humanos, se ha incorporado el uso de agua bidestilada como solución hipoosmótica (HOST-s) en el semen canino; describiéndose valores de dilatación espermática significativamente más altos respecto a los observados utilizando soluciones de 55 mOsm/l (Sánchez y Garrido, 2013), 60 mOsm/l (Quintela et al., 2010) y 150 mOsm/l (Rodríguez-Gil et al., 1994). Cabe destacar que no obstante esta mayor respuesta, se han observado correlaciones positivas y significativas con HOST y con motilidad progresiva, sugiriéndose la posibilidad de su uso habitual en la clínica reproductiva canina (Quintela et al., 2010; Sánchez y Garrido, 2013).
Otra forma de evaluar la integridad de la membrana plasmática del espermatozoide es mediante tinciones supravitales, las que se fundamentan en la propiedad de ciertos colorantes como la eosina, para permear la membrana plasmática en el espermatozoide muerto ocasionando su tinción (Root Kustritz, 2007). La vitalidad espermática en caninos registra correlaciones positivas con motilidad progresiva, concentración espermática e integridad acrosómica (Goericke-Pesch y Failing, 2013). Además, Rodríguez-Gil et al. (1994), analizando el efecto de la incubación de semen canino fresco en una solución de osmolaridad 150 mOsm/l, describen una alta correlación entre vitalidad espermática y dilatación espermática.
El presente estudio tuvo como objetivo evaluar y comparar el efecto de la incubación de espermatozoides caninos en dos soluciones hipoosmóticas (O mOsm/l vs. 150 mOsm/l) sobre la vitalidad espermática.
MATERIALES Y MÉTODOS
Animales y Lugar de Estudio
El estudio se realizó en el laboratorio del Hospital Clínico Veterinario de la Universidad Santo Tomás, Sede Viña del Mar, Chile. Se utilizaron 10 machos reproductores (5 Bulldog Inglés, 3 Pug y 2 Bull Terrier), clínicamente sanos, entre 2 y 6 años de edad, y cuyos propietarios autorizaron el procedimiento de extracción de semen.
Evaluación Convencional del Semen
Se obtuvieron 15 muestras de semen, mediante el método de manipulación digital,en un vaso temperado a 38 ºC. Únicamente se recolectó la fracción espermática de los eyaculados. Las muestras seminales fueron evaluadas según el método descrito por Root Kustritz (2007), registrándose volumen, color, olor, motilidad progresiva, vitalidad espermática, morfología espermática y concentración espermática utilizando la cámara de Neubauer en dilución de 1:100.
En las evaluaciones se utilizó microscopía de campo claro. Todos los eyaculados tenían aspecto lechoso y motilidad progresiva mayor a 70%.
Integridad Bioquímica de Membrana
Cada muestra de semen fresco fue evaluada mediante una prueba hipoosmótica convencional (HOST), consistente en la incubación de 5 µl de semen con 45 µl de una solución de fructosa y ácido cítrico de osmolaridad 150 mOsm/L por 45 min a 37 °C (Kumi-Diaka, 1993) y una prueba hipoosmótica simplificada (HOST-s), diluyendo 5 µl de semen con 45 µl de agua bidestilada de osmolaridad 0 mOsm/L e incubando por 5 min a 37 °C (Sánchez y Garrido, 2013), donde el menor tiempo de incubación tiene por propósito simplificar el procedimiento. Las soluciones hipoosmóticas fueron previamente temperadas a 37 ºC en baño María. La osmolaridad de las soluciones se midió con un osmómetro digital, basado en la técnica de descenso crioscópico (Roebling, Alemania).
Se consideraron espermatozoides con membrana funcional los que reaccionaron al medio hipoosmótico con dilatación de la parte distal de la cola espermática o enrollamiento de la misma, mientras que aquellos espermatozoides sin cambios en la cola se consideraron funcionalmente dañados. La dilatación espermática se evaluó utilizando un microscopio óptico de campo claro (40x y 100x). Se hizo el recuento de 200 espermatozoides y los resultados fueron expresados en porcentaje de espermatozoides dilatados.
Vitalidad Espermática
Se evaluó la vitalidad espermática mediante una tinción eosina-nigrosina (Minitube, Alemania), mediante la cual se considera que los espermatozoides que pierden la integridad de membrana (muertos) son permeados por el colorante y se tiñen rojo-rosa. Brevemente, el procedimiento consistió en mezclar una gota de la muestra con una gota de eosina y dos de nigrosina en un portaobjeto previamente temperado y realizar un frotis el cual fue observado con microscopio óptico de campo claro (40x y 100x). Se hizo el recuento de 200 espermatozoides y el resultado se expresó en porcentaje de espermatozoides vivos (no teñidos).
Análisis Estadístico
Los datos porcentuales fueron transformados a valores angulares (ángulo = arcoseno x) para llevarlos a la distribución normal y realizar un análisis unilateral de la varianza (Zar, 1999). Las diferencias entre soluciones hipoosmóticas se estimaron mediante la prueba de hipótesis específica de Tukey. Los programas empleados fueron Prisma® 5.0 y Excel Software®.
RESULTADOS Y DISCUSIÓN
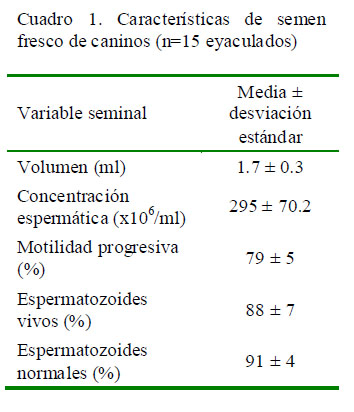
Los diez perros utilizados como donantes respondieron satisfactoriamente al método de colección de semen. Las características seminales de los quince eyaculados obtenidos se presentan en el Cuadro 1, donde los valores del espermiograma pueden ser considerados normales para la especie (England y Allen, 1989).
Los resultados de dilatación y vitalidad espermática de las muestras incubadas en las soluciones hipoosmóticas se presentan en el Cuadro 2. Cabe destacar que, en general, los valores de dilatación espermática concuerdan con resultados previos para semen canino fresco, tanto empleando HOST-s (Quintela et al., 2010; Sánchez y Garrido, 2013) como HOST (England y Plummer, 1993; Kumi-Diaka, 1993; Pinto y Kozink, 2008; Goericke-Pesch y Failing, 2013).
En relación a la vitalidad espermática (VE), se observaron descensos significativos entre semen fresco e incubado en HOST-s (88 ± 7 vs. 66.5 ± 10.2; p<0.01) o en HOST (88 ± 7 vs. 78.3 ± 10.7; p<0.05). Este último resultado difiere de lo descrito por Rodríguez-Gil et al. (1994), quienes señalan un efecto mínimo de osmolaridades entre 100 y 150 mOsm/l sobre VE, lo cual podría explicarse por las técnicas de tinción empleadas.
Rodríguez-Gil et al. (1994), incubando espermatozoides caninos en agua bidestilada a 37 ºC durante 45 min, describen un marcado efecto del estrés osmótico, observando 100% de mortalidad espermática y altos porcentajes de espermatozoides con acrosomas dañados. Este último parámetro también se considera como estimador de la integridad de membrana plasmática del espermatozoide (Kumi-Diaka y Badtram, 1994). En otro estudio, donde se evaluó la integridad acrosómica de espermatozoides caninos incubados en agua bidestilada por 5 min a 37 ºC, no se observó incremento del daño acrosómico (Zamora, 2013). Resulta interesante señalar que en el presente estudio, el porcentaje de VE, aun después del shock hipoosmótico del agua bidestilada, superó el 50%, lo cual podría estar asociado al bajo tiempo de incubación empleado (5 min). Estas observaciones en conjunto permitirían postular la idea de disminuir el tiempo de incubación a un minuto, tal como proponen Pinto y Kozink (2008).
No obstante haberse descrito una correlación positiva en los porcentajes de dilatación espermática entre HOST-s y HOST (Sánchez y Garrido, 2013), en el presente estudio se pudo observar una drástica reducción en la VE posterior a la incubación con la solución 0 mOsm/L respecto a la incubación con solución 150 mOsm/l (p<0.01). Esta situación permite postular que soluciones de osmolaridad muy baja, causarían además de la respuesta fisiológica de equilibrio osmótico inicial, una mayor cantidad de daño físico en los espermatozoides en el tiempo; esto considerando que la tinción supravital mide la ruptura de la membrana plasmática en el espermatozoide muerto -integridad física-, mientras que HOST evalúa la integridad funcional de la misma -integridad bioquímica(Schrader et al., 1986).
CONCLUSIONES
Al comparar el efecto de la incubación de espermatozoides caninos en dos soluciones hipoosmóticas, 0 mOsm/l v/s 150 mOsm/l, se concluye que la menor osmolaridad genera menor vitalidad espermática post-incubación.
LITERATURA CITADA
1. England G, Plummer J. 1993. Hypoosmotic swelling of dog spermatozoa. J Reprod Fertil Suppl 47: 261-270. [ Links ]
2. Goericke-Pesch S, Failing K. 2013. Retrospective analysis of canine semen evaluations with special emphasis on the use of the hypoosmotic swelling (HOS) test and acrosomal evaluation using Spermac®. Reprod Domest Anim 48: 213-217. doi: 10.1111/j.14390531.2012.02134.x [ Links ]
3. Jeyendran R, Van der Ven H, Perez-Pelaez M, Crabo B, Zaneveld L. 1984. Development of an assay to assess functional integrity of the human sperm membrane and its relationship to other semen characteristics. J Reprod Fertil 70: 219-228. doi: 10.1530/jrf.0.0700219 [ Links ]
4. Kumi-Diaka J. 1993. Subjecting canine semen to the hypo-osmotic test. Theriogenology 39: 1279-1289. doi: 10.1016/0093-691X(93)90230-3 [ Links ]
5. Kumi-Diaka J, Badtram G. 1994. Effect on sperm membrane integrity and other functional characteristics of canine spermatozoa: in vitro bioassay for canine semen. Theriogenology 41: 1355-1366. doi: 10.1016/0093-691X(94)90187-N [ Links ]
6. Pinto C, Kozink D. 2008. Simplified hypoosmotic swelling testing (HOST) of fresh and frozen-thawed canine spermatozoa. Anim Reprod Sci 104: 450- 455. [ Links ]
7. Quintela A, Oliveira I, Souza A, Gusmao A, Silva A. 2010. Waterinduced hypo-osmotic test for the evaluation of canine sperm membrane integrity. Anim Reprod 7: 70-74. [ Links ]
8. Rodríguez-Gil J, Montserrat A, Rigau T. 1994. Effects of hypoosmotic incubation on acrosome and tail structure on canine spermatozoa. Theriogenology 42: 815-829. doi: 10.1016/0093- 691X(94)90450-W [ Links ]
9. Root Kustritz M. 2007. The value of canine semen evaluation for practitioners. Theriogenology 68: 329-337. doi: 10.1016/j.theriogenology.2007.04.017 [ Links ]
10. Rota A, Bastianacci V, Mgelli C, Panzani D, Camilo F. 2010. Evaluation of plasma membrane integrity of donkey spermatozoa. Reprod Dom Anim 45: 228-232. doi: 10.1111/j.1439- 0531.2008.01241.x [ Links ]
11. Sánchez A, Garrido, D. 2013. Evaluación de una prueba hipoosmótica simplificada en semen canino fresco y refrigerado. Rev Científ FCV-LUZ 23: 506- 510. [ Links ]
12. Schrader S, PIatek S, Zaneveld L, Perez-Pelaez M, Jeyendran R. 1986. Sperm viability: a comparison of analytical methods. Andrologia 18: 530- 538. doi: 10.1111/j.1439-0272.1986. tb01822.x [ Links ]
13. Yeung C, Wagenfeld A, Nieschlag E, Cooper T. 2000. The cause of infertility of male c-ros tyrosine kinase receptor knockout mice. Biol Reprod 63: 612-618. doi: 10.1095/ biolreprod63.2.612 [ Links ]
14. Zamora P. 2013. Evaluación de vitalidad e integridad acrosomal en espermato-zoides caninos incubados en dos medios hiposmóticos. Tesis de Médico Veterinario. Viña del Mar, Chile: Universidad Santo Tomás. 60 p. [ Links ]
15. Zar J. 1999. Biostatistical analysis. 4ª ed. New Jersey. Prentice Hall. 929 p. [ Links ]
Recibido: 15 de agosto de 2015
Aceptado para publicación: 25 de noviembre de 2015