Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.2 Lima abr./jun. 2016
http://dx.doi.org/10.15381/rivep.v27i2.11647
ARTÍCULOS PRIMARIOS
Prevalencia de Nematodos Gastrointestinales en Sistemas de Producción Ovina y Caprina bajo Confinamiento, Semiconfinamiento y Pastoreo en Municipios de Antioquia, Colombia
Prevalence of gastrointestinal nematodes in sheep and goat production systems under confinement, semi-confinement and grazing in Municipalities of Antioquia, Colombia
Richard Zapata Salas1,3, Raúl Velásquez Vélez2, Liseth Vanessa Herrera Ospina1, Leonardo Ríos Osorio1, Diana N. Polanco Echeverry1
1 Grupo de Investigación en Microbiología Veterinaria, Escuela de Microbiología, Universidad de Antioquia, Colombia
2 Politécnico Colombiano Jaime Isaza Cadavid. Universidad Nacional de Colombia, Sede Medellín, Colombia
3 E-mail: richard.zapata@udea.edu.co
RESUMEN
El objetivo del estudio fue determinar la prevalencia de nematodos gastrointestinales en sistemas de producción de ganado ovino y caprino en el trópico de Antioquia, Colombia, mediante un estudio descriptivo transversal. Se incluyeron 17 apriscos de 9 municipios y 302 animales (ovejas y cabras). Se evaluó la frecuencia de parasitismo gastrointestinal y carga parasitaria de especies y géneros determinados a través de la caracterización taxonómica por identificación de las larvas (L3), considerando variables clínico-epidemiológicas. El 76% de los animales se encontraba infectado, donde el 69.5% presentó cargas parasitarias bajas (menos de 200 hpg de heces). Se concluyó que los apriscos de Antioquia presentan alta prevalencia de infección por Tricostrongilidos, siendo Haemonchus contortus (61.3%), Teladorsagia (Ostertagia) circumcincta (25.5%) y Trichostrongylus sp (21.5%) los parásitos más frecuentes.
Palabras clave: Antioquia, Haemonchus contortus, nematodos gastrointestinales, ovejas, cabras
ABSTRACT
The aim of this study was to determine the prevalence of gastrointestinal nematodes in sheep and goat production systems in the tropics of Antioquia, Colombia through a cross-sectional study. Faecal samples were collected from 302 sheep and goats from 17 farms in 9 municipalities. The prevalence of nematode infection and the parasite burden based on species and genus identified through taxonomic characterization of infective third-stage larvae (L3) and considering clinical and epidemiological variables were evaluated. The prevalence of infected ruminants was 76%, where 69.5% showed low parasite burden (less than 200 epg of faeces). It is concluded that ovine and caprine farms in Antioquia had high prevalence of Trichostrongylids infection, where Haemonchus contortus (61.3%), Teladorsagia (Ostertagia) circumcincta (25.5%) and Trichostrongylus sp (21.5%) were the most common parasites.
Key words: Antioquia, Haemonchus contortus, gastrointestinal nematode, sheep, goats
INTRODUCCIÓN
La cadena ovina y caprina colombiana la integran dos sistemas de producción: el primero se dedica a la producción de cárnicos y lana, y el segundo se dedica a la producción de leche y sus derivados (MADR, 2006). La población ovina y caprina en Colombia era de 1 260 916 y de 1 114 874 cabezas en 2013, donde la población ovina actual representa el 55% de la población existente en el año 2000, mientras que la población caprina se ha mantenido relativamente constante (FAO, 2015).
La producción de ovinos y caprinos está distribuida en todo el país, siendo más intensiva en los departamentos de la Guajira, Magdalena, Atlántico, Bolívar, Sucre y Córdoba; además, los departamentos de Santander, Nariño, Putumayo, Cesar y el altiplano Cundiboyacense registran niveles importantes de producción de pequeños rumiantes (MADR, 2006).
El endoparasitismo por nematodos es una de las causas más importantes de la baja productividad y merma económica de los sistemas pecuarios ovinocaprinos del mundo en general y de Colombia en particular. Los parásitos pueden alterar el bienestar animal y, por tanto, los niveles productivos de las fincas, independientemente del sistema productivo, aunque con una aparente relación con el sistema de manejo bajo pastoreo (Herrera et al., 2013). Estas infecciones tienen efectos directos sobre la ganancia de peso, el desarrollo corporal, el comportamiento reproductivo y la producción de leche, así como efectos indirectos tales como la subutilización del recurso forrajero y la predisposición a enfermedades (Soca et al.,2005), además de los costos implicados en los tratamientos del animal que generan mayores gastos en la producción, reduciendo la rentabilidad (Márquez, 2003).
La nematodiosis es una enfermedad multietiológica ocasionada por varios nematodos gastrointestinales de varias especies y géneros (Soca et al., 2005), pudiendo ubicarse en los diversos segmentos del tracto digestivo de los rumiantes. Los principales nematodos que afectan a caprinos y ovinos son Haemonchus contortus, Cooperia sp, Teladorsagia (Ostertagia) circumcincta, Trichostrongylus sp y Oesophagostomum sp (Márquez, 2003; Arece et al., 2005; Molento et al., 2011; Herrera et al., 2013).
Pocos estudios presentan el estado del parasitismo gastrointestinal en pequeños rumiantes en el departamento de Antioquia, de allí que el presente estudio tuvo como objetivo determinar la prevalencia de nematodos gastrointestinales en ovinos y caprinos en tres sistemas de manejo en municipios antioqueños.
MATERIALES Y MÉTODOS
Diseño y Población de Estudio
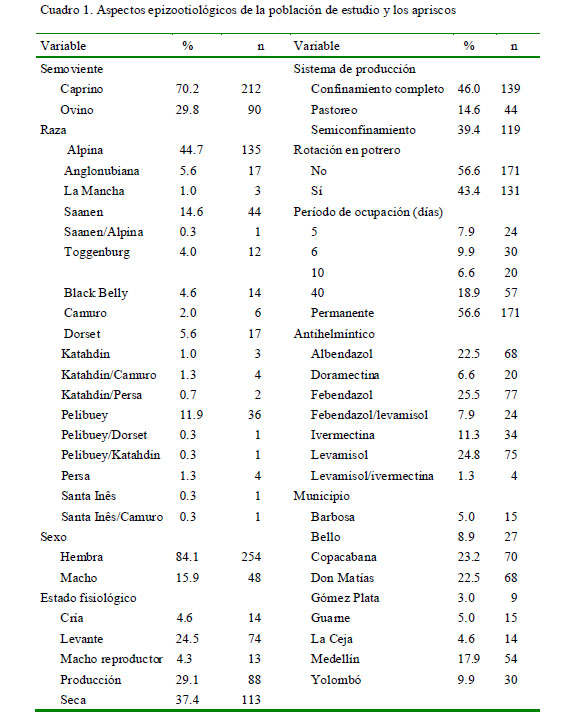
El estudio fue de tipo descriptivo transversal. Se diseñó un muestreo no probabilístico en ovinos y caprinos distribuidos en 17 apriscos de municipios del norte y nororiente de Antioquia. Estos fueron en Yolombó (7), Medellín (2), Copacabana (2), Barbosa (1), Bello (1), Gómez Plata (1), Guarne (1), Don Matías (1) y La Ceja (1), los cuales se encuentran entre los 1300 y 2200 msnm, con temperaturas entre 16 y 28 °C y precipitación media anual de 1656 mm, con variaciones según la zona.
El cálculo muestral se obtuvo a partir de una población de referencia (universo muestral) de 950 animales. Se tuvo en cuenta un nivel de confianza del 95%, un error probabilístico del 5% y un valor P de 0.5. Los datos se ingresaron al programa Epi-info 2004 resultando una muestra (n) de 274 animales, a la cual se sumó un 10% (28) previendo posibles pérdidas de muestras, así como para incrementar el poder estadístico. La muestra final de 302 animales estuvo constituida por 90 ovinos Persa, Camuro, Santa Inés, Santa Inês/Camuro, Black Belly, Kathadin, Katahdin/Camuro, Kathadin/Persa, Pelibuey, Pelibuey/Dorset, Pelibuey/Kathadin y Dorset y 212 caprinos Alpina, Saanen, Sannen/ Alpina, Toggenburg, Anglonubiana y La Mancha. Se trabajó con animales machos y hembras, con edades entre 2 y 142 meses, en sistemas de producción en confinamiento completo, semiconfinamiento y pastoreo. Tres apriscos (17.6%) contenían tanto ovinos como caprinos.
El estudio fue aprobado por el Comité de Ética en Investigación Animal de la Universidad de Antioquia mediante Acta N.° 65 del 29 de septiembre de 2010. Los propietarios de los apriscos fueron informados sobre los objetivos, alcances e implicación del estudio en sus animales, garantizando las buenas prácticas en el manejo de los animales; asimismo, se obtuvo su consentimiento informado.
Datos de Campo y Muestras
Se recolectó una muestra fecal (20 g) directamente del recto de cada animal, los cuales fueron seleccionados al azar en cada aprisco. La mitad de la muestra fue conservada con formalina al 10% para el análisis cuantitativo de nematodos y la otra mitad fue transportada en frascos sin preservante para el cultivo de larvas.
Se recolectaron muestras de sangre (4 ml) de la vena yugular de cada animal en tubos con EDTA y fueron conservadas a 4 oC para la determinación del hematocrito por la técnica de microhematocrito.
En el momento de la toma de las muestras se aplicó una encuesta como instrumento para la recolección de información de los animales y de los apriscos.
Análisis de Laboratorio
La carga parasitaria se determinó mediante el recuento de huevos utilizando la cámara McMaster (Shapiro, 2010), la cámara triple-chambered McMaster counting slide (Chalex Corporation®) y la solución de Sheather.
Para la obtención de larvas L3 se implementó la técnica de cultivo Corticelli y Lai (Van Wyk et al., 2004). Las larvas se conservaron en 50 μl de formalina al 10% y se identificaron por microscopía a nivel de géner o o es p ecie u t iliza ndo cla ves taxonómicas basadas en su morfología (tamaño total, tamaño de la cola y forma de la vaina, tamaño y forma del esófago, cantidad y forma de las células esticosomales y cuerpos refringentes) (Van Wyk et al., 2004).
Análisis Estadístico
Se evaluaron las variables edad, sexo, alzada (cm), semoviente (ovino, caprino), tipo y frecuencia de tratamiento antihelmíntico, sistema de producción (confinamiento completo, semiconfinamiento, pastoreo), estado fisiológico (cría, levante, macho reproductor, producción, seca), condición corporal (escala de 1 a 5), producción de leche (sí, no), rotación en potrero (sí, no) y periodo de ocupación (en días) y los resultados de la valoración de palidez en conjuntiva ocular por el método FAMACHA (Batch et al., 2001).
Se calculó la frecuencia global de infección por tricostrongilidos y específicas por género de nematodo y se determinó su posible asociación con el sexo, semoviente, sistema de producción, estado fisiológico, producción, rotación en potrero y periodo de ocupación, mediante las pruebas de Chi Cuadrado de Pearson y Exacta de Fisher. Asimismo, la posible asociación con la edad, condición corporal, alzada, frecuencia de antihelmíntico, hematocrito y valor de FAMACHA se realizó a través de la Prueba U de Mann Whitney, dado el incumplimiento del supuesto de normalidad evaluado a través de las pruebas Kolmogorov Smirnov con corrección de la significación de Lilliefors y Shapiro Wilk.
Los datos fuer on analizados en el Statistical Package for the Social Sciences for Windows, software SPSS® v. 20.0, considerando p<0.05 como significación estadística.
RESULTADOS
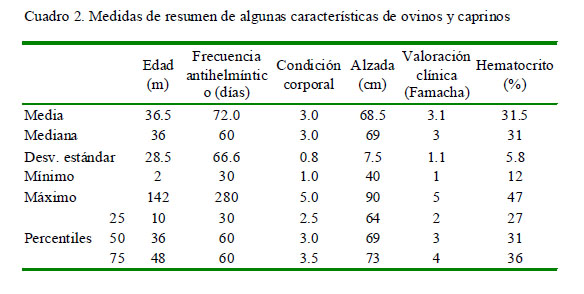
Los Cuadro 1 y 2 presentan las características de la población de estudio y de los apriscos en relación con la epizootiología de la nematodosis caprina y ovina. Se trabajó con 212 (70.2%) caprinos y 90 (29.8%) ovinos con edades entre los 2 y 142 meses (promedio: 36 meses), donde el 50% de los valores centrales de la edad estuvieron entre 10 y 48 meses. Los valores más frecuentes fueron para la raza Alpina (44.7%), el sistema de confinamiento completo (46%) y el no uso de rotación de potreros (56.6%).
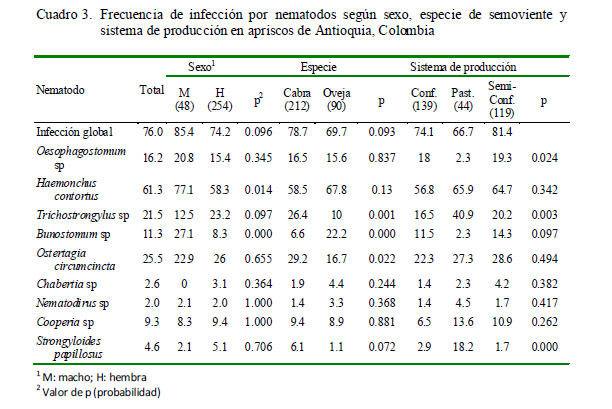
La frecuencia de infección por nematodos fue de 76%, siendo Haemonchus contortus (61.3%), Teladorsagia (Ostertagia) circumcincta (25.5%) y Trichostrongylus sp (21.5%) los parásitos más frecuentes (Cuadro 3). El 11.6% de los animales presentaron cargas parasitarias de 700 o más huevos por gramo de heces (hpg), el 18.9% presentó cargas medias entre 201 y 700 hpg y el 69.5% presentó cargas bajas por debajo de los 200 hpg.
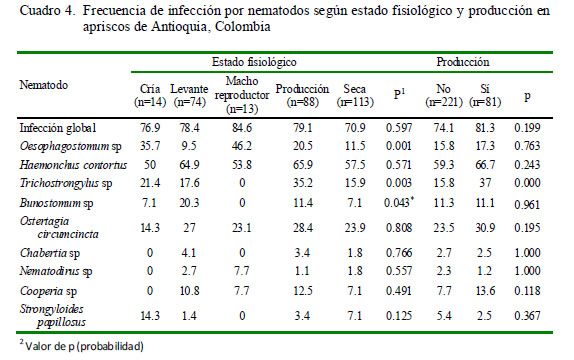
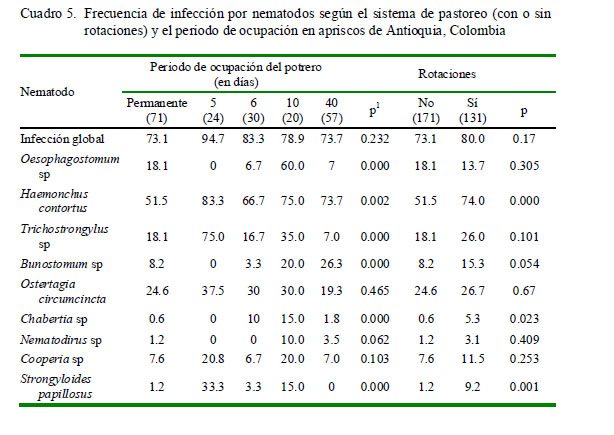
Se encontró asociación estadística ent re la infección por los nematodos H. contortus y Bunostomum sp con el sexo (Cuadro 3), Trichostrongylus sp, Bunostomum sp y Telador sagia (Ost ertag ia) circumcincta con la especia de semoviente (Cuadro 3 ), Oesophagotomum sp y Trichostrongylus sp con el sistema de producción (Cuadro 3), Oesophagostomum sp, Trichostrongylus sp y Bunostomum sp con el esta do fisiológico (Cuadro 4), Trichostrongylus sp con la producción de leche (Cuadro 4), H. contortus, Chabertia sp y S. papillosus con la rotación de potreros (Cuadro 5). Asimismo, la mayoría de parásitos presentó asociación estadística con el periodo de ocupación de los potreros (Cuadro 5).
Al utilizar la prueba de contraste U de Mann Whitney, no se encontró relación estadística entre la infección y las variables edad (p=0.345), condición corporal (p=0.310), alzada (p=0.405), frecuencia de tratamiento antihelmíntico (p=0.191) y hematocrito (p=0.831). No obstante, se encontró una relación significativa entre la infección y los valores de FAMACHA (p=0.033).
DISCUSIÓN
En el presente estudio se encontraron animales infectados en los nueve municipios, con una frecuencia de 76% de infección por nematodos gastrointestinales.
En Latinoamérica, Brasil y México son importantes representantes de la industria ovina y caprina , y constituyen zonas enzoóticas para la nematodosis. En la actualidad, los estudios se encuentran enfocados en la resistencia a los medicamentos y en las prácticas de manejo frente a los tricostrongilidos (Torres-Acosta et al., 2003; Guimarães et al., 2011; Gaba et al., 2012).
En Colombia se han desarrollado pocos estudios epidemiológicos que involucren el grupo de los tricostrongilidos. Ensuncho-Hoyos et al. (2014), encontraron una prevalencia del 97.7% en una población de ovinos de pelo al pastoreo en Córdoba; Pulido-Medellín et al. (2014), en Toca, Boyacá, encontraron el 33.5% de los ovinos infectados por parásitos del suborden Strongylida; en tanto que Herrera et al. (2013), en una población de ovinos y caprinos en Antioquia, reportaron 86.3% de infección por tricostrongilidos, siendo H. contortus (66.3 %), Oesophagostomum sp (38.9%), Trichostrongylus sp (34.7 %) y Teladorsagia (Ostertagia) circumcincta (24.2%) los parásitos más prevalentes.
Resultados similares se obtuvieron en el presente estudio, donde los tricostrongilidos H. contortus, Teladorsagia (Ostertagia) circumcincta y Trichostrongylus sp fueron los parásitos más frecuentes. Este hallazgo podría estar influenciado por la facultad que tienen estos nematodos para realizar hipobiosis, proceso biológico del parásito en el que efectúa un cese temporal del desarrollo en un punto preciso de sus estadios larvarios (L3 y L4) que depende de elementos facultativos del hospedero y de factores climáticos (Morgan y van Dijk, 2012). Esto ha sido observado para H. contortus y Ostertagia sp en ovejas en España (Uriarte et al., 2003). La ocurrencia de hipobiosis en tricostrongilidos en regiones de trópico y subtrópico como Colombia no es clara; sin embargo, su alta prevalencia demostrada en el estudio podría estar relacionada con este proceso biológico.
La asociación significativa entre sexo e infección por H. contortus (p=0.014) y Bunostomum sp (p=0.000) y el sexo, donde los machos se muestran más susceptibles a la infección (Cuadro 3), podría estar asociada a la producción de testosterona en machos enteros y su efecto negativo sobre la inmunidad de los animales (Gauly et al., 2006; Aguilar-Caballero et al., 2008).
La ausencia de infección por Trichostrongylus sp y Bunostomum sp en los machos reproductores es notoria, a pesar que estos animales se encontraban en los apriscos conjuntamente con los demás grupos de animales. Este hallazgo, opuesto a la mayor susceptibilidad de machos enteros a la infección por nematodos, podría estar relacionada con la resistencia genética de ciertas razas al parasitismo gastrointestinal, especialmente si se considera que el 46.2 y 23.1% de los machos reproductores fueron de las razas Alpina y Saanen, respectivamente, razas que son consideradas resistentes a la infección (Baker et al., 2001).
Si bien hay evidencia limitada sobre la resistencia de razas de cabras frente a los nematodos gastrointestinales, se dispone de mayor información sobre razas de ovinos. Entre las que han demostrado esta resistencia, especialmente frente a H. contortus se encuentran Blackbelly, St. Croix, Katahdin, Red Maasai, Nali, Florida, Castellana, Gulf Coast Native, Scottish Blackface, Santa Inês (Amarante A y Amarante M, 2003) y Polaca de Lana Larga (Bishop y Stear, 2003). Asimismo, se ha descrito la resistencia a la infección por Trichostrongylus colubriformis en la raza Merino (Amarante A y Amarante M, 2003).
A pesar de haber encontrado una asociación significativa entre la infección y el tipo de semoviente, donde los caprinos presentan mayor infección por Trichostrongylus sp y Teladorsagia (Ostertagia) circumcincta (p<0.001) y los ovinos mayor infección por Bunostomum sp (p<0.022), no hay estudios que sustenten mayor afinidad o predilección por dichos hospederos. Por otro lado, solo 3 de los 17 apriscos tenían producción mixta de ovinos y caprinos, de allí que es posible que este comportamiento pudiera estar relacionado con la endemicidad de los parásitos en los apriscos y no con el tipo de semoviente.
Se encontró una asociación significativa (p<0.000) entre el porcentaje de infección por T. colubriformis y animales que estaban en lactación (Cuadro 4). Asimismo, Hoste y Chartier (1993) encontraron que cabras con menores índices de producción de leche presentaban una mayor prevalencia de H. contortus y T. colubriformis, así como valores más bajos de hematocrito y recuento de glóbulos rojos. En forma similar, Alberti et al. (2012), encontraron una asociación entre la ovoposición de los parásitos con la raza y número de lactancia en cabras.
La frecuencia de infección por H. contortus, Chabertia sp y S. papillosus presentó una asociación significativa con la rotación en potrero, donde los animales presentaban un nivel de parasitismo mayor en apriscos con rotaciones de potreros en comparación con apriscos donde el pastoreo era permanente en un solo potrero. Estos resultados son concordantes con los obtenidos en un estudio en México, donde los mayores recuentos de hpg de materia fecal se encontraron en animales bajo pastoreo rotacional, comparados con animales en pastoreo permanente (Vásquez et al., 2003). Adicionalmente, se obtuvo asociación estadística entre el periodo de ocupación del potrero y la prevalencia de infección de varios tipos de parásitos (Cuadro 5). Se ha encontrado que en periodos de ocupación de pocos días el consumo de alimento se realiza cerca de sus excretas, lo que podría incrementar la ingestión del estadio infectante L3. Por otro lado, el pastoreo permanente puede ser más eficiente para disminuir infección y carga parasitaria, siempre que el área de forraje sea amplia con relación al número de animales (Vásquez et al.,2003).
La mayoría de estrongilidos como H. contortus y Chabertia sp, y a su vez S. papillosus requieren entre 5 y 7 días para el desarrollo de las larvas infectantes L3 en los pastos (Zajac, 2006). No obstante, el desarrollo de huevo a L3 en H. contortus puede variar de 3 a 5 días con temperatura ambiente de 25-26 °C y de 15 a 30 días con temperaturas de 10-11 °C (Rose, 1963). En este estudio no se evaluó el periodo de descanso de los potreros; sin embargo, es importante resaltar esta práctica de manejo como fundamental y complementaria al manejo del periodo de ocupación de potreros para disminuir la infección y la carga parasitaria en los animales. Se ha demostrado que bajo las condiciones ecológicas de países tropicales, el sistema de pastoreo rotacional con periodos de ocupación de 3.5 días y descansos de 35 días puede disminuir cerca del 50% de la carga parasitaria en ovinos; más aún si el periodo de descanso es superior a dos meses (Vásquez et al., 2003). Donald (1967) recomienda periodos de descanso de potreros no menores de 56 días para alcanzar reducciones significativas de la presencia y viabilidad de las larvas infectivas en las pasturas. Asimismo, Colvin et al. (2008) encontraron mayor prevalencia de H. contortus en sistemas de pastoreo con periodos largos de ocupación que en un sistema de pastoreo rotacional intensivo.
CONCLUSIONES
-
El 76% de los ovinos y caprinos se encontraba infectado, donde el 69.5% presentó cargas parasitarias bajas (menos de 200 hpg de heces).
-
Los apriscos en Antioquia presentan alta prevalencia de infección por Tricostrongilidos, siendo Haemonchus contortus, Teladorsagia (Ostertagia) circumcincta y Trichostrongylus sp los parásitos más frecuentes.
-
Los machos registraron una mayor susceptibilidad a la infección por Haemonchus contortus y Bunostomum sp, y los machos reproductores de las razas Alpina y Saanena Oesophagostomum sp.
-
Las hembras productoras de leche fueron más susceptibles a la infección por Trichostrongylus sp.
Agradecimientos
El proyecto de investigación fue financiado por el Comité para el Desarrollo de la Investigación de la Universidad de Antioquia, en convocatoria menor cuantía 2010, ACTA CIEM-028-10 del Centro de Investigación de la Escuela de Microbiología. Los autores agradecen a los productores de la industria ovinocaprina que apoyaron el desarrollo del estudio.
LITERATURA CITADA
1. Aguilar-Caballero AJ, Torres-Acosta JFJ, Cámara-Sarmiento R, Hoste H, Sandoval-Castro CA. 2008. Inmunidad contra los nemátodos gastrointestinales: la historia caprina. Trop Subtrop Agroecosyst 9: 73-82. [ Links ]
2. Alberti EG, Zanzani S, Ferrari N, Bruni G, Manfredi MT. 2012. Effects of gastrointestinal nematodes on milk productivity in three dairy goat breeds. Small Ruminant Res 106S: S12-S17. doi: 10.1016/j.smallrumres.2012.04.027 [ Links ]
3. Amarante AFT, Amarante MRV. 2003. Breeding sheep for resistance to nematode infections. J Anim Vet Adv 2: 147-161. [ Links ]
4. Arece J, Rodríguez JG, Torres- Hernández G, Olivares JL. 2005. Especies de estrongílidos gastrointestinales que afectan los ovinos en la provincia de Matanzas, Cuba. Rev Salud Anim 27: 31-37. [ Links ]
5. Baker RL, Audho JO, Aduda EO, Thorpe W. 2001. Genetic resistance to gastro-intestinal nematode parasites in Galla and Small East African goats in the sub-humid tropics. Anim Sci 73: 61-70. [ Links ]
6. Batch G, Hansen J, Krecek R, Vanwyk J, Vatta A. 2001. Sustainable approaches for managing haemonchosis in sheep and goats. Final report of FAO Technical Cooperation Project in South Africa. Rome: FAO. 90 p. [ Links ]
7. Bishop SC, Stear MJ. 2003. Modeling of host genetics and resistance to infectious diseases: understanding and controlling nematode infections. Vet Parasitol 115: 147-166. doi: 10.1016/ S0304-4017(03)00204-8 [ Links ]
8. Colvin AF, Walkden-Brown SW, Knox MR, Scott JM. 2008. Intensive rotational grazing assists control of gastrointestinal nematodosis of sheep in a cool temperate environment with summer-dominant rainfall. Vet Parasitol 153: 108-120. doi: 10.1016/j.vetpar.2008.01.014 [ Links ]
9. Donald AD. 1967. Populations of strongyloid infective larvae in pastures after sheep are removed from grazing. Aust Vet J 43: 122-128. [ Links ]
10. Ensuncho-Hoyos C, Castellano-Coronado A, Maza-Ángulo L, Bustamante- Yánez M, Vergara-Garay O. 2014. Prevalencia y grado de infección de nematodos gastrointestinales en ovinos de pelo en pastoreo de cuatro municipios de Cordoba, Colombia. Rev Cientif LUZ 24: 414-420. [ Links ]
11. [FAO] Food and Agriculture Organization of the United Nations. 2015. FAOSTAT. [Internet]. Available in: http://faostat3.fao.org/download/Q/ QL/E [ Links ]
12. Gaba S, Cabaret J, Chylinski C, Sauvé C, Cortet J, Silvestre A. 2012. Can efficient management of sheep gastrointestinal nematodes be based on random treatment? Vet Parasitol 190: 178-184. doi: 10.1016/j.vetpar.2012.06.011 [ Links ]
13. Gauly M, Schackert M, Hoffmann B, Erhardt G. 2006. Influence of sex on the resistance of sheep lambs to an experimental Haemonchus contortus infection. Dtsch Tierarztl Wochenschr 113: 178-181. [ Links ]
14. Guimarães AS, Gouveia AM, do Carmo FB, Gouveia GC, Silva MX, Vieira LS, Molento MB. 2011. Management practices to control gastrointestinal parasites in dairy and beef goats in Minas Gerais; Brazil. Vet Parasitol 176: 265-269. doi: 10.1016/j.vetpar.2010.10.049 [ Links ]
15. Herrera L, Ríos L, Zapata R. 2013. Frecuencia de infección por nemátodos gastrointestinales en ovinos y caprinos de cinco municipios de Antioquia. Rev MVZ Córdoba 18: 3851-3860. [ Links ]
16. Hoste H, Chartier C. 1993. Comparison of the effects on milk production of concurrent infection with Haemonchus contortus and Trichostrongylus colubriformis in high-and low-producing dairy goats. Am J Vet Res 54: 1886-1993. [ Links ]
17. Márquez D. 2003. Resistencia a los antihelmínticos: origen, desarrollo y control. Rev CORPOICA 4(1): 55-71. [ Links ]
18. [MADR] Ministerio de Agricultura y Desarrollo Rural. Observatorio Agrocadenas Colombia. 2006. La cadena ovinos y caprinos en Colombia. Doc Trabajo 125. Bogotá: MADR. [Internet]. Disponible en: http://agronet.gov.co/ www/docs_agronet/20078611357_ caracterizacion_ovinosycaprinos.pdf [ Links ]
19. Molento MB, Fortes FS, Pondelek DA, Forges FA, Chagas AC, Torres- Acosta JF, Geldhof P. 2011. Challenges of nematode control in ruminants: focus on Latin America. Vet Parasitol 180: 126- 132. doi: 10.1016/j.vetpar.2011.05.033 [ Links ]
20. Morgan ER, van Dijk J. 2012. Climate and the epidemiology of gastrointestinal nematode infections of sheep in Europe. Vet Parasitol 189: 8-14. doi: 10.1016/ j.vetpar.2012.03.028 [ Links ]
21. Pulido-Medellín MO, García-Corredor D, Díaz-Anaya A, Andrade-Becerra A. 2014. Pesquisa de parásitos gastrointestinales en pequeñas explotaciones ovinas del municipio de Toca, Colombia. Rev Salud Anim 36: 65-69. [ Links ]
22. Rose JH. 1963. Observations on the free-living stages of the stomach worm Haemonchus contortus. Parasitology 53: 469-481. doi: 10.1017/S00311820000 73923 [ Links ]
23. Shapiro LS. 2010. Pathology and parasitology for veterinary technicians. 2nd. USA: Delmar Cengage Learning. 302 p. [ Links ]
24. Soca M, Roque E, Soca M. 2005. Epizootiología de los nematodos gastrointestinales de los bovinos jóvenes. Pastos y Forrajes 28: 175-185. [ Links ]
25. Torres-Acosta JF, Villarroel-Álvarez MS, Rodríguez-Arévalo F, Gutiérrez- Segura I, Alonso-Díaz MA. 2003. Diagnóstico de nematodos gastrointestinales resistentes a bencimidazoles e imidazotiazoles en un rebaño caprino de Yucatán, México. Rev Biomed 14: 75-81. [ Links ]
26. Uriarte J, Llorente MM, Valderrábano J. 2003. Seasonal changes of gastrointestinal nematode burden in sheep under an intensive grazing system. Vet Parasitol 118: 79-92. doi: 10.1016/ j.vetpar.2003.07.030 [ Links ]
27. Van Wyk JA, Cabaret J, Michael LM. 2004. Morphological identification of nematode larvae of small ruminants and cattle simplified. Vet Parasitol 119: 277- 306. doi: 10.1016/j.vetpar.2003.11.012 [ Links ]
28. Vasquez M, González R, Torres G, Mendoza P, Ruiz JM. 2006. Comparación de dos sistemas de pastoreo en la infestación con nematodos gastrointestinales en ovinos de pelo. Vet Méx 37: 15-27. [ Links ]
29. Zajac AM. 2006. Gastrointestinal nematodes of small ruminants: life cycle, anthelmintics, and diagnosis. Vet Clin North Am Food Anim Pract 22: 529-541. doi: 10.1016/j.cvfa.2006.07.006 [ Links ]
Recibido: 6 de agosto de 2015
Aceptado para publicación: 16 de diciembre de 2015