Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.2 Lima abr./jun. 2016
http://dx.doi.org/10.15381/rivep.v27i2.11653
ARTÍCULOS PRIMARIOS
Seroprevalencia de Toxoplasma gondii en Gallus domesticus en La Habana, Cuba
SEROPREVALENCE of Toxoplasma gondii in Gallus domesticus in Havana, Cuba
Raiden Grandía G.1,4, Manuel Colas C.2, Julio Soroa R.1, Ángel Entrena G.1, Teresa Figueroa B.1, Ana Bada B.1, Susana Jáuregui C.1, Yara Caraballoso H.1, Itamys García V.1, Miriam Burón R.1, Moraima Pérez G.1, Natacha Negrin R.1, Danny Pantaleón M.3, Raydel Frías M.3, Ángel Rodríguez L.3, Miguel Barrios H.3, Ariam Rodríguez J.3
1 Centro Nacional para la Producción de Animales de Laboratorio, CENPALAB, Cuba
2 Universidad Agraria de La Habana, UNAH, Cuba
3 Unidad Empresarial Básica Avícola «El Paraíso», Cuba
2 E-mail: raiden.grandia@cenpalab.cu
RESUMEN
El estudio tuvo como objetivo determinar la seroprevalencia de T. gondii en Gallus domesticus en La Habana, Cuba. Se colectaron 300 muestras de suero de pollitas White Leghorn L33 en fase de desarrollo en 2015, distribuidas a razón de 100 aves por cada lote incorporado a la unidad avícola desde procedencias diferentes. Las muestras fueron analizadas mediante un ELISA de inhibición y se utilizaron las pruebas Chi-cuadrado y Dócima de Duncan para comparar las proporciones de aves positivas entre los lotes estudiados. Se encontró una relativa baja seroprevalencia de T. gondii (9.6%), similar a otros hallazgos reportados a nivel internacional. Se evidenciaron diferencias significativas (p=0.0001) en la prevalencia de T. gondii entre los tres lotes de aves. Se concluye que la seroprevalencia de T. gondii en Gallus domesticus en La Habana es baja, aunque esta constituye un riesgo de infección para las poblaciones humanas y animales susceptibles.
Palabras clave: seroprevalencia, Toxoplasma gondii, Gallus domesticus, La Habana
ABSTRACT
The aim of this study was to determine the seroprevalence of T. gondii in Gallus domesticus in Havana, Cuba. Three hundred serum samples were collected from White Leghorn pullets L33 in growing stage in 2015. Samples represented 100 birds per batch incorporated into the poultry unit from different origins. Samples were evaluated by an ELISA inhibition test and data was analyzed by the Chi-square and Duncan tests to compare proportions of positive birds among batches. A relatively low seroprevalence of T. gondii was found (9.6%), similar to other findings reported internationally. Significant differences (p=0.0001) in the prevalence of T. gondii among the three bird batches were found. It is concluded that the seroprevalence of T. gondii in Gallus domesticus in Havana is low, though this constitutes a risk of infection for susceptible human and animal populations.
Key words: seroprevalence, Toxoplasma gondii, Gallus domesticus, Havana
INTRODUCCIÓN
Desde el descubrimiento en 1908 por Nicolle y M anceaux, Toxoplasma gondii (T. gondii) ha sido reportado a nivel mundial como un protozoo que afecta a diversas especies de mamíferos y aves, sin excluir al ser humano. La toxoplasmosis es por lo tanto considerada una zoonosis cosmopolita y de gra n import ancia médica y veterina ria (Aldebret et al., 2011; Shah et al., 2014).
Esta enfermedad es generalmente de curso asintomático en las aves (Dubey,
2010a,b), aunque en algunos casos con síntomas muy sutiles comunes a otras afecciones, al mismo tiempo que genera lesiones silentes en órganos vitales para el desarrollo y la expresión potencial de las características productivas en aves destinadas a la producción. Asimismo, se ha demostrado un mayor riesgo de infección con T. gondii en poblaciones de pollos criados en condiciones poco controladas (Asgari et al., 2008), donde la mortalidad puede alcanzar hasta un 50% (Kaufmann, 1996).
La toxoplasmosis clínica en pollos presenta lesiones en encéfalo y en el globo ocular, así como quistes tisulares en cerebro, corazón, músculo esquelético y diafragma (Dubey, 2010b). Asimismo, se reportan tremores de cuello y cabeza, parálisis y pérdida de la visión, inhabilidad en la marcha, posición lateral yacente y reducción de la producción de huevos (Kaufmann, 1996; Dubey et al., 2007).
En La Habana, Cuba, se reportan valores de seroprevalencia en humanos superiores al 70% (Calero, 2013). Asimismo, otros estudios en esta ciudad evidenciaron una seroprevalencia similar en gatos, la que estuvo condicionada por la existencia de factores de riesgo que incrementaron la vulnerabilidad en estos hospederos definitivos (Grandía et al., 2013a,b). Esta elevada prevalencia en los gatos habaneros constituye un riesgo potencial de infección para otros hospederos intermediarios como los pollos, los que han sido considerados como un indicador de contaminación del suelo por ooquistes de T. gondii (Dubey, 2010b).
Las investigaciones en Cuba sobre toxoplasmosis en aves son escasas, particularmente en pollos (Gallus domesticus), condicionado por la carencia de medios diagnósticos y recursos económicos para la importación de kits e insumos de laboratorio, así como para el desarrollo de métodos nacionales para el aseguramiento de la red de diagnóstico veterinario. Por estas razones, el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) ejecutó la validación de un sistema ELISA de inhibición para el diagnóstico de T. gondii en varias especies, incluyendo las aves.
El desarrollo de este método diagnóstico, unido a la importancia que tienen las aves como hospederos intermediarios en la transmisión de este protozoo hacia el ser humano y otros animales, y el efecto negativo de la toxoplasmosis en la expresión genética productiva en aves de cría intensiva, promovieron la implementación del presente estudio con el objetivo de determinar la seroprevalencia de T. gondii en G. domesticus en La Habana.
MATERIALES Y MÉTODOS
El estudio transversal de T. gondii se realizó en una unidad avícola del oeste de La Habana, Cuba, ubicada en una zona a 90 m sobre el nivel del mar, con valores promedios anuales de temperatura de 21 °C y humedad relativa de 65%. Esta unidad tiene como propósito la cría intensiva de pollitas de reemplazo de ponedoras White Leghorn (genotipo L33) en fase de desarrollo.
Selección y Toma de Muestra
Se seleccionó una muestr a de 300 pollitas de 16 semanas de edad, distribuida a razón de 100 aves por cada lote incorporado a la instalación avícola desde procedencias diferentes. El muestreo se realizó en los meses de febrero y marzo de 2015. Para el estudio se seleccionaron 50 aves por nave (seis naves), ubicadas en lugares representativos de las instalaciones.
Se recolectó 1.5 ml de sangre de cada ave por punción de la vena braquial con jeringuilla de 5 ml y aguja 21 G, con previa antisepsia de la zona de extracción con alcohol al 70%. La sangre fue transferida a viales Eppendorf de 1.5 ml y centrifugada a 3500 g durante 5 min para separar el suero, el cual se trasvasó a viales de 0.5 ml. Las muestras fueron conservadas a -20 °C.
Serología
Las muestras de suero se procesaron en el Laboratorio del Grupo Investigación + Desarrollo de la Dirección de Biotecnología del CENPALAB con la utilización de un ELISA de inhibición (ELISA/i). Este ensayo fue diseñado para determinar anticuerpos
antiT. gondii en varias especies (Entrena,2011). Se utilizó un conjugado obtenido de conejos inmunizados en el CENPALAB, compuesto por una IgG policlonal antiT. gondii conjugada con peroxidasa. Asimismo, se empleó un antígeno soluble proveniente de la cepa RH de T. gondii donada por el Instituto de Medicina Tropical «Pedro Kourí» en
1988, la cual tiene su origen en el Instituto Pitik-Salpet riera de Francia, y que fue criopreservada en 5% de glicerol en nitrógeno líquido hasta ser utilizada.
La densidad óptica de las muestras se determinó en un lector de ELISA (Biochrom Anthos 2010 v2) a una longitud de onda de 492 nm. Se consideraron como positivas, aquellas muestras cuyo factor de inhibición fuera igual o mayor al 20%, negativas con valores iguales o menores al 15% y sospechosas con valores mayores de 15% y menores de 20%.
Previo al monitoreo serológico, el ELISA/i fue validado frente a un sistema de referencia (Aglutinación con Látex) de origen italiano (Mascia Brunelli SpA). La evaluación de los controles negativo y positivo (de bajo y alto título) demostró una repetibilidad y precisión intermedia adecuadas (CV<10%), al mismo tiempo que garantizó resultados exactos y precisos (variabilidad media de las réplicas entre ± 2 desviaciones estándares). El desempeño diagnóstico evidenció que el ELISA/i validado frente al sistema de referencia generó adecuados valores de sensibilidad (98%), especificidad (98%), valores predictivos negativos y positivos (98%), eficacia (98%) e índice Kappa (0.96).
Análisis Estadístico
Se obtuvieron frecuencias absolutas y relativas para evidenciar la cantidad de aves reactivas en cada uno de los lotes de aves. Se realizaron las pruebas Chi-cuadrado de Pearson y Dócima de Duncan para comparar las proporciones de aves positivas entre lotes. Se consideró como significación estadística una p<0.05. Los datos fueron analizados con el programa estadístico InfoStat v. 2.0.
RESULTADOS Y DISCUSIÓN
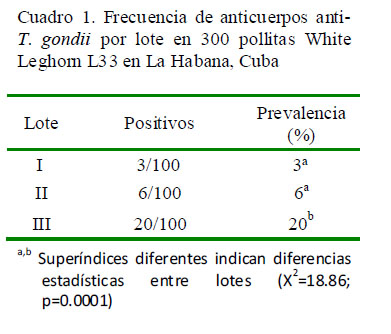
Los resultados serológicos evidenciaron 29 muestras positivas, para una prevalencia de anticuerpos antiT. gondii en las pollitas White Leghorn L33 de 9.6% (Cuadro 1); hallazgo que denota una seroprevalencia relativamente baja. Este resultado llama la atención dado que se esperaba una mayor prevalencia de T. gondii, basado en hallazgos de 2013 donde se encontraron valores de 70% en la población de gatos y superiores al 72% en humanos de La Habana (Calero, 2013; Grandía et al., 2013a). Por otro lado, no se observaron signos y síntomas compatibles con la toxoplasmosis aviar en la población estudiada.
El 9.6% de seroprevalencia sugiere la ausencia o insuficiente dosis infectiva de ooquistes de T. gondii en la mayoría de las fuentes potenciales de contaminación de las pollitas, pese a que las condiciones de almacenamiento del alimento y el no tratamiento del agua de bebida (Elsheikha, 2008) en la unidad avícola constituyeran condiciones de riesgo de infección en los animales evaluados.
Este resultado dependería también de la cepa de T. gondii circulante en la zona estudiada. Sobre ello, Dubey (2010b) hizo referencia a las manifestaciones clínicas y lesiones en pollos infectados experimentalmente con cepas de T. gondii, donde quedó demostrado que la virulencia de la cepa juega un papel esencial en la infección. Así, la infección con 100 000 ooquistes de la cepa GT1 ocasionó anorexia, necrosis focal en intestino, hígado y bazo, formación de quistes tisulares en cerebro, corazón y músculo esquelético, y muerte, en tanto que la inoculación de la cepa Me-49 con la misma dosis de ooquistes no generó signos clínicos.
Asimismo, aunque la presencia de gatos (Lopes et al., 2008) y abundantes poblaciones de insectos (moscas y cucarachas) (Dubey, 2010a) en las instalaciones de crianza están considerados escenarios que facilitan la infección con T. gondii en los hospederos susceptibles, estos factores tampoco fueron suficientes para generar una mayor prevalencia, al menos en la muestra de aves estudiada.
Existen reportes similares al del presente estudio, donde se incluyen seroprevalencias de 14 a 30% en Portugal, Polonia e Italia (Dubey et al., 2006a, 2008) y de 19 a 25% en Indonesia, Pakistán y Vietnam (Dubey et al., 2008; Dwinata et al., 2012; Mahmood et al., 2014). Asimismo, se suman otros hallazgos con prevalencias inferiores al 30% en el continente americano, como el 27.3% en Perú (Ruíz et al., 2012), 16.9% en Estados Unidos (Dubey et al., 2003) y 6.2% en México (Dubey et al., 2004).
Por otra parte, a diferencia de estos reportes mencionados y de los resultados obtenidos en este estudio, existen otros con p r eva lencia s de T. g o n d i i en Ga l l u s domesticus que superan el 45%. Por ejemplo, en países africanos como Etiopía, Egipto, Uganda, y la República Popular del Congo (El-Massry et al., 2000; Dubey et al., 2005; Lindström et al., 2008; Tilahun et al., 2013).
Igualmente, en el continente americano se han reportado valores elevados, tales como 41.2% en Brasil (Casartelli-Alves et al., 2015),
55.3% en Chile (Dubey et al., 2006b) y 85.7% en Nicaragua (Dubey et al., 2006c).
La prevalencia obtenida en las aves del presente estudio constituye un riesgo potencial de infección para otros hospederos intermediarios y definitivos. La base fundamental de ello radica en que los pollos han sido considerados un indicador de contaminación del suelo por ooquistes de T. gondii (gran susceptibilidad a la infección con esta forma infectiva) (Dubey, 2010b) y por ser su carne una de las más consumidas y de mayor riesgo de infección con quistes tisulares a nivel mundial (Lora et al., 2007; Chumpolbanchorn et al., 2013).
Este resultado permite inferir un cierto riesgo de infección para el ser humano como posible zoonosis, ya que podrían existir prevalencias superiores a la demostrada en la muestra analizada en otros muestreos de aves. Es así, que el Cuadro 1 revela diferencias significativas (p=0.0001) en la prevalencia de T. gondii entre los tres lotes de aves evaluados con diferentes orígenes de crianza, desde donde estas fueron incorporadas a la nueva instalación avícola. El lote III de pollitas provino de una zona con condiciones más adecuadas para la esporulación de los ooquistes de T. gondii (50 msnm, 22 °C de temperatura y 75% de humedad relativa), aunado de mayores deficiencias en las condiciones de almacenamiento del alimento y calidad del agua en las fases de inicio y crecimiento.
Los resultados obtenidos en el presente estudio permiten concluir que la seroprevalencia de T. gondii en Gallus domesticus en La Habana es baja, aunque esta constituye un riesgo de infección para las poblaciones humanas y animales susceptibles.
LITERATURA CITADA
1. Aldebret D, Hypolite M, Cavailles P, Touquet B, Flori P, Loeuillet C, Cesbron-Delauw MF, 2011. Development of high-throughput methods to quantify cysts of Toxoplasma gondii. Cytometry A 79: 952-958. doi: 10.1002/cyto.a.21138 [ Links ]
2. Asgari Q, Akrami-Mohajeri F, Kalantari M, Esmaeilzadeh B, Farzaneh A, Moazeni M, Ghalebi SR, et al. 2008. Chicken toxoplasmosis in different types of breeding: a seroprevalence survey in southern Iran. Int J Poultry Sci 7: 1247-1250. doi: 10.3923/ijps.2008.1247.1250 [ Links ]
3. Calero RB. 2013. Actualización sobre la toxoplasmosis humana. SOCIVESC. [Internet]. Disponible en: http://socivesc.es/index.php?view=article&catid=49%3Apublica-cionesocivesc&id=198%3Aactualizacion-sobrela-toxoplasmosis-humana&format=pdf&option=comcontent&Itemid=37 [ Links ]
4. Casartelli-Alves L, Reis MRA, Cardoso VB, Ferreira LC, Araujo JCC, Nicolau JL, de Freitas EPT, et al. 2015. Mapping of the environmental contamination of Toxoplasma gondii by georeferencing isolates from chickens in an endemic area in Southeast Rio de Janeiro State, Brazil. Geospat Health 10: 311. doi: 10.4081/gh.2015.311 [ Links ]
5. Chumpolbanchorn K, Lymbery AJ, Pallant LJ, Pan S, Sukthana Y, Thompson RC. 2013. A high prevalence of Toxoplasma in Australian chickens. Vet Parasitol 196: 209-211. doi: 10.1016/ j.vetpar.2013.01.009 [ Links ]
6. Dubey JP. 2010a. Toxoplasmosis of animals and humans. 2nd ed. Maryland: CRC Press. 319 p. [ Links ]
7. Dubey JP. 2010b. Toxoplasma gondii infections in chickens (Gallus domesticus): prevalence, clinical disease, diagnosis and public health significance. Zoonoses Public Health 57: 60 -73. doi: 10.1111/j.1863-2378.2009.01274.x [ Links ]
8. Dubey JP, Graham DH, Dahl E, Sreekumar C, Lehmann T, Davis MF, Morishita TY. 2003. Toxoplasma gondii isolates from free-ranging chickens from the United States. J Parasitol 89: 1060-1062. [ Links ]
9. Dubey JP, Morales ES, Lehmann T. 2004. Isolation and genotyping of Toxoplasma gondii from free-ranging chickens from Mexico. J Parasitol 90: 411-413. [ Links ]
10. Dubey JP, Karhemere S, Dahl E, Sreekumar C, Diabaté A, Dabiré KR, Vianna MCB, et al. 2005. First biologic and genetic characterization of Toxoplasma gondii isolates from chickens from Africa (Democratic Republic of Congo, Mali, Burkina Faso, and Kenya). J Parasitol 91: 69-72. [ Links ]
11. Dubey JP, Vianna MC, Sousa S, Canada N, Meireles S, Correia da Costa JM, Marcet PL, et al. 2006a. Characterization of Toxoplasma gondii isolates in free-range chickens from Portugal. J Parasitol 92: 184-186. doi: 10.1645/GE-652R.1 [ Links ]
12. Dubey JP, Patitucci AN, Su C, Sundar N, Kwok OCH, Shen SK. 2006b. Characterization of Toxoplasma gondii isolates in free-range chickens from Chile, South America. Vet Parasitol 140: 76-82. doi: 10.1016/j.vetpar.2006.03.023 [ Links ]
13. Dubey JP, Sundar N, Pineda N, Kyvsgaard NC, Luna LA, Rimbaud E, Oliveira JB, et al. 2006c. Biologic and genetic characteristics of Toxoplasma gondii isolates in free-range chickens from Nicaragua, Central America. Vet Parasitol 142: 47-53. doi: 10.1016/ j.vetpar.2006.06.016 [ Links ]
14. Dubey JP, Webb DM, Sundar N, Velmurugan GV, Bandini LA, Kwok OCH, Su C. 2007. Endemic avian toxoplasmosis on a farm in Illinois: clinical disease, diagnosis, biologic and genetic characteristics of Toxoplasma gondii isolates from chickens (Gallus domesticus), and a goose (Anser anser). Vet Parasitol 148: 207-212. [ Links ]
15. Dubey JP, Huong LTT, Lawson BWL, Subekti DT, Tassi P, Cabaj W, Sundar N, et al. 2008. Seroprevalence and isolation of Toxoplasma gondii from free-range chickens in Ghana, Indonesia, Italy, Poland, and Vietnam. J Parasitol 94: 68-71. doi: 10.1645/GE-1362.1 [ Links ]
16. Dwinata IM, Oka IBM, Suratma NA, Damriyasa IM. 2012. Seroprevalence and isolation of Toxoplasma gondii among free-range chickens in Bali. J Veteriner 13: 340-344. [ Links ]
17. El-Massry A, Mahdy OA, El-Ghaysh A, Dubey JP. 2000. Prevalence of Toxoplasma gondii antibodies in sera of turkeys, chickens, and ducks from Egypt. J Parasitol 86: 627-628. doi: 10.1645/0022-3395(2000)086 [0627:POTGAI]2.0.CO;2 [ Links ]
18. Elsheikha HM. 2008. Congenital toxoplasmosis: priorities for further health promotion action. Public Health 122: 335- 353. doi: 10.1016/j.puhe.2007.08.009 [ Links ]
19. Entrena AAG. 2011. Desarrollo de un sistema inmunoenzimático de inhibición de un anticuerpo, para el diagnóstico de Toxoplasma gondii en diferentes especies. Tesis Doctoral. San José de las Lajas, Cuba: Universidad Agraria de La Habana. 126 p. [ Links ]
20. Grandía RG, Entrena ÁG, Cruz JH, Ginorio DG, Domenech IC, Alfonso AM, Perdomo LR, et al. 2013a. Seroprevalencia de Toxoplasma gondii en Felis catus en La Habana. Rev Inv Vet Perú 24: 369-375. doi: 10.15381/ rivep.v24i3.2586 [ Links ]
21. Grandía RG, Entrena ÁG, Cruz JH, Ginorio DG, Domenech IC, Alfonso AM, Perdomo LR, et al. 2013b. Factores de riesgo asociados con la presencia de anticuerpos anti-Toxoplasma gondii en Felis catus en La Habana. REDVET 14 (10). [Internet]. Disponible en: http://www.veterinaria.org/revistas/ redvet/n101013.html [ Links ]
22. Kaufmann J. 1996. Parasite of poultry. In: Parasitic infections of domestic animals (A diagnostic manual). Basel: Birkhäuser Verlag. 367 p. [ Links ]
23. Lindström I, Sundar N, Lindh J, Kironde F, Kabasa JD, Kwok OCH, Dubey JP, Smith JE. 2008. Isolation and genotyping of Toxoplasma gondii from Ugandan chickens reveals frequent multiple infections. Parasitology 135: 39- 45. [ Links ]
24. Lopes AP, Cardoso L, Rodrigues M. 2008. Serological survey of Toxoplasma gondii infection in domestic cats from northeastern Portugal. Vet Parasitol 155: 184-189. doi: 10.1016/j.vetpar. 2008. 05.007 [ Links ]
25. Lora F, Aricapa HJ, Pérez JE, Arias LE, Idarraga SE, Mier D, Gómez JE. 2007. Detección de Toxoplasma gondii en carnes de consumo humano por la técnica de reacción en cadena de la polimerasa en tres ciudades del eje cafetero. Infectio 11: 117-123. [ Links ]
26. Mahmood ZU, Zahid M, Sthanadar AA, Shah M, Hussain A. 2014. Seroprevalence of Toxoplasma gondii infection in Gallus domesticus of District Mardan, Khyber Pakhtunkhwa, Pakistan. Pakistan J Zool 46: 1705-1710. [ Links ]
27. Ruíz NR, Casas EA, Suárez FA, Díaz DC, Fernández VP. 2012. Frecuencia de anticuerpos contra Neospora caninum y Toxoplasma gondii en canes con signos clínicos de afección neuromuscular. Rev Inv Vet Perú 23: 441-447. doi: 10.15381/rivep.v23i4.950 [ Links ]
28. Shah M, Zahid M, Sthanadar AA, Asmat P. 2014. Seroprevalence of Toxoplasma gondii infection in human population of Mohmand Agency, Pakistan. Pakistan J Zool 46: 1169-1172. [ Links ]
29. Tilahun G, Tiao N, Ferreira LR, Choudhary S, Oliveira S, Verma SK, Kwok OC, et al. 2013. Prevalence of Toxoplasma gondii from free-range chickens (Gallus domesticus) from Addis Ababa, Ethiopia. J Parasitol 99: 740-741. doi: 10.1645/12-25.1 [ Links ]
Recibido: 3 de septiembre de 2015
Aceptado para publicación: 28 de enero de 2016