Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.3 Lima jul./set. 2016
http://dx.doi.org/10.15381/rivep.v27i3.12007
ARTÍCULOS PRIMARIOS
Efecto Antihelmíntico in vitro del Extracto de Albizia lophantha sobre Nematodos Gastrointestinales de Caballos
In Vitro Anthelmintic Effect of the Extract of Albizia Lophantha on Gastrointestinal Nematodes of Horses
E. Chicaiza-Tisalema1, M. Barros-Rodríguez1,2, H. Zurita-Vásquez1, R. Mera-Andrade1, G. Velástegui-Espín1, M. Muñoz-Espinoza1, S. Espinoza-Vaca1, P. Ortiz-Tirado1, E. Ibarra-López1
1 Facultad de Ciencias Agropecuarias, Universidad Técnica de Ambato, Tungurahua, Ecuador
2 E-mail: ma_barrosr@yahoo.es
RESUMEN
El extracto de Albiziza lophantha fue empleado (T1: 0 mg de extracto/ml de cultivo ([mg/ml], T2: 0.04 mg/ml, T3: 0.08 mg/ml, T4: 0.12 mg/ml) para evaluar el efecto antihelmíntico in vitro en nematodos gastrointestinales de caballos. Se observó mayor inhibición en la eclosión de huevos (T4: 43% y T3: 11%) y menor supervivencia larval con dosis altas (T4: 0%, T3: 0% a las 36 y 60 horas después de aplicar el extracto, respectivamente) (p=0.0001). El extracto de A. lophantha fue eficaz en el control in vitro de nematodos gastrointestinales de caballos.
Palabras clave: Albizia lophanta, taninos, caballos, nematodos
ABSTRACT
The Albizia lophantha extract (T1: 0 mg of extract/ml of nutritive cultivation [mg/ml], T2: 0.04 mg/ml, T3: 0.08 mg/ml, T4: 0.12 mg/ml) was used to evaluate the in vitro anthelmintic effect on gastrointestinal nematodes of horses. Higher inhibition in the hatching of eggs (T4: 43% and T3: 11%, respectively) and lower in the survival of larvae in the treatments of high doses (T4: 0% and T3: 0% at 36 and 60 hours after applying the extract respectively) (p=0.0001). The A. lophantha extract was effective in the in vitro control of gastrointestinal nematodes of horses.
Key words: Albizia lophanta, tannins, horses, nematodes
INTRODUCCIÓN
El parasitismo de nematodos gastrointestinales (NGI) en equinos es uno de los casos más graves e importantes en la producción equina. El uso de plantas bioactivas ricas en metabolitos secundarios (taninos), puede ser una alternativa de control de los NGI, ya que se ha demostrado la presencia de un potente antihelmíntico natural cuando son proporcionadas a los rumiantes (Hernandez-Villegas et al., 2014). El efecto antihelmíntico de los taninos ha sido asociado con su capacidad para formar complejos con la proteína de los parásitos (Alonso-Díaz et al., 2010), afectando de esta manera el metabolismo de los nematodos (Alonso-Díaz et al., 2008; Brunet et al., 2011).
Otro mecanismo de acción directa de los taninos sobre el control de nematodos propuesto por Iqbal et al. (2007) es la unión de los taninos a la cutícula de la larva, la cual está compuesta de glicoproteínas que al ser destruidas o disminuidas producen la muerte del parásito. Con base en lo anterior, el objetivo de esta investigación fue determinar la actividad antihelmíntica in vitro del extracto de Albizia lophantha sobre nematodos gastrointestinales de caballos.
MATERIALES Y MÉTODOS
El estudio se realizó en la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Ambato, ubicada en el Cantón Cevallos, Tungurahua, Ecuador, a 2900 msnm.
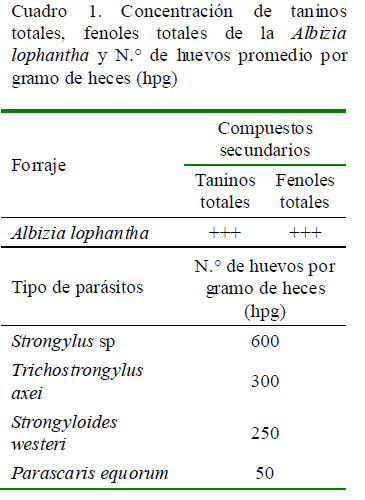
Las hojas verdes y frescas de Albizia lophantha fueron recolectadas de árboles de aproximadamente 5 m de altura, sembrados en los predios de la institución. El material vegetal fue secado a 60 ºC en estufa durante 24 h y luego fue triturado. Se pesó una muestra de 100 g que fue introducida en un balón aforado de fondo redondo, con una capacidad de 1 L. Se agregó el disolvente (300 ml de alcohol al 50%) y se sometió a baño maría a 70 °C durante 1 h. Se dejó en reposo a temperatura ambiente y se filtró a través de un papel filtro. Al extracto se le realizó un ‘screening’ fitoquímico para determinar la presencia de taninos totales y fenoles totales (Cuadro 1), siguiendo la metodología descrita por Castillo et al. (2014).
Se tomaron muestras de heces, directamente del recto de 10 caballos parasitados. Las muestras fueron colocadas en fundas plásticas dentro de un termo de polietileno a 4 °C y fueron trasladadas de inmediato al laboratorio para su análisis. Se estimó la cantidad de huevos por gramo de heces (hpg) mediante la técnica de McMaster con solución azucarada (8:1000). Se encontraron huevos de Strongylus spp, Trichostrongylus axei, Strongyloides westeri y Parascaris equorum (Cuadro 1).
El estudio in vitro se realizó con cuatro tratamientos: T1, 0 mg de extracto/ml de cultivo (mg/ml); T2, 0.04 mg/ml; T3, 0.08 mg/ml; y T4, 0.12 mg/ml.
Se estimó la inhibición in vitro de la eclosión de huevos utilizando la técnica de Willis (flotación). Se tomó 10 µl de la superficie del contenido, se depositó en un portaobjeto y se observó al microscopio. Se seleccionaron 50 huevos según el porcentaje que correspondía para cada parásito identificado, donde el porcentaje fue calculado según el número de huevos por gramo de heces: Strongylus spp (50%), Trichostrongylus axei (25%), Strongyloides westeri (20.8%) y Parascaris equorum (4.2%). Los huevos se depositaron en cajas Petri (n= 6 por tratamiento), las cuales contenían 3 ml de la solución azucarada y se incubaron a 24 °C. Luego de 16 h (hora 0) se aplicaron las dosis del extracto de acuerdo a cada tratamiento y se volvió a incubar por 24 h. Posteriormente se procedió al conteo de huevos no eclosionados y larvas L1 (hora 24), según la metodología descrita por Marie-Magdeleine et al. (2009).
Para determinar la mortalidad larval in vitro se sembraron 50 huevos en cajas Petri (n= 6 por tratamiento), según el método anteriormente descrito. Una vez ocurrida la eclosión de los huevos a estado larval L1 y L2, se aplicaron las dosis del extracto según corresponde a cada tratamiento (hora 0) y se incubó a 24 ºC. Posteriormente, se observó al microscopio cada 12 h hasta las 72 h, para contabilizar las larvas muertas por tratamiento (Marie-Magdeleine et al., 2009).
Se utilizó un diseño completamente al azar, con cuatro tratamientos y seis repeticiones (placas Petri). Las variables fueron analizadas según el diseño empleado mediante el PROC GLM del SAS. La comparación de medias se realizó mediante la prueba de Tukey en el paquete estadístico SAS 2009.
RESULTADOS
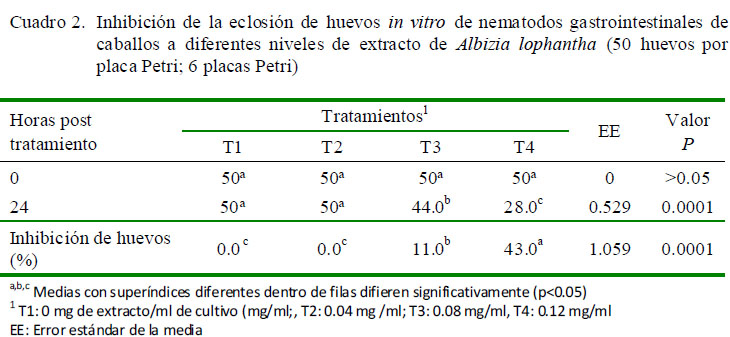
Se encontró 43 y 11% de inhibición en la eclosión de huevos para T4 y T3, respectivamente, resultando diferencias significativas (p=0.0001) con respecto a los demás tratamientos (Cuadro 2).
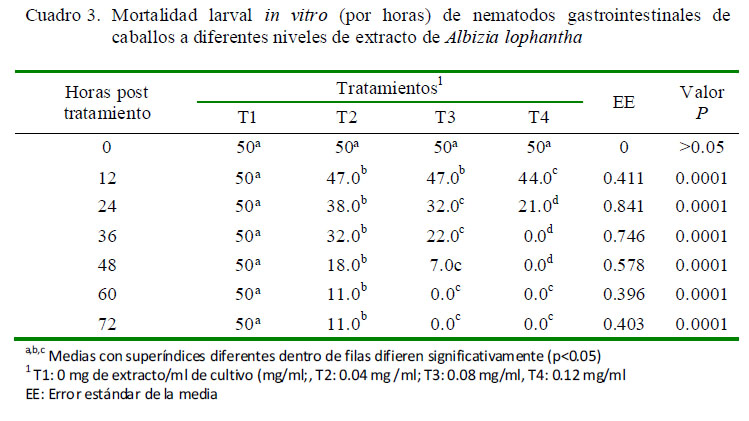
La mortalidad larval se presenta en el Cuadro 3. A partir de las 12 h, los grupos con dosis ascendentes del extracto de A. lophantha tuvieron mejores respuestas en comparación con el grupo control, T1 (p=0.0001). Asimismo, todas las larvas del T4 llegaron a morir a las 36 h, a diferencia de los demás tratamientos (p=0.0001). La menor supervivencia larval en T3 y T2 se observó a las 60 h (Cuadro 3).
DISCUSIÓN
El efecto del extracto de A. lophantha sobre la inhibición en la eclosión de huevos y la supervivencia larval de los NGI fue evidente en el estudio. El modo de acción se debe probablemente a la presencia de metabolitos secundarios (taninos y fenoles totales) en el extracto (Cuadro 1). Estos metabolitos tienen capacidad para formar complejos con las proteína de los parásitos (Alonzo-Díaz et al., 2010), lo que afecta la biología de los nematodos, interfiriendo con la eclosión de huevos, proceso de desenvaine y desarrollo larval (Iqbal et al., 2007).
Los resultados del presente estudio son consistentes con el trabajo de MarieMagdeleine et al. (2009) y HernandezVillegas et al. (2014), quienes observaron un efecto antihelmíntico en nematodos gastrointestinales en rumiantes utilizando extractos de plantas ricas en taninos.
CONCLUSIÓN
El extracto de Albizia lophantha mostró efectividad in vitro sobre la eclosión de huevos y la supervivencia de larvas de nematodos gastrointestinales de caballos.
LITERATURA CITADA
1. Alonso-Díaz MA, Torres-Acosta JFJ, Sandoval-Castro CA, Hoste H. 2010. Tannins in tropical tree fodders fed to small ruminants: a friendly foe? Small Rumin Res 89: 164-173. doi: 10.1016/j.smallrumres.2009.12.040. [ Links ]
2. Alonso-Díaz MA, Torres-Acosta JFJ, Sandoval-Castro CA, Capetillo-Leal C, Brunet S, Hoste H. 2008. Effects of four tropical tanniniferous plant extracts on the inhibition of larval migration and the exsheathment process of Trichostrongylus colubriformis infective stage. Vet Parasitol 153: 187-192. doi: 10.1016/j.vetpar.2008.01.011 [ Links ]
3. Brunet S, Fourquaux I, Hoste H. 2011. Ultrastructural changes in the third-stage, infective larvae of ruminant nematodes treated with sainfoin (Onobrychis viciifolia) extract. Parasitol Int 60: 419-424. doi: 10.1016/j.parint.2010.09.011 [ Links ]
4. Castillo M, Quinatoa E, Risco D, Arnelas I. 2014. Preliminary phytochemical screening of some Andean plants. Int J Pharm Sci Rev Res 28: 35-37. [ Links ]
5. Hernandez-Villegas M, Pérez-Pérez C, de la Cruz-Burelo P, Hernández-Bolio G, Bolio-López G. 2014. In vitro anthelmintic effect of methanolic leaf extract of Gliricidia sepium against gastrointestinale nematodes of sheep. Trop Subtrop Agroecosyst 17: 105-111 [ Links ]
6. Iqbal Z, Sarwar M, Jabbar A, Ahmed S, Nisa M, Sajid MS, Khan MN, et al. 2007. Direct and indirect anthelmintic effects of condensed tannins in sheep. Vet Parasitol 144: 125-131. doi: 10.1016/j.vetpar.2006.09.035 [ Links ]
7. Marie-Magdeleine C, Hoste H, Mahieu M, Varo H, Archimede H. 2009. In vitro effects of Cucurbita moschata seed extracts on Haemonchus contortus. Vet Parasitol 161: 99-105. doi: 10.1016/j.vetpar.2008.12.008 [ Links ]
Recibido: 2 de febrero de 2016
Aceptado para publicación: 16 de mayo de 2016